磷酸川芎嗪对血管紧张素Ⅱ诱导的H9c2细胞肥大的影响及其机制的研究
李春红 王婕 吴爱明 陈慧洋 张婷 马喆 高永红 娄利霞
[摘要] 目的 探討磷酸川芎嗪对血管紧张素Ⅱ(AngⅡ)诱导的H9c2细胞肥大的影响及可能机制。 方法 以AngⅡ诱导的H9c2细胞肥大为模型,将细胞随机分为对照组、模型组、磷酸川芎嗪组、磷酸川芎嗪+NE-100组、NE-100组。采用罗丹明标记的鬼笔环肽染色,观察细胞面积的变化;Fura-2 AM法测定细胞内Ca2+浓度变化;Western blot法检测Sigma-1受体(Sig-1R)、三磷酸肌醇受体(IP3R)与钙调神经磷酸酶(calcineurin,CaN)的蛋白表达水平。 结果 给予磷酸川芎嗪干预可以抑制AngⅡ诱导的细胞面积增加(P < 0.05),这种抑制作用可以被Sig-1R抑制剂NE-100阻断(P < 0.05);同时,磷酸川芎嗪干预可以抑制AngⅡ诱导的BNP mRNA表达水平的增高(P < 0.05)。AngⅡ孵育降低Sig-1R的蛋白表达水平(P < 0.05),磷酸川芎嗪有恢复Sig-1R蛋白表达水平的趋势(P > 0.05);磷酸川芎嗪干预可明显降低AngⅡ诱导的IP3R蛋白水平的增加(P < 0.05),NE-100阻断了这种作用(P < 0.05);但磷酸川芎嗪干预对AngⅡ诱导的CaN蛋白表达水平的增加无明显抑制作用(P > 0.05)。此外,磷酸川芎嗪可以抑制AngⅡ引起的H9c2细胞内Ca2+含量的增加,NE-100阻断了这种作用(P < 0.05)。 结论 磷酸川芎嗪对心肌细胞肥大有抑制作用,其机制可能与其通过Sig-1R干预IP3R的表达,影响细胞内钙平衡有关。
[关键词] 心肌细胞肥大;磷酸川芎嗪;Sigma-1受体;钙调节
[中图分类号] R285.5 [文献标识码] A [文章编号] 1673-7210(2019)05(b)-0004-05
[Abstract] Objective To investigate the effects of ligustrazine phosphate (ligu) on hypertrophy of H9c2 cells induced by angiotensin Ⅱ (Ang Ⅱ) and its possible mechanism. Methods H9c2 cells hypertrophy induced by Ang Ⅱ was used as a model. The cells were randomly divided into control group, model group, ligustrazine phosphate group, ligustrazine phosphate + NE-100 group and NE-100 group. Rhodamine-Phalloidin staining was used to observe the changes of cell area; Fura-2 AM was used to determine the changes of intracellular Ca2+ concentration; Western blot was used to detect the expression of Sigma-1 receptor (Sig-1R), calcineurin (CaN) and inositol 1, 4, 5-trisphosphate receptor (IP3R). Results Ligustrazine phosphate could inhibit the increase of cell area induced by Ang Ⅱ (P < 0.05), which could be blocked by NE-100, a Sig-1R inhibitor (P < 0.05), and Ligustrazine phosphate could inhibit the increase of BNP mRNA level induced by Ang Ⅱ (P < 0.05). Ang Ⅱ incubation decreased the expression level of Sig-1R protein (P < 0.05), ligustrazine phosphate had a tendency to restore the expression level of Sig-1R protein (P > 0.05); ligustrazine phosphate intervention could significantly reduce the increase of IP3R protein level induced by Ang II (P < 0.05), NE-100 blocked the effect (P < 0.05); but ligustrazine phosphate intervention had no effect on the increase of CaN induced by Ang Ⅱ (P > 0.05). In addition, ligustrazine phosphate inhibited the increase of intracellular Ca2+ in H9c2 cells induced by Ang Ⅱ, which was blocked by NE-100 (P < 0.05). Conclusion Ligustrazine phosphate inhibits cardiomyocyte hypertrophy by interfering with the expression of IP3R through Sig-1R and affecting intracellular calcium balance.
[Key words] Cardiomyocyte hypertrophy; Ligustrazine phosphate; Sigma-1 receptor; Calcium regulation
近年来,我国心力衰竭的患病率持续增加,病死率居高不下[1-3],而临床上对心力衰竭的治疗并无大的突破。心肌肥大是启动心力衰竭的病理过程及心力衰竭的重要促进因素。心肌肥大的早期,心室壁增厚、心肌收缩功能改善,为代偿性过程。在持久病理性应激情况下,心肌肥大伴随着间质纤维化、收缩功能失调以及基因表达、能量代谢和电生理特征的异常,最终导致了失代偿性心力衰竭[4]。AngⅡ是肾素-血管紧张素系统的主要活性成分,其在心肌肥大中发挥重要作用。抑制AngⅡ相关的心肌肥大对防治心力衰竭具有重要意义[5]。
中医认为,气虚血瘀为心力衰竭的基本证候[6],因此益气活血法作为中医治疗心力衰竭的主要治法,贯穿心力衰竭治疗的始终。从益气活血方的活血药川芎中提取的主要活性成分川芎嗪,研究显示具有扩张血管、抑制血小板聚集、防止血栓形成、改善脑缺血等作用[7]。同时,体外实验研究[8-9]表明,川芎嗪抑制AngⅡ诱导的心肌细胞肥大,并认为其机制可能与其保护线粒体结构和功能及抑制心肌细胞内NF-κB途径有关。集中分布于线粒体相关内质网膜(mitochondrion-as-sociated ER membrane,MAM)的Sig-1R是内质网中主要的分子伴侣[10-11],在心脏中有相对较高的表达[12-13]。研究[14]显示,Sig-1R具有心肌细胞保护作用,能够改善心脏肥大和心力衰竭。本研究旨在探讨磷酸川芎嗪是否能通过干预Sig-1R信号通路抑制AngⅡ诱导的H9c2细胞肥大。
1 材料与方法
1.1 材料
大鼠H9c2心肌细胞系购自中国医学科学院基础医学研究所国家实验细胞资源共享服务平台。DMEM、胎牛血清以及胰蛋白酶购自美国Gibco公司。AngⅡ(ANGT-003)购自中国杭州中肽生化有限公司,磷酸川芎嗪购自中国药品生物制品检定所,NE-100(SML6031)购自美国Sigma公司。Trizol购自美国Invitrogen公司,反转录试剂盒(K1622)购自美国Thermo公司,定量PCR试剂盒购自ABI公司,所用引物由北京诺赛基因组研究中心有限公司合成。罗丹明标记的鬼笔环肽染液(CA1610)购自北京索莱宝科技有限公司。Sig-1R一抗(15168-1-AP)与GAPDH一抗(10149-1-AP)购自美国Proteintech公司,β-actin一抗(ab8227)购自英国Abcam公司,IP3R一抗(11217)购自美国Santa Cruz公司,CaN一抗(2614S)购自美国CST公司。全蛋白提取试剂盒(KGP250)与BCA蛋白含量检测试剂盒(KGP902)购自江苏凯基技术生物有限公司。Fura-2AM试剂盒(S1052)购于上海碧云天生物技术有限公司。其他试剂为市售分析纯试剂。
1.2 仪器
千分之一电子天平(上海精密科学仪器有限公司,JA1003N型);4℃离心机(上海沪粤明科学仪器有限公司,TGL-16G);Gene Quant紫外分光光度计(Phar-macia Biotech公司);基因扩增仪GeneAmp PCR System 9700(美国ABI公司,Applied Biosystems);实时荧光定量PCR仪Mx3000P(美国安捷伦科技公司);激光共聚焦显微镜(日本奥林巴斯公司,FV1000)。
1.3 实验方法
1.3.1 细胞培养及分组 大鼠H9c2心肌细胞系在含有10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基中置于37℃ CO2孵育箱培养。长至80%~90%时去上清,加入无血清的DMEM培养基,细胞分为5组:①对照组:常规培养;②模型组:AngⅡ孵育,浓度为1 μmol/L;③磷酸川芎嗪组:AngⅡ孵育浓度为1 μmol/L,磷酸川芎嗪浓度为100 μmol/L;④磷酸川芎嗪+NE-100组:AngⅡ孵育浓度为1 μmol/L,磷酸川芎嗪浓度为100 μmol/L,Sig-1R抑制剂NE-100浓度为10 μmol/L;⑤NE-100組:NE-100浓度为10 μmol/L。不同处理组细胞孵育48 h后进行检测。
1.3.2 罗丹明标记的鬼笔环肽染色测定细胞面积 根据试剂说明书操作。不同组细胞去上清,37℃预热的1×PBS(pH 7.4)清洗细胞2次,4%甲醛溶液室温固定10 min,PBS清洗细胞2次,每次10 min。0.5%Triton X-100溶液透化处理5 min,PBS清洗细胞3次,每次10 min。取配制好的100 nm的TRITC标记鬼笔环肽工作液,覆盖住细胞,室温避光孵育30 min,PBS清洗细胞3次,每次10 min。DAPI溶液(浓度:100 nmol/L)对细胞核进行复染约30 s,PBS清洗细胞3次,每次10 min。选择TRITC激发/发射滤片(Ex/Em=540/570 nm)和DAPI激发/发射滤片(Ex/Em=364/454 nm),共聚焦显微镜下进行荧光观察。
1.3.3 RNA提取和RT-PCR 细胞去上清,PBS洗3次,吸干所有液体,加Trizol裂解细胞。加氯仿室温震荡3 min,4℃ 12 000 r/min离心15 min,取上清加异丙醇冰上放置5 min后4℃ 12 000 r/min离心10 min,弃上清加75%乙醇洗沉淀,4℃ 12 000 r/min离心5 min弃上清,室温晾干,加入DEPC处理H2O冰上溶解,紫外分光光度计测定RNA浓度和纯度。取1 μg总RNA,在oligo(dT)15和M-MuLV反转录酶作用下反转录为cDNA。PCR反应体系为25 μL∶5 μL cDNA,5 μmol/L上下游引物各1 μL,2×PCR Mix 12.5 μL,H2O 5.5 μL。反应条件:94℃变性5 min,然后进行30次扩增反应:94℃ 30 s,57℃ 30 s,72℃延伸40 s,最后72℃延伸10 min。基因引物序列为:BNP上游引物5′-CAGAAGCTGCTGGAGCTGATA-3′,下游引物5′-TCCGGTCTATCTTCTGCCCA-3′;内参GAPDH上游引物5′-AGTTCAACGGCACAGTCAAG-3′,下游引物5′-TA-CTCAGCACCAGCATCACC-3′。
1.3.4 蛋白提取和Western blot检测目标分子蛋白表达水平的变化 收集细胞于1.5 mL EP管中,PBS清洗2遍。每管细胞(106个)加100 μL裂解液,用超声破碎仪裂解。4℃ 12 000 r/min离心15 min。收集上清,BCA法测蛋白定量。
配制10%聚丙烯酰胺凝胶。电泳至溴酚蓝指示剂到达预制胶底部,停止电泳。蛋白转膜至NC膜,5%脱脂奶粉中室温封闭1 h。一抗(GAPDH:1∶5000;β-actin:1∶5000;GAPDH:1∶5000;Sig-1R:1∶200;CaN:1∶200;IP3R:1∶500)4℃孵育过夜;TBST洗膜10 min,连续3次;二抗(1∶8000)室温孵育1 h,TBST洗膜10 min,连续3次。ECL化学发光,凝胶成像仪进行扫膜成像,image J软件进行图像分析,分析蛋白灰度值,以GAPDH为内参。
1.3.5 Furu-2 AM法测定不同处理组H9c2细胞的Ca2+含量 大鼠H9c2心肌细胞系细胞经不同处理分组培养48 h后,依据试剂盒说明操作。用D-Hank′s溶液洗涤细胞3次,加入Fura-2AM工作液,37℃细胞培养箱孵育60 min。除去Fura-2AM工作液,用D-Hank′s溶液洗涤,并37℃培养箱孵育20~30 min,用酶标仪检测吸光值。激发波长340 nm和380 nm,发射波长510 nm。以340 nm和380 nm下的吸光度比值作为细胞内Ca2+相对含量。
1.4 统计学方法
采用SPSS 20.0软件进行分析,计量资料采用均数±标准差(x±s)表示,组间比较采用t检验,多组比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 磷酸川芎嗪对AngⅡ诱导的H9c2细胞面积的影响
不同处理组细胞孵育48 h后,采用罗丹明标记的鬼笔环肽染色,共聚焦显微镜检测细胞面积的变化。结果发现,与对照组比较,模型组细胞面积显著增加(P < 0.05);给予磷酸川芎嗪干预后,与模型组比较,细胞面积显著降低(P < 0.05);加用Sig-1R抑制剂NE-100后,与磷酸川芎嗪组比较,细胞面积显著增加(P < 0.05)。由结果可知,AngⅡ孵育可以增加细胞面积,给予磷酸川芎嗪干预可以抑制AngⅡ诱导的细胞面积的增加,同时这种抑制作用可以被NE-100阻断。见图1(封四)。
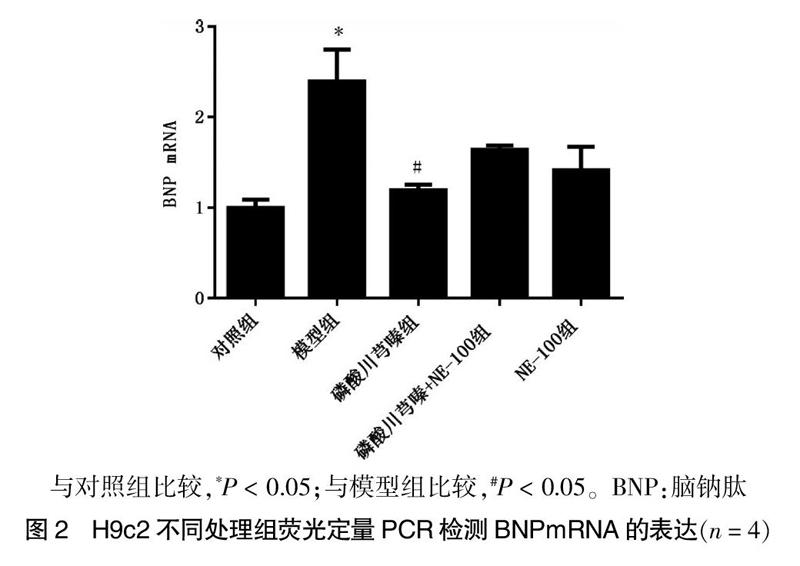
2.2 磷酸川芎嗪对AngⅡ诱导的H9c2细胞肥大中BNPmRNA表达的影响
大鼠H9c2心肌细胞系经不同处理分组培养48 h后,提取总RNA,然后进行反转录,经荧光定量PCR检测目的基因的表达变化。结果发现AngⅡ孵育48 h后可以导致BNPmRNA表达显著升高,磷酸川芎嗪能对此产生明显的抑制作用(P < 0.05),给予NE-100可以部分阻断这种抑制作用(P > 0.05)。见图2。
与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。BNP:脑钠肽
图2 H9c2不同处理组荧光定量PCR检测BNPmRNA的表达(n = 4)
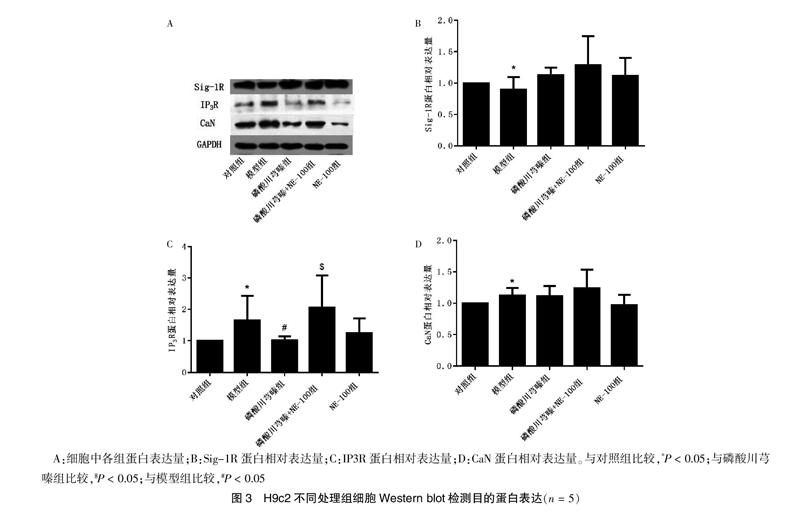
2.3 磷酸川芎嗪对AngⅡ诱导的H9c2细胞中各目的蛋白表达的影响
大鼠H9c2心肌细胞系经不同处理分组培养48 h后,提取总蛋白。进行免疫杂交,检测目的蛋白表达水平变化。结果发现AngⅡ孵育降低Sig-1R的蛋白表达水平(P < 0.05),磷酸川芎嗪有恢复其表达的趋势(P > 0.05);钙离子通道蛋白IP3R在AngⅡ诱导后表达增加,给予磷酸川芎嗪显著抑制其表达的增加(P < 0.05),NE-100可以阻断这种抑制作用(P < 0.05);同时心肌细胞肥大标志性蛋白CaN在AngⅡ诱导后增高(P < 0.05),磷酸川芎嗪对CaN蛋白表达的抑制作用不明显(P > 0.05)。见图3。
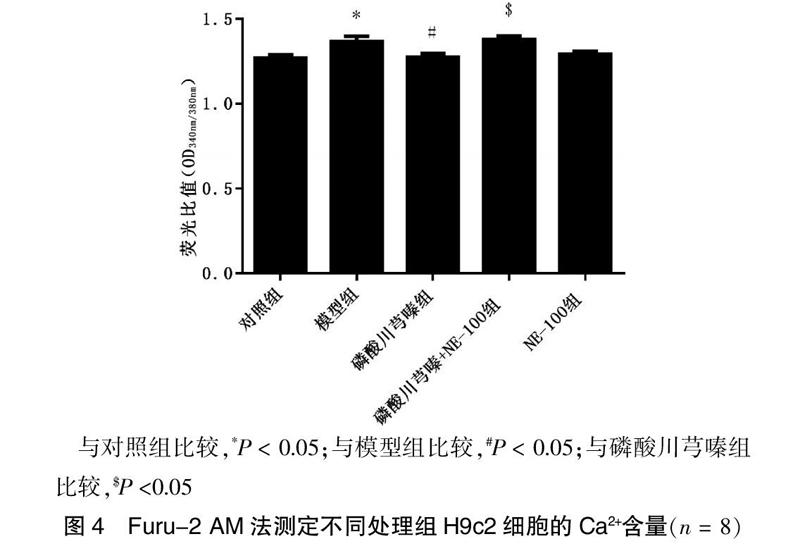
2.4 Furu-2 AM法测定不同处理组H9c2细胞的Ca2+含量
大鼠H9c2心肌细胞系经不同处理分組培养48 h后,依据Furu-2 AM试剂盒说明操作,检测细胞内Ca2+相对含量。结果发现,与对照组比较,模型组细胞Ca2+含量显著增加(P < 0.05);磷酸川芎嗪可以抑制AngⅡ诱导的H9c2细胞内Ca2+含量的增加,NE-100阻断了这种作用(P < 0.05)。见图4。
3 讨论
在心脏中,持续的病理应激导致收缩期心肌细胞Ca2+增加[15],产生病理性心肌细胞肥大。研究表明,Sig-1R是应激损伤时细胞内亚细胞器间信号调节的重要分子伴侣,是细胞维持存活体系的关键[16]。近年来研究证实,Sig-1R作为内质网重要的分子伴侣[10],可通过调节细胞内的Ca2+转运通路,改善心肌细胞功能障碍,从而抑制心肌肥大的发生发展[17],促进细胞存活[18]。Sig-1R可介导快速Ca2+内流和细胞内Ca2+动员,使细胞内Ca2+增加[19]。内质网的Ca2+损失可以将Sig-1R从与GRP78的相互作用中释放出来,使其与其他蛋白质产生相互作用[18]。Sig-1R通过IP3R调节细胞内Ca2+浓度,抑制细胞内Ca2+过载,减轻心肌肥大和功能障碍[17,20-21]。已有研究[22]发现,在心力衰竭的人心肌细胞中,IP3R表达增加,而IP3R介导的Ca2+释放可部分通过CaN依赖性机制调节心脏肥大[23]。
我们的前期在体动物研究表明,益气活血方药可显著改善心肌梗死后心力衰竭大鼠心脏重构和心脏功能,其机制与调节心肌梗死后心肌组织Sig-1R及相关分子的表达有关[24]。故本研究以体外培养的H9c2心肌细胞为研究对象,应用AngⅡ刺激,建立细胞肥大模型,应用益气活血方药中有效成分川芎嗪干预,探讨其对AngⅡ诱导的心肌细胞肥大的保护作用及与Sig-1R相关的机制。结果表明,磷酸川芎嗪能减轻AngⅡ诱导的H9c2心肌细胞肥大,抑制心肌肥厚分子标志物BNP的mRNA表达增加,而NE-100可部分阻断其抑制作用。证实磷酸川芎嗪减轻AngⅡ诱导的H9c2心肌细胞肥大的部分机制与磷酸川芎嗪增加了心肌细胞中Sig-1R的表达有关。其次,本研究证实,磷酸川芎嗪可以通过Sig-1R干预IP3R的表达影响细胞内钙平衡,抑制心肌细胞肥大,这种保护作用可能与CaN依赖的信号通路密切相关。
總之,本研究利用AngⅡ诱导的H9c2细胞肥大模型,通过给予磷酸川芎嗪及NE-100,检测细胞面积及细胞内Ca2+浓度变化,以及Sig-1R、IP3R和CaN蛋白的表达,证实磷酸川芎嗪对心肌细胞肥大的抑制作用,其机制可能与其通过Sig-1R干预IP3R的表达,影响细胞内钙平衡有关。
[参考文献]
[1] 金雪娟,周京敏,葛均波.心力衰竭流行病学的研究进展[J].中国临床医学,2013,20(6):852-855.
[2] 黄峻.中国心力衰竭流行病学特点和防治策略[J].中华心脏与心律电子杂志,2015,3(2):2-3.
[3] 邱伯雍,王永霞.慢性心力衰竭流行病学及防治研究进展[J].中华实用诊断与治疗杂志,2017,31(6):619-621.
[4] Gardin JM,Lauer MS. Left ventricular hypertrophy:the next treatable,silent killer?[J]. JAMA,2004,292(19):2396-2398.
[5] Frey N,Katus HA,Olson EN,et al. Hypertrophy of the heart: a new therapeutic target?[J]. Circulation,2004,109(13):1580-1589.
[6] 陈可冀,吴宗贵,朱明军,等.慢性心力衰竭中西医结合诊疗专家共识[J].心脑血管病防治,2016,16(5):340-347.
[7] 罗伟华.川芎嗪的临床应用及其制剂研究进展[J].中国现代药物应用,2017,11(18):191-193.
[8] 于妍,王硕仁,孙逸坤,等.川芎嗪在逆转心肌细胞肥大过程中对心肌细胞线粒体结构和功能的影响[J].中国中西医结合杂志,2012,32(5):661-665.
[9] 杨爽,杨凯,陆莹,等.川芎嗪对血管紧张素Ⅱ诱导心肌细胞肥大的影响[J].中国动脉硬化杂志,2010,18(5):355-357.
[10] Su TC,Lin SH,Lee PT,et al. The sigma-1 receptor-zinc finger protein 179 pathway protects against hydrogen peroxide-induced cell injury [J]. Neuropharmacology,2016, 105:1-9.
[11] Hayashi T,Rizzuto R,Hajnoczky G,et al. MAM:more than just a housekeeper [J]. Trends Cell Biol,2009,19(2):81-88.
[12] Bhuiyan MS,Tagashira H,Shioda N,et al. Targeting sigma-1 receptor with fluvoxamine ameliorates pressure-overload-induced hypertrophy and dysfunctions [J]. Expert Opin Ther Targets,2010,14(10):1009-1022.
[13] Ela C,Barg J,Vogel Z,et al. Sigma receptor ligands modulate contractility,Ca++ influx and beating rate in cultured cardiac myocytes [J]. J Pharmacol Exp Ther,1994, 269(3):1300-1309.
[14] Tagashira H,Bhuiyan S,Shioda N,et al. Sigma1-receptor stimulation with fluvoxamine ameliorates transverse aortic constriction-induced myocardial hypertrophy and dysfunction in mice [J]. Am J Physiol Heart Circ Physiol,2010,299(5):H1535-H1545.
[15] Houser SR,Molkentin JD. Does contractile Ca2+ control calcineurin-NFAT signaling and pathological hypertrophy in cardiac myocytes?[J]. Sci Signal,2008,1(25):pe31.
[16] Tsai SY,Hayashi T,Mori T,et al. Sigma-1 receptor chaperones and diseases [J]. Cent Nerv Syst Agents Med Chem,2009,9(3):184-189.
[17] Tagashira H,Bhuiyan MS,Shioda N,et al. Fluvoxamine rescues mitochondrial Ca2+ transport and ATP production through sigma(1)-receptor in hypertrophic cardiomyocytes [J]. Life Sci,2014,95(2):89-100.
[18] Hayashi T,Su TP. Sigma-1 receptor chaperones at the ER-mitochondrion interface regulate Ca2+ signaling and cell survival [J]. Cell,2007,131(3):596-610.
[19] Urani A,Romieu P,Portales-Casamar E,et al. The antidepressant-like effect induced by the sigma(1)(sigma(1)) receptor agonist igmesine involves modulation of intracellular calcium mobilization [J]. Psychopharmacology(Berl),2002,163(1):26-35.
[20] Chen W,An P,Quan XJ,et al. Ca(2+)/calmodulin-dependent protein kinase Ⅱ regulates colon cancer proliferation and migration via ERK1/2 and p38 pathways [J]. World J Gastroenterol,2017,23(33):6111-6118.
[21] Tagashira H,Bhuiyan MS,Fukunaga K. Diverse regulation of IP3 and ryanodine receptors by pentazocine through sigma1-receptor in cardiomyocytes [J]. Am J Physiol Heart Circ Physiol,2013,305(8):H1201-H1212.
[22] Go LO,Moschella MC,Watras J,et al. Differential regulation of two types of intracellular calcium release channels during end-stage heart failure [J]. J Clin Invest,1995, 95(2):888-894.
[23] Nakayama H,Bodi I,Maillet M,et al. The IP3 receptor regulates cardiac hypertrophy in response to select stimuli [J]. Circ Res,2010,107(5):659-666.
[24] 王婕,吳爱明,李春红,等.益气活血方对大鼠心肌梗死边缘区Sigma-1R、SERCA2a、IP3R mRNA表达的影响[J].中西医结合心脑血管病杂志,2018,16(9):1180-1184.
(收稿日期:2019-01-22 本文编辑:金 虹)

