胶质瘤干细胞和胶质瘤间充质干细胞原代培养的一种新方法*
岑梓文, 陈芙蓉, 王静, 柯超, 陈银生, 陈忠平△, 冯冰虹
1广东药科大学药学院(广东广州 510006); 2中山大学肿瘤防治中心、华南肿瘤学国家重点实验室、肿瘤医学协同创新中心神经外科/神经肿瘤科(广东广州 510060)
胶质瘤是最常见的原发脑肿瘤,呈弥漫性、浸润性增长,预后一般,高级别的胶质瘤容易复发[1]。越来越多的研究表明胶质瘤干细胞(glioma stem cell,GSCs)在肿瘤发生、维持、转移与复发以及耐药过程中均发挥着关键性作用[2]。GSCs能对抗胶质瘤的治疗,是胶质瘤细胞的一个特定亚群,具有肿瘤干细胞的特性,如无限的自身克隆能力,分化和对化疗和放疗的抵抗力,并表现出非常强的DNA修复能力[3]。GSCs高度表达CD133、Sox2和Nestin肿瘤干性等分子标志物[4]。Hossain等[5]的研究表明,肿瘤性间充质干细胞(mesenchymal stem cell,MSCs)是胶质瘤中的潜在的新基质成分,可驱动GSCs的侵袭性,抑制MSCs的生长是胶质瘤治疗中的一种新型靶点。还有Lim等[6]的研究表明,肿瘤源性MSCs与GSCs共培养能增强其耐药性,它对胶质瘤的进展有着促进的作用。为了研究GSCs和MSCs在胶质瘤中促进生长、耐药等问题中的作用和机制,必须先分离筛选这类细胞。在此,我们收集多例高级别胶质瘤手术标本,成功进行GSCs和MSCs的原代培养,并详细介绍了GSCs与MSCs的鉴定方法及结果。
1 材料与方法
1.1 材料 2017年3月至2019年3月期间,我们共对取自中山大学肿瘤防治中心的62例高级别胶质瘤手术标本进行GSCs和MSCs的原代培养。手术标本对应患者的纳入标准:(1)影像学和术后病理诊断为胶质瘤,WHO Ⅲ级及以上;(2)原发性或继发性胶质瘤;(3)年龄18岁及以上,男女不限。排除标准:HIV阳性。
BALB/c-nu裸鼠,4周龄,18~22 g,雌性,由北京维通利华公司提供,于中山大学(北校区)动物中心SPF条件饲养。本研究获得患者的知情同意,取得了伦理委员会对开展相关人体以及动物实验的批准,并遵循中山大学实验动物管理与使用的规定。
1.2 主要试剂 (1)GSCs培养基:DMEM/F12培养基(Gibco,美国),2%神经元细胞添加剂B-27(Gibco,美国)、20 ng/mL表皮细胞生长因子(EGF)(PeproTech,美国)及20 ng/mL碱性成纤维细胞生长因子(b-FGF)(PeproTech,美国);(2)间充质干细胞培养基:含L-谷氨酰胺的MEM培养基(Corning,美国),10%胎牛血清(FBS)(Corning,澳大利亚);(3)其他:Ⅱ型胶原酶(Invitrogen,美国),干细胞消化酶(Accutase)(Corning,美国),0.25%胰酶(Gibco,中国),纤维粘连蛋白(Fibronectin,Fib)(Corning,美国),小鼠抗人CD133、GFAP、Ⅲ β-tubulin、Nestin和兔抗人Sox-2抗体(Abcam,美国),间充质干细胞三系分化试剂盒(Lonza,美国),茜素红染液,阿利斯蓝染液和油红O染液(谷歌生物,中国)。
1.3 方法
1.3.1 胶质瘤细胞的原代培养 手术台上取新鲜胶质瘤标本,冰上运输至超净台里,使用灭菌消毒后的眼科剪刀将标本剪碎至糊状,生理盐水轻轻漂洗;去上清后加入Ⅱ型胶原酶,置于37℃培养箱消化,适时吹打均匀直到大部分组织块状物溶解消失为止,加入含血清培养基终止消化后将70 μm的细胞过滤器过筛,分成2份,400×g离心后去掉上清。分别加入GSCs培养基和MSCs培养基,重悬得单细胞悬液并种板于培养皿;48 h后更换培养基,显微镜观察细胞的生长情况和细胞密度,适时传代。GSCs使用干细胞消化酶消化传代,MSCs使用0.25%胰酶消化传代。
1.3.2 GSCs的免疫荧光鉴定 取GSCs种于已涂布Fib的24孔板;过夜贴壁后4%多聚甲醛固定,山羊血清封闭,分别孵育CD133、GFAP、Ⅲ β-tubulin、Nestin和Sox-2一抗过夜;PBS洗3次后避光孵育对应种属的荧光二抗;PBS洗3次后染DAPI;加入防淬灭试剂后于荧光显微镜观察并拍摄图像。
1.3.3 GSCs的成瘤鉴定 取生长良好,光泽通亮的GSCs,加入干细胞消化酶为单细胞悬液,显微计数,调整细胞密度为1×106个/mL;取0.1 mL皮下注射于裸鼠腋下,注射细胞数为1×105个/只裸鼠,共3只裸鼠,观察肿瘤出现时间,游标卡尺测量肿瘤大小。
1.3.4 MSCs的三系分化鉴定 取生长良好的MSCs,0.25%胰酶消化,终止消化后种板于24孔板;过夜贴壁后换液,分别加入成骨、成软骨、成脂肪条件分化培养基,分别设立对照组,为MSCs培养基培养,每3 d换液;4周后,去除培养基,PBS洗3次,4%多聚甲醛固定,成骨组加入茜素红染色,成软骨组加入阿利斯蓝染色,成脂肪组加入油红O染色5 min,对照组亦分别染色;PBS洗3次后,显微观察并拍摄图片。
2 结果
2.1 原代培养结果 在62例手术标本中, WHO Ⅲ级胶质瘤22例,WHOⅣ级胶质瘤40例。能培养出同源GSCs和MSCs的标本13例,均为WHO Ⅳ级胶质瘤,其中病理诊断为原发性7例,继发性6例。
2.2 GSCs和MSCs的形态 GSCs为成球形态,悬浮生长,细胞光泽明亮通透;MSCs为大部分纺锤形,小部分圆形贴壁生长,与普通胶质瘤形态类似,伪足较长。见图1。目前两种细胞已经能稳定传至30代,本研究实验使用15代以上的细胞。
2.3 GSCs的免疫荧光鉴定 本研究患者来源的细胞以GSCs选择性培养基培养后,使用免疫荧光技术检测,目的蛋白分子使用荧光二抗(绿色)标记。结果检测出该细胞高度表达干性分子标记CD133、SOX-2、Nestin,低表达分化标记GFAP和Ⅲ β-tubulin,蓝色DAPI染核。见图2。
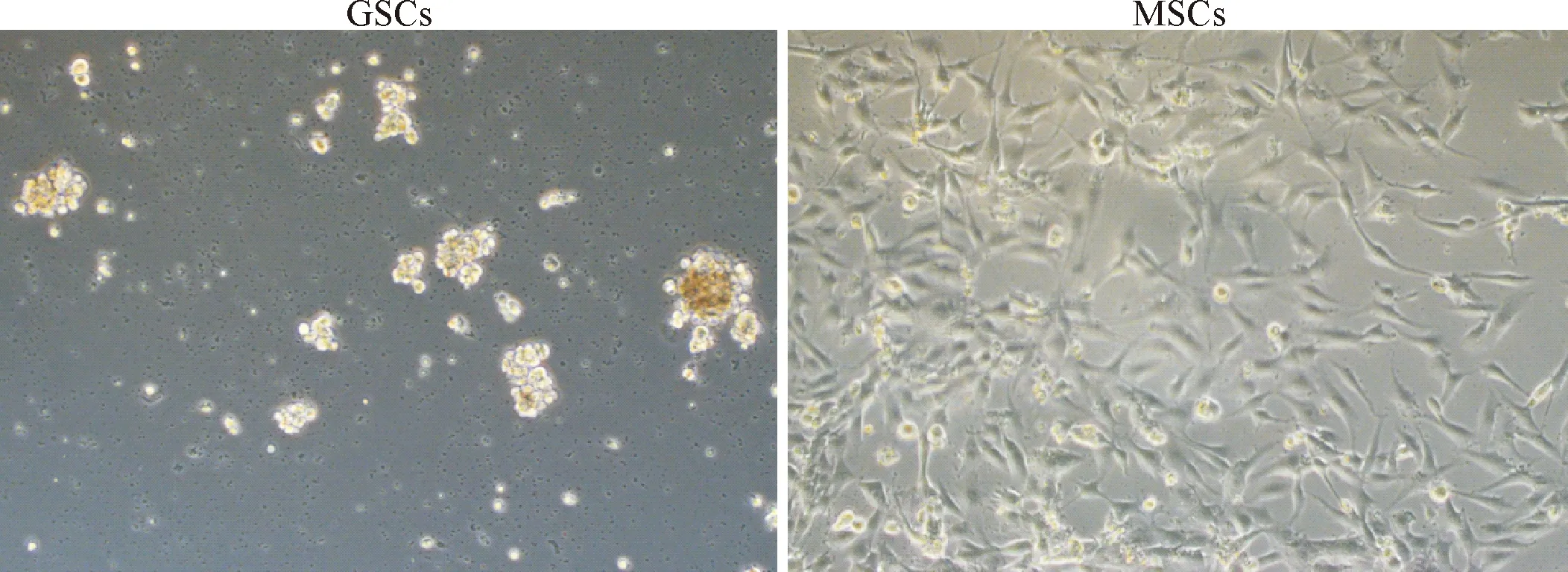
图1 GSCs和MSCs的形态(×100)
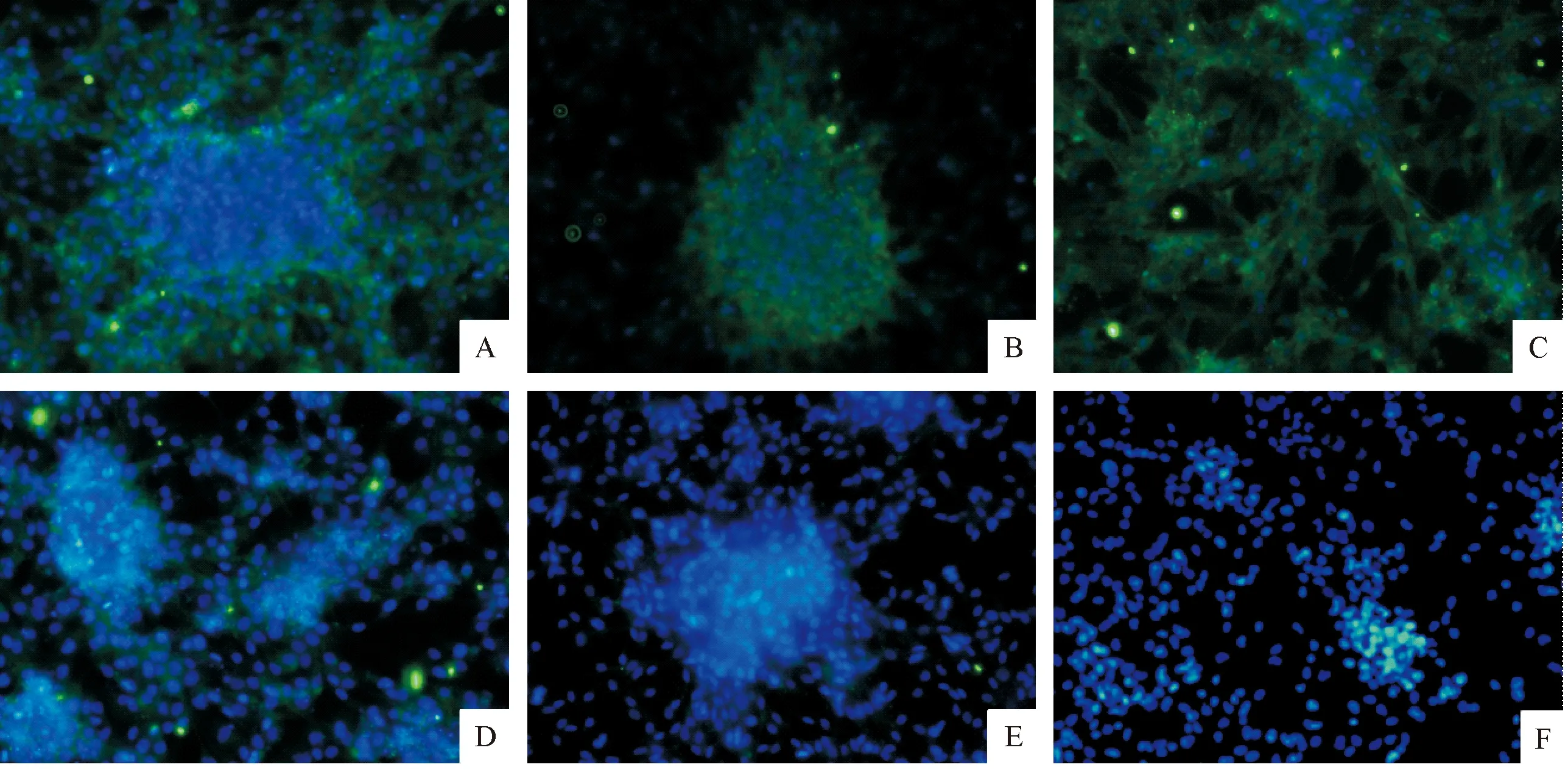
A:CD133;B:SOX-2;C:Nestin;D:GFAP;E:Ⅲ β-tubulin;F:空白对照
2.4 GSCs的成瘤鉴定 动物实验结果表明,皮下注射1×105原代培养的GSCs,3只裸鼠在6周后都形成肿瘤,最大径为(0.7±0.3)cm。
2.5 MSCs的三系分化鉴定 鉴定结果表明,经过MSCs诱导分化试剂盒诱导后,肿瘤源性MSCs成功分化为骨细胞、软骨细胞和脂肪细胞。见图3。
3 讨论
由于胶质瘤浸润性生长,血脑屏障的存在,耐药性及容易复发等特点,目前胶质瘤的治疗形势不容乐观[7],因此寻求新的治疗方法十分重要。越来越多的证据表明[8],GSCs的存在是胶质瘤难以治疗的重要因素。GSCs能通过调节肿瘤微环境[9],促进肿瘤血管生成[10]等原因驱动胶质瘤的发展。最近的研究表明,肿瘤性MSCs通过促进GSCs的生长进而促进胶质瘤的发展[11]。因此,研究GSCs和MSCs是研究治疗胶质瘤的重要方向。
研究GSCs和MSCs的首要步骤,需要先从肿瘤细胞中分离并筛选这类肿瘤干细胞,国内外已经报道了胶质瘤原代培养的方法,如胶质瘤组织培养法[12]和胰酶消化法[13]等,但是这些方法只能短期培养而不能稳定传代以满足实验要求。以往本实验室中传统GSCs的原代培养诱导方法成功率比较低,2010—2016年间42例高级别(Ⅲ和Ⅳ级各半)胶质瘤手术标本中有2例Ⅳ级成功培养出GSCs,成功率只有不到5%。在使用传统方法对Ⅲ级或是Ⅳ级胶质瘤标本进行原代培养时,胶质瘤细胞往往都会无法传代扩增细胞数或者数代以内大部分细胞会凋亡。本研究的GSCs诱导成功率与传统方法相比提高了4倍,超过20%。原代培养手段改善之处有:使用Ⅱ型胶原酶代替0.25%胰酶消化胶质瘤组织,并且在消化过程中及时吹打,使组织与胶原酶充分接触;使用干细胞消化酶Accutase代替0.25%胰酶在传代时消化细胞;如遇GSCs细胞球体积较大而难以消化成单细胞时,可将GSCs球接种与涂布Fib的培养皿上,待GSCs球会贴壁生长后轻轻吹打,可将球状结构吹散获得单细胞悬液以便传代或者冻存。GSCs的原代培养与诱导关键之处在于细胞的生长状态,胰酶对细胞蛋白的消化能力较大,而Ⅱ型胶原酶和Accutase对细胞的温和性大大提高,减少了对胶质瘤细胞表面蛋白的损伤,保证了细胞的生长状态。另外,我们对成功培养出GSCs的13例标本进行病理诊断分析,发现胶质瘤级别全部为Ⅳ级,在40例Ⅳ级胶质瘤标本总数中占32.5%,因此考虑个体差异也是一个很重要的影响因素,这可能与胶质瘤的恶性程度有关。我们得出结论,胶质瘤的恶性程度越高,才能更容易培养诱导出GSCs。因此,并不是每一个手术标本都能成功原代培养出GSCs,这可能是以往GSCs原代培养中失败率比较高的重要因素。
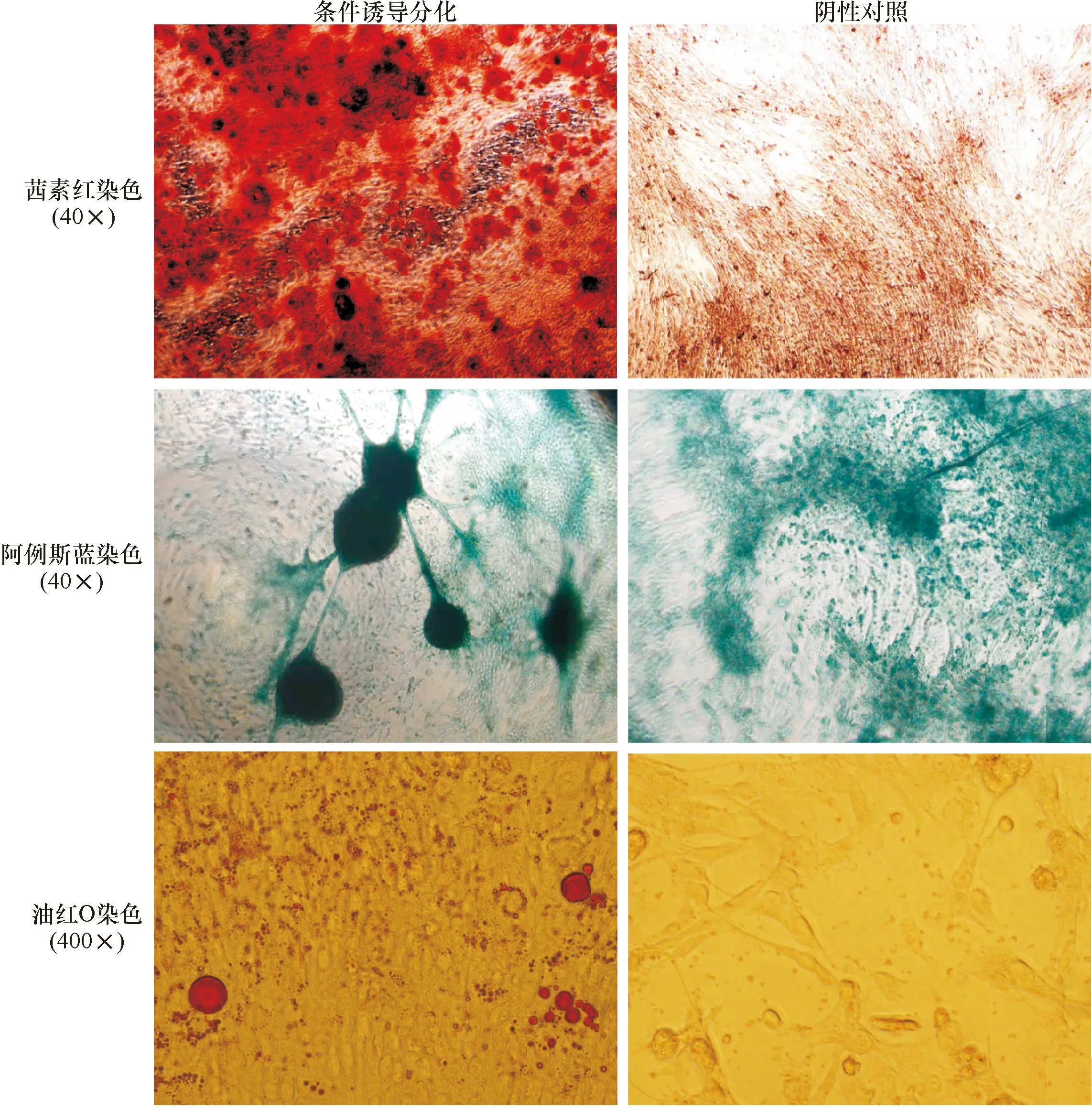
图3 MSCs的三系分化染色图
MSCs的原代培养则比GSCs相对容易,一般来说只要胶质瘤组织标本适合培养,就能培养出MSCs。目前国内外对胶质瘤源性MSCs的研究尚不多,尤其国内关于胶质瘤MSCs的报道颇少。国外研究表明[14],MSCs显示多效功能,其包括分泌具有与癌症进展有关的免疫抑制活性的可溶性因子,肿瘤源性的MSCs比正常组织的MSCs具有更强的免疫抑制性,并且影响自然杀伤细胞(natural killer,NK)功能和表型。肿瘤源性MSCs能通过促进GSCs生长,增强胶质瘤的对抗放疗和化疗的能力。因此,我们下一步的研究是MSCs和GSCs共培养的方向,研究MSCs如何改变GSCs的微环境,如GSCs的药敏实验中,使用MSCs贴壁培养24 h后的上清培养基,再测其相关蛋白的变化。国外有新的3D细胞培养研究方法[15],传统的2D细胞培养在研究癌症进展和转移以及筛选治疗候选物方面具有局限性,3D培养系统可以允许细胞彼此生长、迁移和相互作用,从而成为比2D平面培养模式更能模拟体内细胞生长环境的实验模型。MSCs除了能影响GSCs,还能调节一般肿瘤细胞的存活、增殖、迁移和耐药性以及MSCs对胶质瘤微环境免疫状态的影响方面的致病作用,所以我们不只研究MSCs对GSCs的作用,日后还会研究MSCs与胶质瘤非干细胞的作用。
本研究介绍了肿瘤源性MSCs的培养方法并分享了GSCs的改善培养方法。在62例标本的原代培养中,能培养出同源GSCs和MSCs的有13例,成功率达20.9%。GSCs的培养需使用无血清培养基因而培养难度较大,但是课题组使用最新并优化的原代培养技术将成功率提高。本研究不足之处在于有接近4/5的手术标本不能成功地原代培养出GSCs,其可能与标本是否高级别胶质瘤有关,后续研究我们将手术的纳入标准从WHO Ⅲ级及以上改为WHO Ⅳ级。本研究成功培养并鉴定出胶质瘤源性GSCs和MSCs,为将来在此基础上开展胶质瘤治疗方法探索的研究提供基础。

