Bt蛋白对杨扇舟蛾连续世代存活与发育的影响
王留成,刘 洁,高佳敏,孟丹阳,姚 彤,孙天骅,高宝嘉
(河北农业大学 林学院,河北保定 071000)
苏云金芽孢杆菌(Bacillusthuringiensis,Bt)是一种普遍存在的杆状芽孢杆菌,自1996年美国首次将转Bt杀虫蛋白基因作物商业化以来,在世界范围内迅速用作许多害虫的防范措施[1],Bt生物农药和转Bt基因作物大大提高了人们有效安全地管理农业害虫的能力,但是由于受Bt毒素强烈的时间和空间选择压力,多种鳞翅目害虫已经产生抗性[2-3],昆虫对Bt的抗性已经成为转基因作物最主要的生态风险,也是Bt作物持续长期有效的最大威胁[4-5]。
在全球范围内,已有大约17种昆虫在实验室中对Bt产生抗性,1种在田间表现出广泛的抗性,8个国家进行77项研究得出结论,由于更广泛的监测、Bt作物种植面积的增加以及暴露于Bt作物的害虫种群数量和累积暴露时间的上升,到2010年,13种主要害虫中有5种与Bt作物的田间进化抗性有关,其中有4种是毛虫,而2005年只有1种与Bt作物有关[6]。国内近年来也有诸多相关报道,如梁革梅等[7]通过室内筛选棉铃虫(Helicoverpaarmigera)16代后对转Bt基因棉的抗性上升43.3倍;杨峰山等[8]研究表明,小菜蛾(Plutellaxylostell)的Bt抗性品系在繁殖能力上存在显著的生存劣势;而陈建[9]以含Bt饲料饲养甜菜夜蛾(Spodopteraexigua)后认为,低浓度Bt对幼虫存活、生长发育和繁殖均未造成影响,甚至对成虫生殖有一定的促进作用;贺明霞等[10]也发现亚洲玉米螟(Ostriniafurnacalis)在不断提高的汰选压下其种群对Cry1Ie毒素的敏感性逐渐下降。这些昆虫与转基因作物的交互抗性研究为今后合理实施害虫抗性治理策略提供了重要依据。
在林业中昆虫与Bt交互抗性的研究主要是通过鳞翅目害虫的短期胁迫反应来评价转基因杨的抗虫性,如康薇[11]分析‘中嘉8号’转Bt基因杨的田间抗性及生物安全性,郑均宝等[12]、张炬红等[13]及王智等[14]分析转双抗虫基因‘741’杨(BtCry1Ac+API)的抗虫性,均表明转基因杨对靶标害虫具有良好的抗虫性。但刘军侠等[15]与宋晓英[16]基于SSR分析发现杨扇舟蛾(Closteraanachoreta)实验种群取食转基因杨后其遗传多样性有明显增高趋势,这些研究对转基因杨的可持续利用具有重要意义。而杨扇舟蛾是危害杨树生长期的主要食叶害虫,其1a可发生4~5代,产卵量大,虫口数量易在短期剧增,可将整株杨树的树叶吃光,在中国华北、东北及西北地区都有不同程度的虫灾发生[17-18],严重危害当地森林资源和生态安全。因此林业害虫在Bt胁迫下其连续世代生长发育的变化同样值得探讨。本试验以杨扇舟蛾为例,连续3代对其饲喂转基因‘Pb29’杨叶片及浸泡Cry1Ac杀虫蛋白原毒素的杨树叶片,明确Bt对杨扇舟蛾的长期杀虫活性与控制效果,发现昆虫对Bt的抗性产生规律和机制,为Bt的长期有效性、防止或延缓Bt抗性昆虫种群的发展提供研究基础。
1 材料与方法
1.1 试验材料与虫源
非转基因毛白杨无性系‘741’杨[Populusalba×(P.davidiana+P.simonii)]×P.tomentosa选自河北农业大学标本园;转基因‘741’杨高抗品系‘Pb29’为田颖川[19-20]、郑钧宝等[12]培育的转双抗虫基因[Bt杀虫蛋白基因(BtCry1Ac)+慈菇蛋白酶抑制基因(API)]无性系,选自河北农业大学标本园。采摘枝条中部的健康、新鲜叶片饲喂幼虫。
供试杨扇舟蛾幼虫及卵块采自河北省保定市郊区非转基因杨人工纯林,由于野采幼虫部分有寄生蜂寄生及杂菌感染,因此在养虫室用对照741杨树叶片培养F1代至羽化,随机交配产F2代孵化成幼虫,正常叶片饲养,3龄后用于试验。
所用BtCry1Ac原毒素购于北京美延农业科技有限公司,试验期间避免强烈阳光直射。
1.2 样品处理及昆虫饲养
‘741’杨和转基因‘Pb29’杨叶片处理前用蒸馏水清洗晾干。将BtCry1Ac原毒素以50 mmol/L的Na2CO3溶液稀释,配成系列质量浓度,依次为A=15 μg/mL、B=7.5 μg/mL、C= 1.5 μg/mL,现配现用。将新鲜干净的‘741’杨叶片在各梯度药液中浸泡10 s后保鲜自然晾干;‘Pb29’杨叶片不做处理,设为P组,经检测其Bt表达量低于C组;以50 mmol/L Na2CO3溶液作为对照组(CK)。各处理叶片用花泥保湿,移入高为12.0 cm,直径为8.5 cm的罐头瓶中。
所有杨扇舟蛾均于养虫室内饲养,条件: 26 ℃±1 ℃,相对湿度60%~75%,光周期 16L∶8D。将生长状态一致的3龄幼虫接到叶片上,250目纱网封口,每处理接幼虫20头,3次重复,每天更换新鲜的处理后的杨树叶。各处理Bt胁迫6 d后全部饲喂正常的非转基因‘741’杨树叶片,视幼虫数量适时分瓶,直至幼虫老熟化蛹,羽化后各组分别转入直径28 cm、高32 cm、120目尼龙网的养虫笼中,并以稀释100倍的蜂蜜水供其取食,自由交配产卵。相同方法连续饲养3代,记录幼虫的死亡率、发育历期、化蛹率,蛹质量及成虫的羽化率。
1.3 数据统计与分析
数据以“平均值±标准误(SE)”表示,处理间不同参数(百分率指标以反正弦处理)经方差齐性检验一致且服从正态分布,并采用SNK检验法进行差异显著性分析;回归分析采用线性回归;蛹质量数据采用重复测量的方差分析法进行代间比较,经箱式图检验无异常值,经Shapiro-Wilk检验服从正态分布(P>0.05),经Mauchly’s球形假设检验,因变量的方差协方差矩阵相等(P> 0.05),不相等的(P<0.05)通过Greenhouse-Geisser方法校正。数据均以SPSS 19.0计算所得,以Office Excel 2016为辅助工具。
2 结果与分析
2.1 不同质量浓度Cry1Ac对杨扇舟蛾连续世代存活的影响
2.1.1 幼虫8 d死亡率 幼虫取食含Bt树叶 6 d后,Bt在随后两天里仍会发挥作用,故统计幼虫的8 d死亡率表明,第1代各处理下Bt对杨扇舟蛾的短期致死效果存在显著差异(P<0.05),死亡率随着叶片中Cry1Ac质量浓度的升高而显著升高(P<0.05)(表1),其中A组的死亡率达 83.4%,显著高于C组的低质量浓度处理(P< 0.05);第2代差异性与第1代类似,A、B、C组的死亡率比第1代均有下降,虽然C组仍然比CK高,但已无显著性差异(P>0.05);第3代中A组死亡率与前两代相比下降明显,且B组、C组及P组与CK之间差异不显著(P>0.05),可见Bt对杨扇舟蛾连续世代的短期致死效果出现减弱的趋势。
2.1.2 杨扇舟蛾每代存活率 杨扇舟蛾幼虫的存活曲线表明,幼虫取食含Bt树叶后1~2 d内并没有出现明显的死亡现象(图1),这是由于杨扇舟蛾幼虫体内的BtCry1Ac毒蛋白与中肠受体结合,毒蛋白插入膜内形成孔洞需要一定的响应时间,至幼虫死亡则需要2~3 d。从第4天开始各处理均出现死亡现象,且在停止Bt胁迫后的9~13 d内幼虫仍受到其影响,各组存活率不断下降,其中第1代及第2代与对照组差异显著(P<0.05),P组存活率在B组与C组之间,第13天后各组逐渐趋于稳定;从幼虫化蛹前的校正存活率来看(表2),A组高浓度Bt处理对连续3代杨扇舟蛾幼虫的长期抑制效果没有出现明显减弱,但随着世代的延续其他各组存活率开始升高,且各处理间差异在逐渐缩小(图1-b,1-c),养虫试验中发现,10~17 d死亡的幼虫大部分发育迟缓,无法蜕皮,龄期长期停留在3龄,并且从3代存活曲线的平台期越来越明显可以看出,这部分幼虫取食正常叶片仍不能完成整个生命历程,但幼虫的死亡速度逐渐减缓,对Bt的耐受性在逐渐增强,其中B组最为明显,到第3代存活率为 86.7%,与对照相当。

表1 不同质量浓度Cry1Ac饲养杨扇舟蛾 3代的8天幼虫死亡率Table 1 Mortality of Clostera anachoreta larvae dieting with different mass concentrations of Cry1Ac toxin 8 days for three generations
注:同列中不同字母表示差异显著(P<0.05)。下同。
Note:Values within a column followed by different letters are significantly different(P<0.05).The same below.
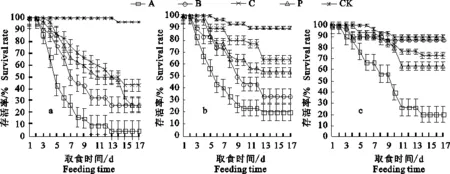
a.第1代 The first generation;b.第2代 The second generation;c.第3代 The third generation
2.2 不同质量浓度Cry1Ac对连续世代杨扇舟蛾发育历期的影响
杨扇舟蛾连续世代各龄期变化表明(表3),初孵幼虫在无Bt胁迫下龄期均为4 d左右,且每代差异均不显著(P>0.05);通过1~3代的3龄发育时间对比,3龄中期开始胁迫后随着质量浓度升高各组龄期也随之明显延长,且每代的A组均与其他处理差异显著(P<0.05),A组第1代有的幼虫处于3龄期长达23 d,而第2、3代低质量浓度处理的部分幼虫已经在停止Bt胁迫末期能蜕皮到达4龄;从高龄期数据可以看出,第1代各处理四龄均比对照长,Bt对幼虫发育及蜕皮速度影响明显,但第2、3代高龄幼虫已基本与对照无显著差异(P>0.05);各世代对比表明,虽然每代龄期比上代有所缩短,但相同处理的每代间发育时间差异不显著(P>0.05)。
整个幼虫历期的统计结果表明(图2),3种质量浓度的BtCry1Ac及转基因‘Pb29’杨均使杨扇舟蛾幼虫的发育速度显著减慢,历期延长(P< 0.05),其中对照组的发育历期最短,第1代 15.12 d、第2代14.51 d、第3代12.73 d,且每代发育速度比前一代有少量加快;A组各代历期分别为29.19、27.13、29.33 d,较对照分别延长 14.07、12.62、16.44 d,从表3可知主要是由于幼虫长期停留在3龄所致;P组所喂叶片Bt质量浓度虽然比C组低,但第1、2代历期反而比C组长;B组各代历期为24.47、21.87、14.42 d,第3代有较大缩短,C组每代历期也均有缩短(24.47、21.87、19.52 d),但B组第3代与对照无显著差异(P>0.05)。
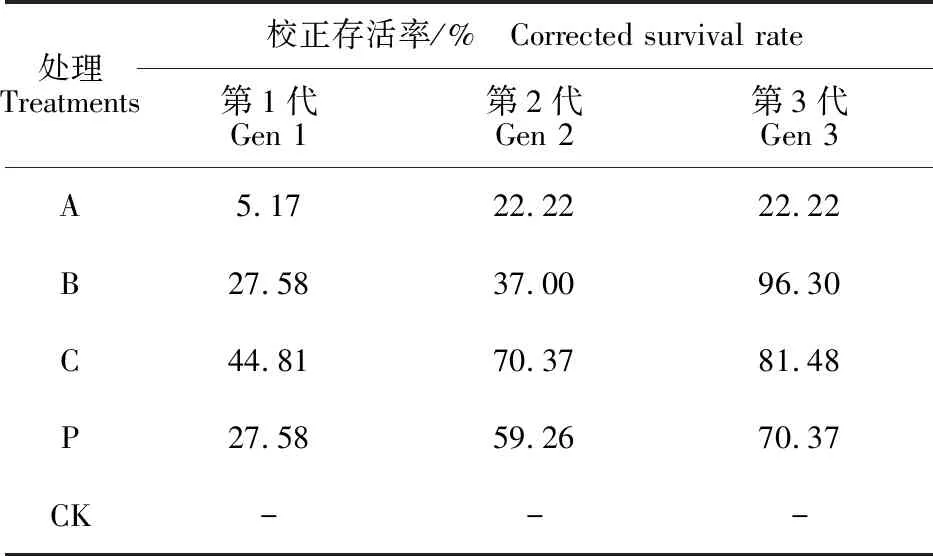
表2 不同质量浓度Cry1Ac饲养杨扇舟蛾幼虫 3代的校正存活率Table 2 Corrected survival rate of Clostera anachoreta larvae after they were dieting with different mass concentrations of Cry1Ac toxin for three generations
注:校正存活率=(处理存活率-对照存活率)/(1-对照存活率)×100%。
Note:Corrected survival rate=(Treatment survival rate-Control survival rate)/(1-Control survival rate)×100%.
2.3 不同质量浓度Cry1Ac对连续3代杨扇舟蛾蛹质量的影响
由图3可知,Bt胁迫下第1代幼虫的蛹质量受到严重影响,其随着Cry1Ac杀虫蛋白质量浓度的升高而出现明显减轻,对照组的蛹浑圆饱满,A组与B组的蛹细小瘦弱,仅有100多 mg,C组与P组较对照也有极大减轻。通过重复测量方差分析法所得结果如下。
A组3代蛹质量分别为(134.57±12.17) mg、(207.76±11.61) mg和(220.28±18.56) mg,各代蛹质量差异具有统计学意义,F(2,4)=28.861,P= 0.004,偏η2=0.935,第2代蛹质量比第1代显著升高73.190 mg(95%置信区间:29.373~117.007,P=0.018),第3代与第2代(P=1.000)、第3代与第1代(P=0.051)差异不显著。
B组分别为(138.57±13.56) mg、(234.14± 9.53) mg和(403.88±48.73) mg,差异具有统计学意义,F(2,4)=72.962,P=0.001,偏η2= 0.973,第2代蛹质量比第1代显著升高95.567 mg(95%置信区间:38.206~152.927,P= 0.018),第3代比第1代显著升高265.310 mg(95%置信区间:38.802~491.818,P=0.037),第3代与第2代(P=0.056)差异不显著。
C组分别为(163.33±15.54) mg、(251.98± 15.55) mg和(294.40±31.98) mg,差异具有统计学意义,F(2,4)=37.302,P=0.003,偏η2= 0.949,第2代蛹质量比第1代显著升高88.650 mg(95%置信区间:42.597~134.703,P= 0.014),第3代比第1代显著升高131.073 mg(95%置信区间:14.155~247.992,P=0.040),第3代与第2代(P=0.550)差异不显著。

表3 不同质量浓度Cry1Ac饲养杨扇舟蛾3代的龄期Table 3 Instar of Clostera anachoreta larvae dieting with different mass concentrations of Cry1Ac toxin for three generations
P组分别为(176.99±16.51) mg、(269.63± 10.53) mg和(315.11±62.86) mg,差异具有统计学意义,F(2,4)=13.456,P=0.017,偏η2= 0.871,第2代蛹质量比第1代显著升高92.633 mg(95%置信区间:60.920~124.347,P= 0.006),第3代与第2代(P=0.960)、第3代与第1代(P=0.144)差异不显著。
CK组分别为(248.06±8.14) mg、(287.90± 12.99) mg和(400.53±32.34) mg,差异具有统计学意义,F(2,4)=34.347,P=0.003,偏η2= 0.945,但第2代与第1代(P=0.217)、第3代与第2代(P=0.125)、第3代与第1代(P=0.051)差异均不显著。
把世代设为x,各处理平均蛹质量设为y后(图3),其线性回归方程分别为:
A:y=42.853x+101.83,R2=0.856 9
B:y=132.65x-6.444 6,R2=0.974 6
C:y=65.537x+105.5,R2=0.960 2
P:y=69.06x+115.79,R2=0.962 6
CK:y=76.235x+159.69,R2=0.929 4
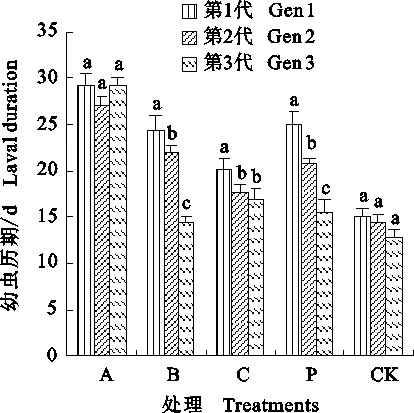
图中所列数据为平均值±标准差,不同字母表示相同处理的不同世代之间差异显著(P<0.05,SNK法检验)。下同 The data shown in the figure are average±standard deviation.Different letters indicate significant differences among different generations of the same treatment(P<0.05,SNK test).The same below
图2 杨扇舟蛾幼虫连续取食Cry1Ac叶片的3代幼虫历期
Fig.2 Laval duration of three successive generationsofClosteraanachoretalarvae dietingwith the leaves of Cry1Ac
可见各组蛹质量随着世代延续均有升高趋势且差异具有统计学意义(P<0.05),其中A、B、C、P组的第2代比第1代显著升高(P<0.05),但第3代比第2代均无显著性差异(P>0.05),且CK组各世代间均无差异性(P>0.05),推测世代对蛹质量的影响在逐渐减弱;回归分析发现处理与对照间的差距在不断缩小,A组增幅最小,Bt连续3代对其化蛹均有较强的抑制效果;而B组中质量浓度处理增幅反而最高,从亚致死剂量的B组存活下来的高龄老熟幼虫有着比CK还要强的营养积累能力;低质量浓度C组的蛹质量反而低于B组和P组。以上表明即使Cry1Ac对幼虫前期有较大影响,停止胁迫后存活并发育到高龄期的幼虫仍然能够摄取到足够的营养完成化蛹,且随着世代的延续蛹质量也在不断增加,但不同梯度处理间并没有线性差异。
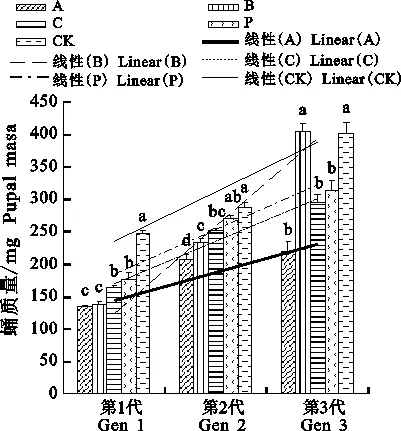
图3 不同质量浓度Cry1Ac饲养下 杨扇舟蛾的蛹质量Fig.3 Pupal mass of Clostera anachoreta larvae dieting with different mass concentrations of Cry1Ac toxin
2.4 不同质量浓度Cry1Ac对连续3代杨扇舟蛾化蛹率及羽化率的影响
尽管幼虫化蛹率随叶片中Cry1Ac杀虫蛋白质量浓度的升高而下降,由于转移至正常叶片上存活下来的高龄幼虫大部分均能发育至蛹,而处理组幼虫死亡导致化蛹基数有一定减少,所以化蛹率与死亡率趋势及差异性相似(表4);羽化率的计算以最终成蛹量为基数,即羽化的杨扇舟蛾数占蛹数的比例,各世代间羽化率随Cry1Ac质量浓度的升高有轻微波动,处理较对照及世代间无显著差异(P>0.05)。表明即使Cry1Ac杀虫蛋白对3龄杨扇舟蛾幼虫胁迫后,其各代幼虫化蛹之后的羽化过程仍不受影响。
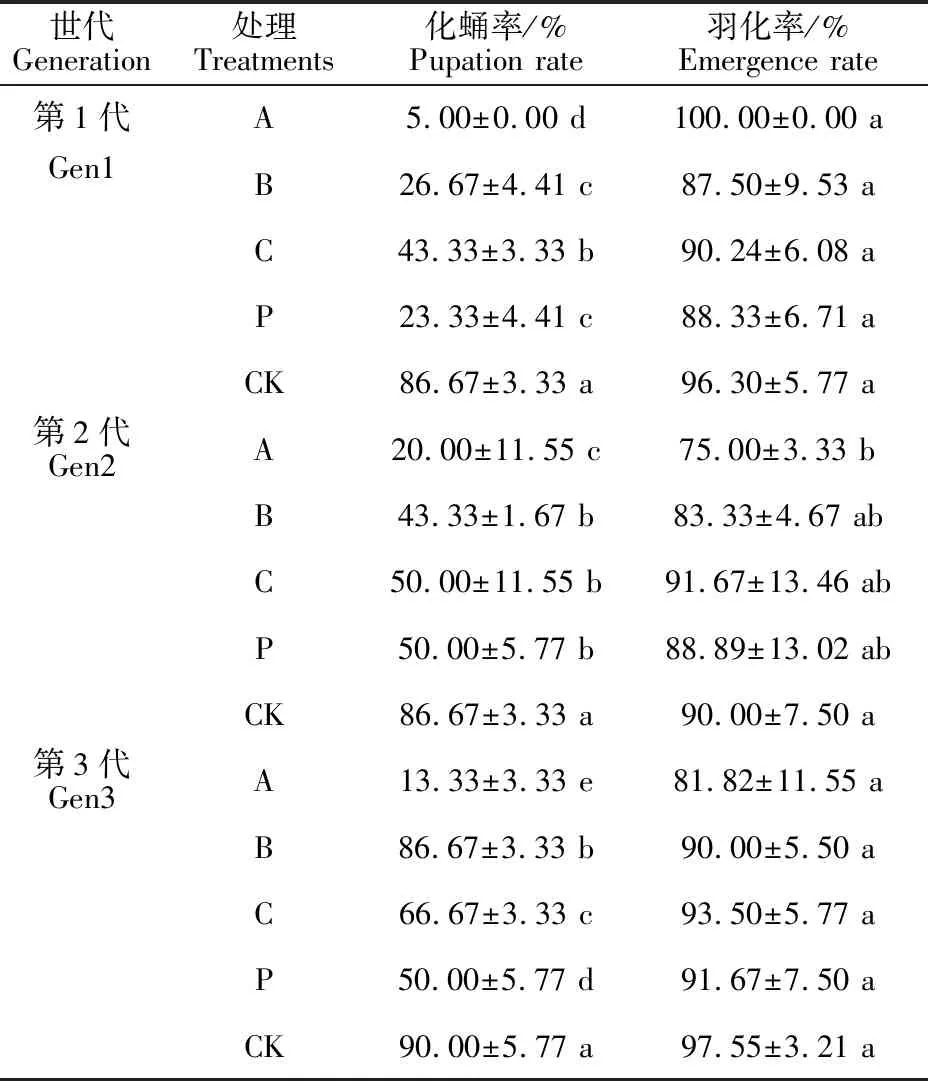
表4 不同质量浓度Cry1Ac连续饲养杨扇 舟蛾3代化蛹率及羽化率的影响Table 4 Pupation and emergence of three successive generations of Clostera anachoreta larvae dieting with different mass concentrations of Cry1Ac toxin
3 讨 论
3.1 杨扇舟蛾对Bt的抗性风险
通过分析不同质量浓度Bt Cry1Ac胁迫对杨扇舟蛾连续3代存活率、发育历期以及蛹质量等指标的影响,结果表明,含Bt Cry1Ac杀虫蛋白的叶片及转基因‘Pb29’杨对3龄杨扇舟蛾有着较强的毒杀作用,高质量浓度Bt对低龄幼虫的致死效果随着代数延长没有明显减弱,与高宝嘉等[21]的研究一致,也有报道杨扇舟蛾幼虫取食转基因‘741’杨两代未产生抗性,且连续两代胁迫后第2代死亡率高于第1代[13,22],由此推测杨扇舟蛾初孵幼虫很难在转基因杨上完成世代发育。本研究幼虫取食Bt叶片后发育受到抑制,第1代和第2代幼虫历期较对照组明显延长,陈建[9]与张炬红等[13]也有相似的研究结论,但停止胁迫后高龄幼虫龄期基本不受影响,且死亡率降低,耐受性逐渐提高,因此如果取食非转基因杨的高龄幼虫转移到Bt杨上取食后就有可能存活下来。
蛹质量随Cry1Ac质量浓度的升高而显著下降,同钟勇等[23]研究结果相似,但本试验中蛹质量随着世代延长而稳定回升,在亚致死剂量存活下来的老熟幼虫比低质量浓度处理幼虫有着更强的耐受性,营养积累能力增强,可见低浓度的Bt处理无法激发幼虫的响应机制,反而在亚致死剂量胁迫下幼虫会产生较明显的适应性。结合上文分析及本试验中较高的羽化率结果,由于转基因杨树对杨扇舟蛾实验种群深刻的遗传分化影响[15-16],野外杨扇舟蛾种群在不同寄主间取食与繁殖的世代延续过程中,可能会产生对转Bt基因杨树产生抗性的杨扇舟蛾种群。
此外,本试验所用‘Pb29’杨中转了Bt和API两种抗虫基因,虽然其表达的Bt质量浓度低于1.5 μg/mL,但由于存在API基因,增强了抗虫效果,进而影响取食‘Pb29’杨叶片的幼虫龄期与发育历期。而致死效果不稳定可能是由于采取的多年生转基因‘Pb29’杨叶片中Bt表达量不稳定所致。另外处理组历期缩短除了对Bt的适应性逐渐加强的因素,也有可能还受野生杨扇舟蛾在室内连续饲养逐渐驯化及季节气候变化的 影响。
3.2 多种高效管理策略的必要性
植物与昆虫之间是不断相互选择、协同进化的[24]。害虫取食植物过程中,植物能够产生多种次生性代谢产物影响害虫的取食行为或生理反应来抵御害虫侵害,害虫又能通过改变体内酶的响应机制等多种途径不断地适应寄主植物的抗虫性[25],甚至食物中可溶性蛋白质-可消化碳水化合物的含量都可以降低对Bt毒素的敏感性[26],因此实施有效和高效的管理策略来控制虫害爆发是非常具有挑战性的,因为它依赖于对害虫生物学和生态学的全面了解,以及预测加剧害虫管理问题的变化趋势[27]。为了延缓和管理田间害虫对Bt作物的抗性,世界范围内应用较为广泛的有金字塔植物策略(在同一植物中表达不同的Cry基因)及高剂量/避难所策略,而自然避难所策略适用于具有高成虫扩散行为的多食性害虫,对单食性或低分散性害虫不适用[28],而本研究中杨扇舟蛾对亚致死剂量的高度耐受性也证明世代种群对转Bt植物抗性累积发展的风险,因此在林业中开展种群动态监测、金字塔植物及避难所策略等措施,从而防止或延缓Bt抗性昆虫种群的产生。
4 结 论
杨扇舟蛾在不同质量浓度Bt Cry1Ac及转基因‘Pb29’杨胁迫下连续3代的发育指标表明,含Bt Cry1Ac杀虫蛋白的叶片及转基因‘Pb29’杨对3龄杨扇舟蛾有着较强的毒杀作用,幼虫取食Bt叶片后发育受到抑制,但随世代延长对低质量浓度Bt及转基因‘Pb29’杨耐受性逐渐提高,且老熟幼虫龄期不受影响;蛹质量随Cry1Ac质量浓度升高显著下降,但随着世代延长而稳定回升,而在亚致死剂量存活下来的老熟幼虫比低质量浓度处理幼虫有更明显的适应性,增加杨扇舟蛾对转Bt基因杨树的抗性风险。

