DWI、T2WI及MRI动态增强扫描成像对不同分化小肝细胞癌的定量诊断研究
张 骏 廖凯兵* 刘红翠 严小兰 周 婷 邵梦平 陈驰华
肝硬化是消化内科常见的一种疾病,且在肝硬化的基础之上患者出现肝癌的风险较大,因此较早发现及实施早期的治疗是提升肝癌患者生存概率的重要意义所在[1-3]。本研究回顾性分析30例患者乙肝肝硬化背景之下的小肝细胞癌(small hepatocellular carcinoma,SHCC)T2加权成像(T2weighted imaging,T2WI)、弥散加权成像(diffusion weighted imaging,DWI)以及核磁共振(magnetic resonance,MR)动态增强扫描结果特征,旨在对SHCC患者的影像特征进行总结,进而明显提升对于病灶定性诊断的正确率,为临床诊断提供更加科学的数据支持。
1 资料与方法
1.1 一般资料
选取2013年6月至2016年9月在湖北省中西医结合医院就诊的30例乙肝肝硬化患者,其中男性21例,女性9例;年龄39~65岁,平均年龄(51±1.45)岁。所有患者均得到相关的病例证实,30例乙肝肝硬化患者中共显现出30个SHCC病灶。本研究经医院伦理委员会审核批准,并允许实施。
1.2 纳入与排除标准
(1)纳入标准:①患有乙肝肝硬化发病史;②MRI检测之前未接受过肝脏、脾脏手术或者是相关的介入治疗;③患者的临床以及影像资料较为完全,T2WI、DWI以及动态增强图像的质量较好;④SHCC的相关诊断标准与病理的选择根据上海肝癌病理协作组的诊断标准得到确定,单个癌结节的最大直径≤3 cm,癌结节的数目>2个,把多个癌结节的直径相加在一起的总和<3 cm,且经过病理证实确诊为SHCC。
(2)排除标准:①合并其他器官或系统的恶性肿瘤;②MRI检测之前有过肝脏、脾脏手术或相关介入治疗;③临床或影像资料不完整,T2WI、DWI以及动态增强图像的质量不好;④非SHCC患者;⑤妊娠及哺乳期患者。
1.3 仪器设备
采用1.5 T HDe型磁共振扫描仪(美国GE公司)进行扫描检查。
1.4 扫描方法
(1)MRI扫描。扫描参数:视野(field of view,FOV)为40 cm×30 cm,矩阵320×224,激励次数(number of excitations,NEX)2.00;轴位呼吸触发快速自旋回波(fast spin echo,FSE)T2WI+FS,重复时间(repetition time,TR)为2~3个呼吸周期,回波时间(echo time,TE)为80 ms,层厚为6 mm,层间距为1.5 mm,单次激发SE-EPIDWI,TR为5000 ms,TE为75.40 ms,层厚为6 mm,层间距为1.5 mm,FOV为40 cm×40 cm,矩阵128×128,NEX为8.00,b值为500~600 s/mm2。
(2)肝脏快速容积采集(liver acquisition volume acceleration,LAVA)动态扫描。LAVA动态增强扫描参数:动脉期为18~22 s,门脉期为1 min,延迟期为3 min,FOV为40 cm×36 cm,矩阵288×192;TR为5.14 ms,TE为2.30 ms,层厚为5 mm,层间距为2.50 mm,根据肝脏大小,约15~18 s完成单期全肝实施扫描。
1.5 观察指标
观察动态增强SHCC的强化特征以及包膜的显示;分析T2WI、DWI、T1WI SHCC的信号特征。
1.6 统计学方法
采用SPSS 21.0统计软件分析,针对计数数据的比较采用x2检验,计量数据以(x-±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 动态增强SHCC的强化特征以及包膜显示
高分化SHCC有5例,中分化SHCC有17例,中低分化SHCC有6例,低分化SHCC有2例。动态增强SHCC的强化特征以及具体包膜显示情况见表1。
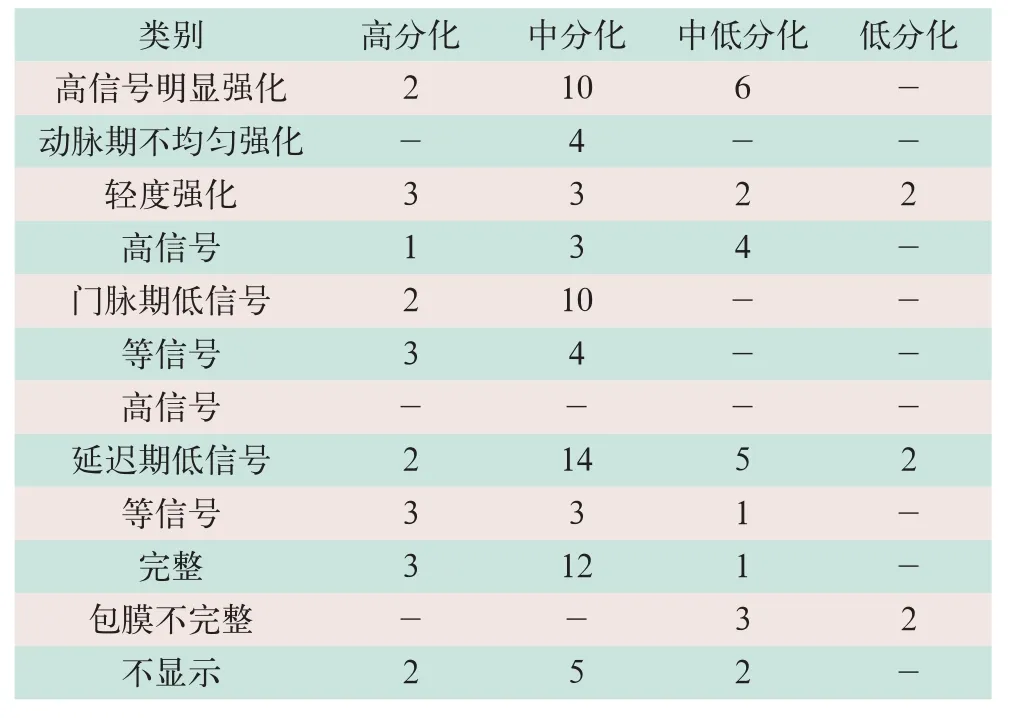
表1 动态增强SHCC的强化特征以及包膜显示(例)
2.2 T2WI、DWI及T1WI的SHCC信号特征
在30例患者中,T2WI检测SHCC有28例,2例未检测出;DWI检测30例,T2WI及DWI对于SHCC的检出率相比,差异无统计学意义(x2=1.115,P>0.05),见表2。

表2 T2WI、DWI及T1WI的SHCC信号特征(例)
2.3 典型患者的影像学图像分析
(1)典型患者经MRI扫描后动态增强SHCC的强化特征显示,其肝S7段肝包膜下结节样双回波,呈现T1W1低信号(图1)。
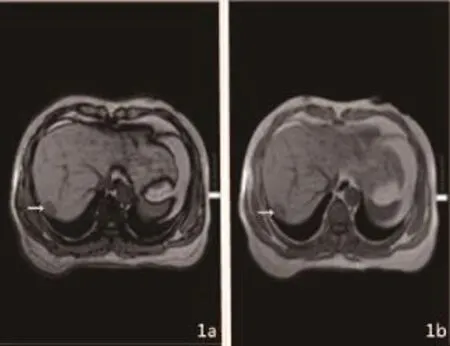
图1 动态增强SHCC的强化特征MRI影像
(2)病变T2WI Flair呈稍高信号(图2),而DWI呈明显高信号(图3a、3b),而时间-信号曲线呈现出 “快进快出型”(图4a~4e)。
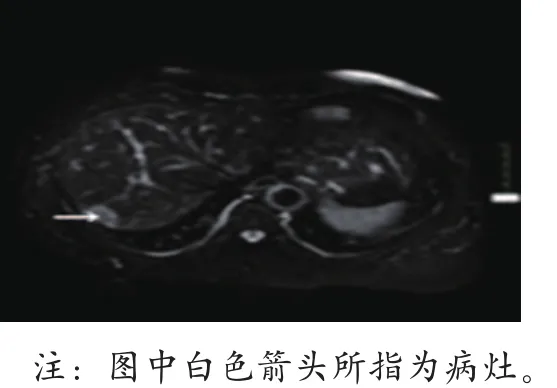
图2 病灶T2WI Flair呈稍高信号

图3 a、3b 病灶DWI呈明显高信号

图4 a~4e 时间-信号曲线显示病灶呈“快进快出”型强化
3 讨论
肝癌指出现在肝脏中的癌症,由肝脏内部的细胞所导致发生的癌病,称其为“原发性肝癌”;从人体其他器官的癌症转移到肝脏而发生的肝脏恶性肿瘤,称其为继发性肝癌,也称之为“转移性肝癌”。各种种类的中胚叶肿瘤侵润到人的肝脏,通常称之为肉瘤肝脏侵润,不包括在继发性肝癌之中。原发性肝癌依据组织学分类为肝细胞型、胆管细胞型以及混合型。原发性肝癌中有85.5%属于肝细胞癌。患者的早期症状以及体征不显著或者是缺乏特异性,有的患者在发病时特的征为肝区胀痛,也有的呈现出急腹痛,或者以转移灶症状为最早的表现。对于患者的诊断除了依据临床的特征外,尚需要依靠肝功能试验、特殊的酶学检测等,除了活组织检测之外,以甲胎蛋白诊断的准确率最高。目前,肝癌的手术治疗以及中西医综合治疗其存活率有所上升。
世界各地的肝癌发病率常以非洲撒哈拉沙漠以南以及亚洲沿海地区发病率较高,欧、美则会较少。此病症可发生在2个月婴儿到80岁的老年群体当中,发病率最高的年龄在40~49岁[4-5]。男性较为多发,男女之比为6∶1。由于此病症的恶性度较高、病情进展较快,患者早期一般不会出现较大的不适现象,然而一旦发生症状则会及时就诊,但常常已经到了中晚期,因此治疗的难度较大、且疗效较差,一般发病之后生存的时间仅为6个月,人称其为“癌中之王”[6-7]。我国是乙肝发病的大国,发病患者大约占到全球的半数以上。肝癌大多是由乙肝肝硬化的基础之上发展而来,由于丙肝患者在渐渐增加,继乙肝之后也大概率会发展成为肝癌。
肝硬化患者出现肝癌的风险概率很大,而血清AFP对于早期小肝癌的特异性也较小,故寻找一种无创的SHCC影像检测意义较为重大,将对肝癌患者的预后产生较大的影响。目前,MRI已经成为在乙肝肝硬化背景下SHCC筛查以及早期检测的重要方式。癌组织的相关分化程度,是否发生相应的脂肪变性,细胞发生坏死以及出现微量金属元素的沉积等等,都会对小肝癌患者的信号强度的检测产生影响[8-10]。小肝癌在临床上表现特征也存在一定的多样性,然而T2WI的病灶则主要显示出较高或者稍高的信号,T1WI的相关信号则主要是低或者是呈现出稍低,DWI主要是高信号[11-13]。本研究对象当中,28个病灶T2WI呈现出高或是稍高的信号,2个病灶呈现出低信号,30个病灶的DWI均呈现出高信号或是稍高的信号,与相关的文献研究的结果相一致[14-15]。徐萍等[16]和石峰等[17]研究表明,对于部分分化情况较好的小肝癌患者,部分T2WI呈现出较低信号,而本研究中有2个病灶产生出T2WI低信号;24个病灶T1WI产生低信号,6个病灶呈现出稍高的信号。
T1WI较高信号出现的因素主要是:脂肪出现沉积、患者的结缔组织降低、瘤内的血管窦加多且患者的细胞密度加大,结节内部的脂肪出现沉积、含水的纤维加多、结节发生出血现象、肿瘤发生分化的情况较好,或者是出现铜沉积,细胞内部的糖蛋白增多;T1WI呈现出低信号则主要是因为病灶发生液化坏死或者是出现纤维化[18]。
DWI能够提供较多的关于病变组织的相关信息,提升SHCC的检出率;尤其是在肝硬化的条件之下,肝硬化的具体背景会使患者的影像检测显现出较低信号,肝硬化出现结节、疤痕或者是发生纤维化等病灶,在DWI上会导致显示率的相关问题,能够易于找出癌灶。在本研究过程当中,使用单次的激发平面回波且实施并行采集技术行DWI相关检测,与此同时,也对相位编码数量有所降低,以此对回波链的长度进行缩减,最大化的降低重复的时间以及扫描的具体时间,以此有效的降低磁敏感以及化学位移产生的伪影,与此同时降低了对于有效TE信号产生的相关影响,减少成像伪影,对于检测图像质量明显进行优化[19]。除此之外,对于线圈体积以及敏感的体积有所下降,并且多个线圈的信号不断叠加,有效地降低检测到的噪声的幅度以及减小噪声,进而显著改善SNR以及载波噪声比(carrier noise ratio,CNR)。DWI信号跟随组织的病理分化级别不断升高而提升[20]。
DWI对于乙肝出现肝硬化背景SHCC的SNR以及CNR最高,且明显好于T2WI,因此在临床工作实施中,需结合动态增强多序列成像以及DWI对病灶进行观察,提升病灶定性诊断的相关准确性。

