盐酸酸洗废液制备聚氯化铁
彭 健,朱 印,张登峰
(昆明理工大学化学工程学院,云南昆明650500)
钢材深加工过程中,为了改善钢材表面结构以获得更好的性能,需要用盐酸进行浸泡或者喷淋。酸洗后会产生大量的废液,这种废液属于工业危险废物,具有腐蚀性和污染性。为此,需要采取措施对其进行无害化处理[1-3]。国内外对酸洗废液的处理研究历史悠久,目前的处理方式主要有中和沉淀法、直接焙烧法、浓缩结晶法、膜分离法、生物法和化学转化法[4-11]。在实际的工业应用中,中和沉淀法药剂消耗量大,中和效果欠佳;直接焙烧法和浓缩结晶法需要消耗大量的燃料;膜分离法对于所处理的酸的要求较高;生物法目前只是适用于硫酸酸洗废液的处理以及回收单质硫。
在酸洗废液中加入氧化剂,最终可以得到聚氯化铁(PFC),相比于铝系混凝剂,PFC具有处理效果好且无毒的优点[4]。过氧化氢是一种具有强氧化性、弱酸性的物质,其标准氧化还原电位仅次于臭氧,高于高锰酸钾和硝酸等[12],能直接氧化酸洗废液中的Fe2+。相对于铁(Fe3+/Fe2+)来讲,根据过氧化氢和氯酸钠的标准电位(H2O2/H2O和ClO3-/Cl-)可知,过氧化氢的氧化性要强于氯酸钠[13]。过氧化氢溶液中除了氢和氧以外基本不含其他物质,不会给溶液中带入Na+和Cl-,能够最大限度地减少其他离子对产品纯度的干扰。
本实验以过氧化氢为氧化剂处理盐酸酸洗废液,制备聚氯化铁。通过改变氧化剂添加量、反应温度、反应时间、溶液酸度,研究各变量对实验结果的影响,分析其反应机理,找到最佳实验条件。
1 实验部分
1.1 仪器与试剂
仪器:HK-1D型恒温水浴;DJ1C-60型增力电动搅拌器。
试剂:过氧化氢、重铬酸钾、可溶性淀粉、硫代硫酸钠、二苯胺磺酸钠、盐酸、磷酸二氢钾,均为分析纯。
1.2 实验步骤
准确量取100 mL酸洗废液加入三口烧瓶,置于恒温水浴中,搅拌转速为5 r/s,加入一定量的浓盐酸(37%)和过氧化氢,最后加入稳定剂磷酸二氢钾,开始反应。反应结束,用重铬酸钾滴定法测定其中Fe2+含量,计算转化率。
1.3 分析方法
Fe3+以淀粉为指示剂,用硫代硫酸钠标准溶液滴定;Fe2+以二苯胺磺酸钠为指示剂,用重铬酸钾标准滴定溶液滴定。
1.4 原料
酸洗废液:来自云南玉溪某钢铁企业的盐酸酸洗废液,其中Fe2+质量分数为10.42%,Fe3+质量分数为0.62%。
2 实验结果与讨论
2.1 过氧化氢加入量对Fe2+氧化效果的影响
过氧化氢氧化Fe2+需要在酸性或碱性环境下进行[14-15]。 在碱性环境下,H2O2会与 Fe2+发生如下反应:
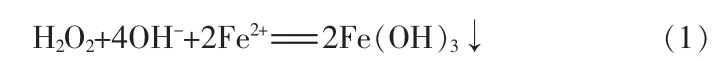
而本实验中选择的原料是经过盐酸酸洗过的废液,已经是酸性溶液。过氧化氢在酸性环境下将Fe2+氧化成Fe3+,并在加入稳定剂的情况下反应得到聚氯化铁。化学方程式如下:

实验条件:本实验选用的是30%H2O2,以加入质量为变量;废酸酸量为100 mL;加入12 mol/L盐酸12 mL,磷酸二氢钾固体0.3 g;反应温度为30℃、搅拌速率为5 r/s、反应时间为120 min。
在本实验中,废液已被调制成极强的酸性环境,H2O2加入后,开始剧烈反应,伴随着大量冒泡和沸腾蒸汽,溶液的颜色迅速变棕红色,且由于反应不均匀,溶液出现了短暂的分层现象。大量的反应热不但会蒸发部分物质改变反应环境造成反应本身的变化,且由于过氧化氢遇热会分解,氧化性减弱;在加入H2O2一段时间后,反应减缓,不再有冒泡和沸腾现象,随着Fe2+转化率增高,溶液逐渐变为褐色,伴随着溶胶沉淀出现。在30%H2O2加入量为100 mL及以上的实验组里,溶液几乎已经成了半流动的褐色沉淀。
剩余Fe2+含量及其转化率随H2O2加入量的变化见图1。从图1可以看出,随着H2O2加入量的增大,溶液中Fe2+含量随之减少,相应的其转化率持续升高。将30%H2O2加入量增大到120 g后,Fe2+转化率达到96.43%,且继续上升的幅度非常小。
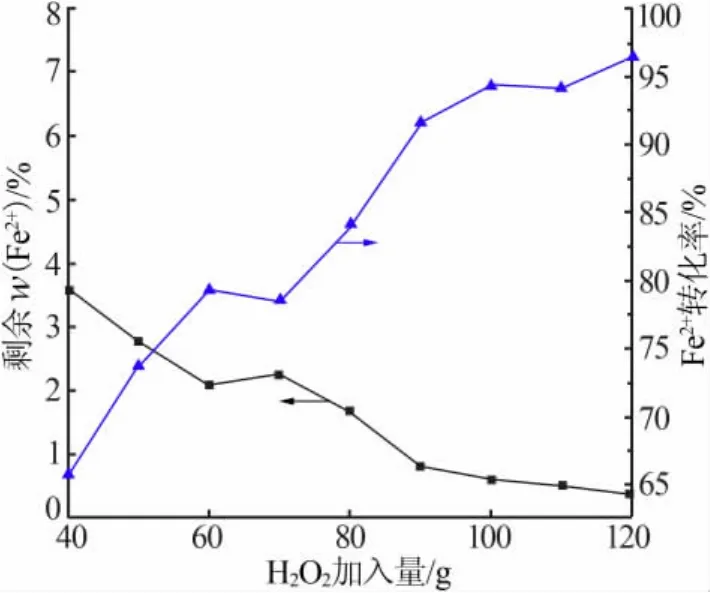
图1 剩余Fe2+含量及其转化率随H2O2加入量的变化
2.2 浓盐酸加入量对Fe2+氧化效果的影响
实验条件:100mL酸洗废液;加入30%H2O290g,磷酸二氢钾固体0.3 g,设定12 mol/L盐酸加入量为变量;反应温度为30℃、反应时间为120 min、搅拌速率为5 r/s。
剩余Fe2+含量及其转化率随浓盐酸加入量的变化见图2。从图2可以看出,酸性环境仍然是有利于反应发生的,随着浓盐酸加入量的增大,溶液中Fe2+的转化率大致呈上升的趋势,在浓盐酸加入量为14 mL时达到最大,然后呈下降趋势。这是因为浓盐酸提供的H+推动氧化反应正向进行,但是需要注意适量,因为溶液中的H+过多,反而开始抑制Fe3+的水解和聚合反应,无盐基度的氯化铁溶液浓度增大,抑制了氧化反应的正向进行。
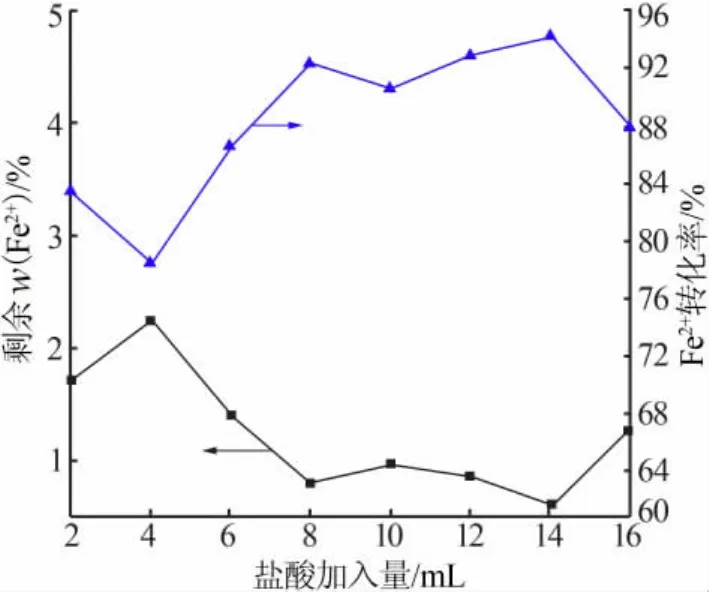
图2 剩余Fe2+含量及其转化率随浓盐酸加入量的变化
2.3 反应温度对Fe2+氧化效果的影响
实验条件:100mL酸洗废液;加入30%H2O290 g,12 mol/L浓盐酸8 mL,磷酸二氢钾固体0.3 g;设定其反应温度为变量(以30℃为起点,每增加10℃做一组实验),搅拌速率为5 r/s,反应时间为120 min。
剩余Fe2+含量及其转化率随反应温度的变化见图3。由图3可知,温度在过氧化氢氧化酸洗废液中的Fe2+的实验中,起到的是一个抑制反应进行的作用,即随着温度逐渐升高,Fe2+转化率大致呈一种下降的趋势。该过程的发生在温度为90℃时最为明显,其Fe2+转化率已经与30℃时有了约30%的差距。其原因在于,过氧化氢与氯化亚铁的反应是一个剧烈放热反应,会在液面上方放出大量的热,而过氧化氢遇热极易分解,加入溶液中的过氧化氢迅速被分解,造成其氧化性减弱;在后续的反应中,过氧化氢持续被分解,温度越高其分解速度越快,Fe2+转化率持续走低。

图3 剩余Fe2+含量及其转化率随反应温度的变化
2.4 反应时间对Fe2+转化率的影响
实验条件:100mL酸洗废液;加入30%H2O290g,12 mol/L浓盐酸8 mL,磷酸二氢钾固体0.3 g;反应时间为120 min,搅拌速率为5 r/s,每隔10 min进行一次取样滴定。
剩余Fe2+含量及其转化率随反应时间的变化见图4。加完过氧化氢后迅速取样滴定作为第0 min的数据,其转化率为79.22%。从转化率曲线可以看出,过氧化氢与氯化亚铁的反应,整个过程集中发生在过氧化氢加入废酸液的初期,两者迅速反应,释放出大量热使溶液沸腾,蒸发出大量水雾。过氧化氢极强的氧化性和它在酸性环境下与氯化亚铁剧烈反应的特性,是该现象发生的主要原因。从转化率曲线可以看出,反应时间对其转化效果的影响较小。
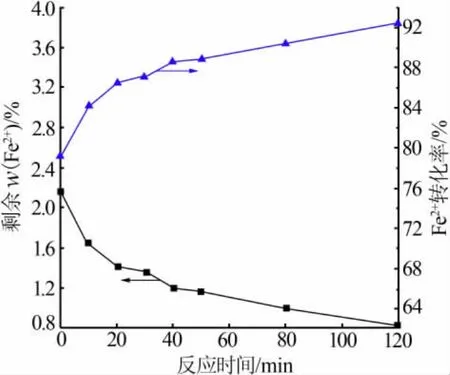
图4 Fe2+含量及其转化率随反应时间的变化
2.5 稳定剂对盐基度的影响
盐基度是衡量聚氯化铁絮凝效果好坏的一个重要标准,是溶液中的氢氧根离子与总铁的质量比。本节实验是以加入的磷酸二氢钾为变量,研究生成的聚氯化铁盐基度随溶液中的n(P)/n(Fe)变化情况,通过观察聚氯化铁状态的变化,分析其中的规律,找出最佳稳定剂加入量。
取100 mL废液,加入到三颈烧瓶中,固定在30℃恒温水浴里,调节转速为5 r/s。加入12 mL的浓盐酸,90 g过氧化氢,以加入的磷酸二氢钾为变量,反应时间为120 min,熟化时间为6 h。
稳定剂加入量对盐基度的影响见图5。从图5可以看出,随稳定剂加入量的增加,聚氯化铁的盐基度先迅速增大,然后逐渐减小。稳定剂的最佳加入量为0.3 g。在实验中观察到,稳定剂加入量越多,聚氯化铁越稳定,当n(P)/n(Fe)接近 0.05 时,PFC 产品一个月没有出现沉淀。
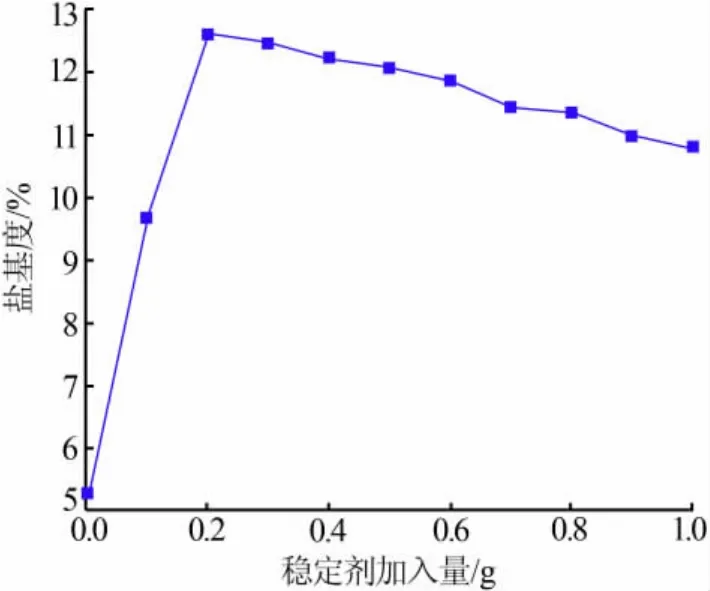
图5 稳定剂加入量对盐基度的影响
2.6 产品指标
制备的聚氯化铁产品与水处理剂聚氯化铁标准HG/T 4672—2014对比,结果见表1。由表1可知,产品各项指标均达到了水处理剂聚氯化铁的标准。

表1 产品与水处理剂聚氯化铁标准对比
3 结论
1)双氧水氧化酸洗废液制备聚氯化铁的最佳工艺条件(每100 mL废液)为:反应温度为30℃,转速为5 r/s,浓盐酸加入量为12 mL,过氧化氢加入量为90g,磷酸二氢钾加入量为0.3g,反应时间为120min,熟化时间为6 h。2)经过分析可以看出,以双氧水作氧化剂,可减少外来离子对产品的影响,得到高纯度的氯化铁,其简单的操作条件又无需对设备和厂区建设大量投入,而且价格也比较便宜。其直接成本要比氯酸钠作氧化剂高,但是由于不引入Cl-和Na+,可以有效减少溶液对设备的腐蚀。

