高效液相色谱-三重四极杆质谱法同时测定烟叶中10种多酚类化合物
刘萍萍,卢紫舒,罗朝鹏,李泽锋,翟 妞,郑庆霞,卢 鹏,曹培健,周会娜,陈千思*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
2.郑州大学化学与分子工程学院,郑州高新技术产业开发区科学大道100号 450001
多酚类化合物是植物中一类重要的次生代谢产物,在烟草中主要以葡萄糖苷和酯的形式存在。多酚类化合物可从植物中提取得到,具有良好的抗氧化性能,广泛应用于食品、医学领域[1-5]。芸香苷和原花青素可作为天然抗氧化剂;绿原酸具有广泛的抗菌作用;花青素可用于食品、染料、医药、化妆品等方面[6];山奈酚广泛存在于水果、蔬菜及饮料中,具有防癌抗癌的功效;氯化飞燕草色素、氯化飞燕草素3-O-β-吡喃葡糖苷、莨菪亭、鼠李金具有一定的抗氧化功能[7-8]。研究表明,多酚类化合物对烟草生长发育有重要影响,同时也与烤烟的感官质量紧密相关[9-10]。
烤烟中的多酚类化合物有多种,其中芸香苷、绿原酸的质量分数最高,绿原酸占多酚类化合物总量的75%~90%[11]。其他质量分数低的多酚类化合物在烟草品质鉴定与改善方面也有辅助作用。因此,准确测定烟草中多酚类化合物对于烟草鉴定、烟草制品质量控制及卷烟设计具有重要意义[10]。烟草中成分复杂,多酚类化合物质量分数差异较大,有些化合物质量分数偏低且不易检测[12]。因此选用合适的样品处理和检测方法尤为重要。
国内外关于烟叶中多酚类化合物的定性定量分析已有较多报道,主要有毛细管电泳法、分光光度法、GC法、LC法、HPLC-MS法等[13-18]。其中HPLC-MS法由于样品处理简单、灵敏度高、定性定量结果可靠、快速简便、自动化程度高、回收率高、适用于复杂基质样品的分析等[19-24],近年来已经发展为多酚类检测的主流方法,并已用于烟草中绿原酸、芸香苷的定性定量分析[12],但对于烟草中低质量分数的多酚类化合物的测定还鲜见相关报道。本研究中基于HPLC-MS/MS技术,采用内标法,建立了一种可以同时检测烟叶中10种多酚类化合物的方法,旨在为同时检测烟叶中多种多酚类化合物提供方法参考。
1 材料与方法
1.1 材料、试剂和仪器
K326烟草生长于25℃、16 h/8 h光暗交替条件下,收集TMV感染组和对照组的第三、第四叶位叶片,立即置于液氮中冷冻至干,-80℃保存。每组分别取3株烟草的烟叶样品,每株为一个重复。
甲酸(质谱纯),山奈酚(Kaempferol)、花青素(Cyanidin)、氯 化 飞 燕 草 色 素(Delphinidin chloride)、鼠 李 金(Rhamnazin)、绿 原 酸(Chlorogenic acid)、氯化飞燕草素3-O-β-吡喃葡糖苷(Delphinidin 3-O-β-glucopyranoside chloride)、原花青素B2(Procyanidine B2)、氯化花青素鼠李葡糖苷(Keracyanin chloride)、芸香苷(Rutin)、莨菪亭(Scopoletin)、伞形花内酯(Umbelliferone)(标准品)(美国Sigma Aldrich公司);乙醇(色谱纯,德国Merck公司)。
1260/6490液相色谱-三重四极杆质谱联用分析仪(美国Agilent公司);BEH Phenyl色谱柱(2.1 mm×150 mm,1.7 μm)(美 国 Waters公 司);BSA224S-CW精密天平(感量0.000 1 g,德国Sartorius公司);PP020XXM1超纯水仪(英国Elga公司);SPD111V真空浓缩仪(美国Thermo公司);KQ-700DE数控超声波清洗器(昆山市超声仪器有限公司);5424离心机(德国Eppendorf公司)。
1.2 方法
1.2.1 样品提取
取50 mg冷冻干燥后的烟叶样品,用研磨机研磨成粉末后,将其转入1.5 mL(2 mL离心管)预冷的乙醇-水(4∶1,体积比)提取液中,常温下超声1 h;然后14 000 r/min条件下离心12 min,取1 mL上清液,将其真空浓缩成固体。用200 μL 80%乙醇(含75 ng/mL伞形花内酯溶液)复溶,20 000 r/min离心3 min,取上清液,进行HPLC-MS/MS检测。分析条件:
色谱柱:BEH Phenyl柱(2.1 mm×150 mm,1.7 μm);流动相:0.1%甲酸水溶液(A)和0.1%甲酸甲醇溶液(B);洗脱梯度:0~2 min B相由5%升到15%,2~10 min B相保持15%,10.01 min~15 min B相升到100%;流速:0.3 mL/min;柱温:35 ℃;进样量:1 μL。电喷雾电离源电离;正离子电离模式下毛细管电压为4 kV;雾化气压力为275.6 kPa;干燥气流量为12 L/min;干燥气温度为290℃;鞘气流量为11 L/min;鞘气温度为200℃;采用实时多反应监测(DMRM)模式扫描。10种多酚类化合物的质谱采集参数见表1。10种化合物母离子均为M+H+峰(本研究中未考察体系中K+、Na+的影响)。
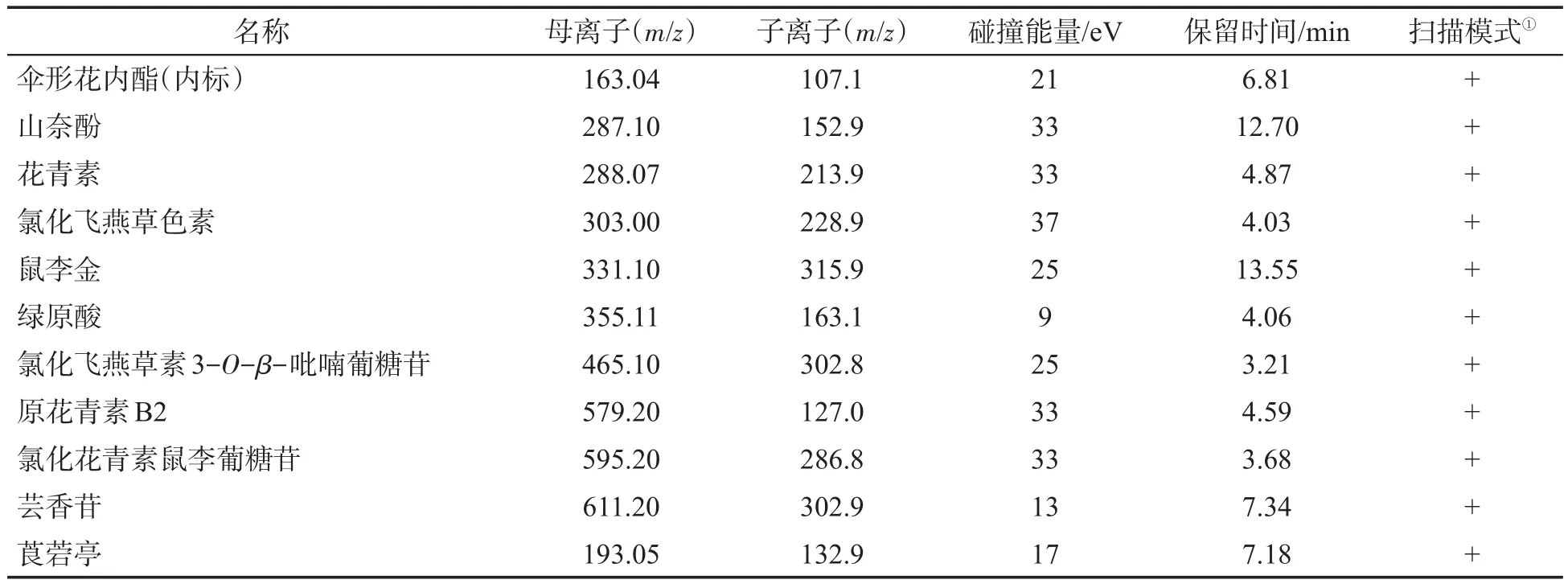
表1 10种多酚类化合物标准品在DMRM模式下的采集参数Tab.1 Collection parameters of ten polyphenol standard samples under DMRM mode
1.2.2 回收率测定
称取12份相同质量的烟叶样品,平均分为4组。分别向4组样品加入终浓度为0、5、15、30 μg/mL相同体积的10种多酚类化合物混合标准液,按照上述条件进行分析,每种化合物的分析结果值分别为C0、C5、C15、C30,分别按照公式(1)~公式(3)计算方法的加标回收率:
终浓度5 μg/mL:
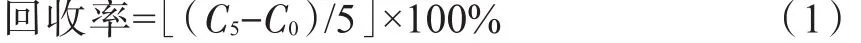
终浓度15 μg/mL:
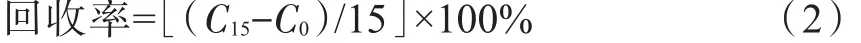
终浓度30 μg/mL:
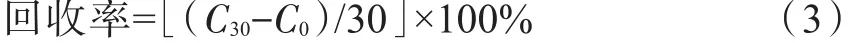
1.2.3 基因表达分析
RNA的提取与反转录参照文献[24]进行。
2 结果与讨论
2.1 仪器分析条件的优化
2.1.1 流动相的优化
在流动相中添加少量的添加剂(如甲酸)可以增强质谱离子源的离子化效率[25]。分别考察了不添加以及分别以0.05%(体积比)甲酸、0.1%甲酸、0.2%甲酸和0.3%甲酸作为添加剂时的效果。以峰面积(响应值)作为选择标准,每一浓度测定3次,取平均值。结果如图1所示,这10种多酚类化合物在0.1%甲酸时信号强度最好。所以选择流动相中添加0.1%甲酸。
2.1.2 质谱参数的选择
对10种多酚类物质标准溶液进行质谱分析,山奈酚、花青素、氯化飞燕草色素、鼠李金、绿原酸、氯化飞燕草素3-O-β-吡喃葡糖苷、原花青素B2、氯化花青素鼠李葡糖苷、芸香苷、莨菪亭在正离子模式下主要产生M+H+准分子离子峰,其母子离子(m/z)分别为 287.1/152.9、288.07/213.9、303/228.9,331.1/315.9,355.11/163.1,465.1/302.8,579.2/127,595.2/286.8,611.2/302.9,193.05/132.9。 这些离子响应值高且结果稳定、重现性好,杂质干扰也较少,选为定量定性离子对,用于对样品中10种多酚类化合物的定量。10种标准品及内标的质谱响应如图2所示。横坐标为时间(min),纵坐标为响应值。这10种植物多酚类化合物几乎互不干扰,能够得到较好的分离。
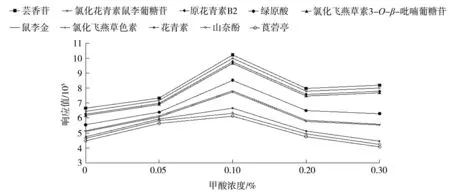
图1 流动相中不同浓度甲酸对10种植物多酚类化合物质谱响应峰面积的影响Fig.1 Effects of formic acid at different concentrations on spectral response peak areas of ten polyphenols in flowing phase

图2 10种植物多酚类化合物混合标准品的多反应监测离子流图Fig.2 A flow-diagram of multiple reaction monitoring ions of ten polyphenols in mixed standard
2.2 方法的日内日间精密度、标准曲线与检出限
2.2.1 日内、日间精密度
标准品混合溶液中山奈酚、花青素、氯化飞燕草色素、鼠李金、绿原酸、氯化飞燕草素3-O-β-吡喃葡糖苷、原花青素B2、氯化花青素鼠李葡糖苷、芸香苷、莨菪亭、伞形花内酯的浓度分别为1.3、1.2、0.8、2.1、2.0、2.0、0.4、2.0、1.5、2.6 μg/mL。连续进样5 d,每天测定5次,考察其精密度。结果如表2所示,所有样品的日内和日间RSD均小于9%,说明仪器状态良好并且稳定。相对于传统的酚类物质分析方法,本方法具有分析速度快、精密度高、稳定性良好等优点。
2.2.2 标准曲线与检出限
用混合标准储备液分别配制用于离子扫描模式的系列浓度的混合标准溶液,每个浓度测定3次,将山奈酚、鼠李金、氯化飞燕草素3-O-β-吡喃葡糖苷、原花青素B2、氯化花青素鼠李葡糖苷、莨菪亭分别配成 25.00、12.50、6.25、3.13、1.57、0.78、0.39、0.19 μg/mL的标准溶液;花青素、氯化飞燕草色素配成 12.00、6.00、4.00、2.00、1.50、1.00、0.50 μg/mL的标准溶液;芸香苷和绿原酸配成500.00、250.00、175.00、87.50、43.75、21.88、10.94、5.47 μg/mL的系列标准溶液,每份标准溶液中内标伞形花内酯均为0.75 μg/mL。以标准品的峰面积与内标峰面积之比(Y)为纵坐标,标准品的浓度(X,μg/mL)为横坐标进行线性拟合,结果见表3。可知,线性拟合的R2在0.999 1~0.999 7之间。表明这10种多酚物质在所试浓度范围内的响应峰面积与其浓度具有较好的线性关系,可以用于后续样品中多酚物质的定量分析。同时,以信噪比3∶1计算得到的检出限在1~200 μg/L之间,发现不同化合物的检出限相差较大。

表2 测定结果的日内RSD(n=5)和日间RSD(n=5)Tab.2 Intra-day RSDs(n=5)and inter-day RSDs(n=5)of the analytical results (%)
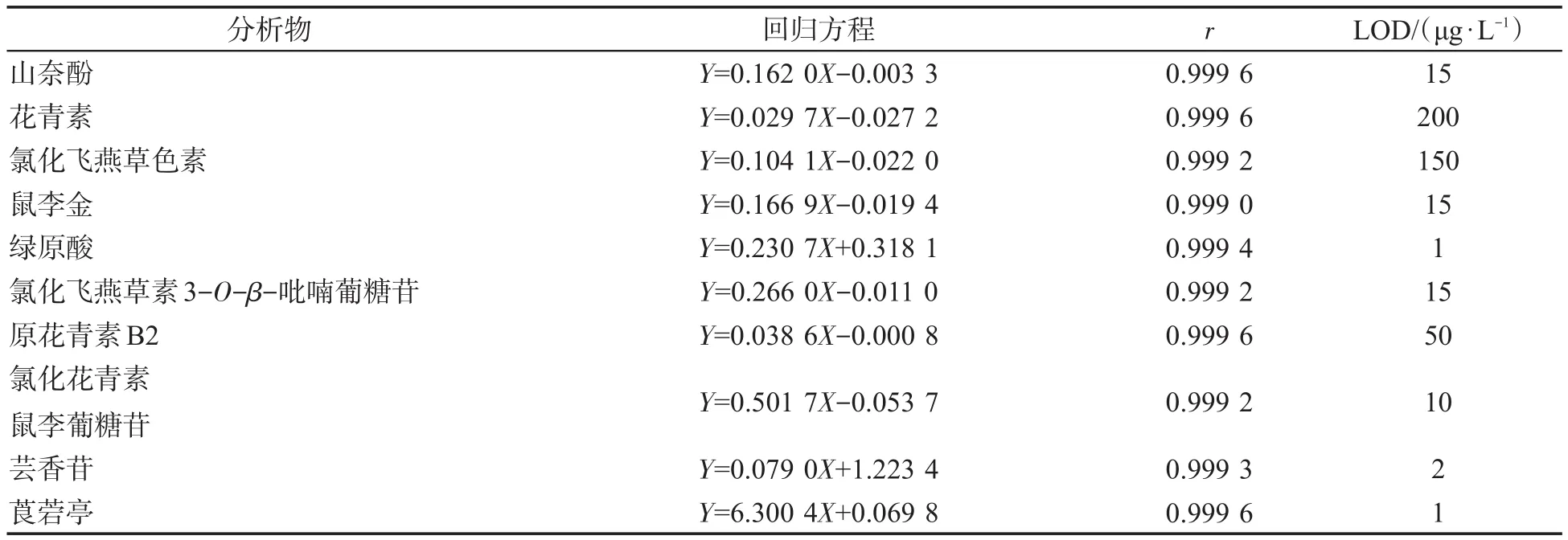
表3 10种植物多酚类物质的线性方程、相关系数及检出限Tab.3 Linear equations,correlation coefficients(r)and limits of detection(LODs)of ten polyphenols
2.3 方法的回收率
方法的加标回收率结果见表4。10种多酚类化合物的加标回收率在79.66%~112.74%之间,表明本方法的可靠性较高。

表4 10种植物多酚类化合物的加标回收率和RSD(n=3)Tab.4 Spiked recoveries of ten polyphenols and RSD(n=3)
2.4 烟叶样品的检测
2.4.1 提取液的选择
由于烟叶样品基质较为复杂,在提取时,不同提取液的提取效率存在差异。因此需要选择合适的提取液,以获得较高的响应值信号。取50 mg干烟叶样品,然后分别用1.5 mL的50%乙醇、80%乙醇、100%乙醇、50%甲醇、80%甲醇、100%甲醇提取液,按照1.2节的方法提取烟叶样品中的多酚类化合物,最后均复溶到200 μL提取液中。图3显示了不同提取液对多酚类化合物检测响应的影响,横坐标为提取液浓度,纵坐标为响应值的对数值。可见,除了鼠李金外,其他多酚类化合物在提取液为80%乙醇或者80%甲醇时,响应值相对较高,且山奈酚、花青素、芸香苷、莨菪亭等多酚类化合物在80%乙醇下的提取效率明显好于80%甲醇。从提取效率、安全性等方面综合考虑,选择使用80%乙醇作为烟叶样品多酚类化合物的提取剂。
2.4.2TMV接种烟叶的PCR测定
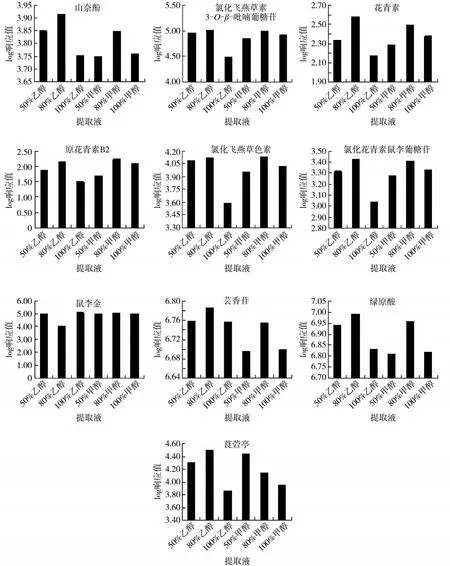
图3 不同提取液对10种多酚类化合物响应值的影响Fig.3 Effects of different extraction solvents on response values of ten polyphenols
1%琼脂糖凝胶电泳检测PCR反应的结果见图4。可见,在3株接种TMV病毒的烟叶上均检测到TMV特异条带,表明接种成功,烟叶已感病,可以用来分析TMV病毒感染对烟叶多酚类化合物质量分数的影响。
2.4.3 TMV病毒感染对烟叶多酚类化合物质量分数的影响
按照建立的方法对接种过TMV的K326烟叶以及其对照组的K326烟叶叶片的10种多酚类化合物质量分数进行测定。每个样品取3个平行样作为生物学重复,采用1.2节的方法进行3次平行测定,根据标准曲线计算得到每种多酚类化合物的质量分数,取平均值,并计算样品间标准偏差(RSD,%);进行T检验分析(表5)。
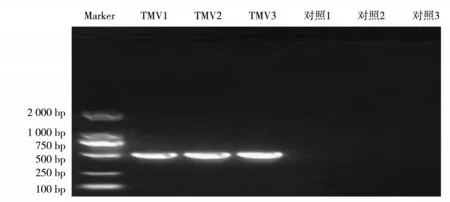
图4TMV特异引物对烟叶样品PCR检测的电泳结果Fig.4 Result of electrophoresis by TMV specific primers for PCR detection of tobacco samples
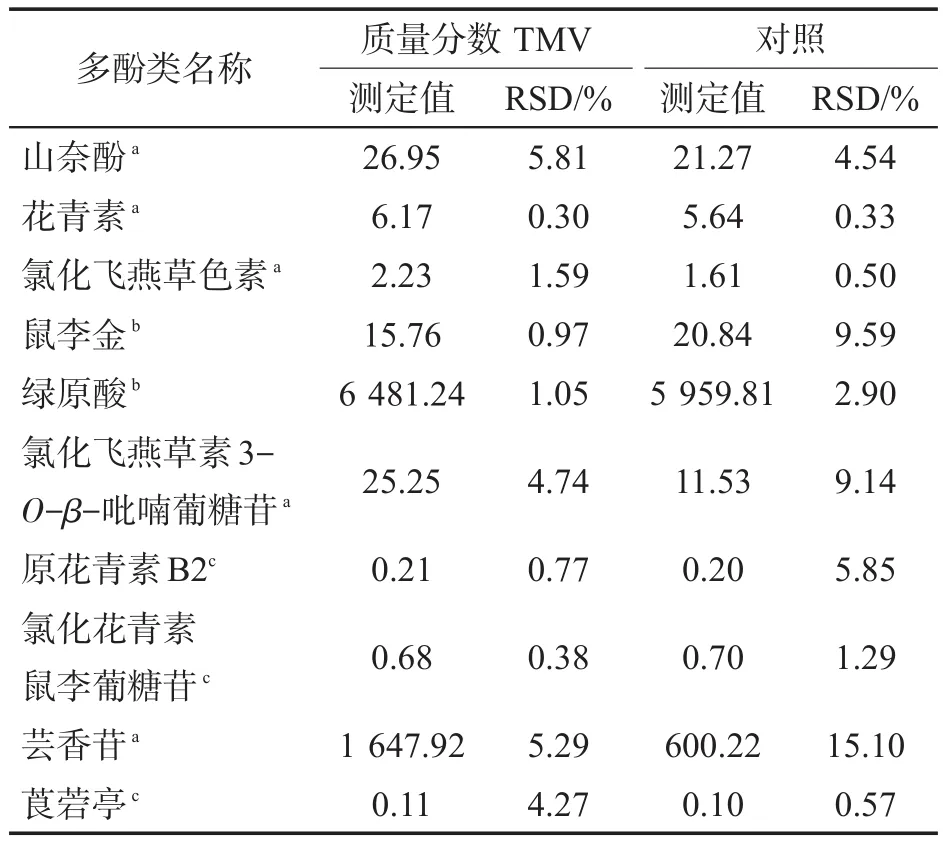
表5 TMV病毒感染对烟叶中10种植物多酚类物质质量分数的影响①Tab.5 Effects of TMV infection on contents of ten polyphenols in tobacco leaves (μg·g-1)
由表5可以看出:感染TMV的植株极显著(p<0.01)增加了烟叶中山奈酚、花青素、氯化飞燕草色素、氯化飞燕草素3-O-β-吡喃葡糖苷、芸香苷的质量分数,显著(p<0.05)增加了烟叶中绿原酸的质量分数,显著(p<0.05)降低了烟叶中鼠李金的质量分数,TMV病毒感染对原花青素B2、氯化花青素鼠李葡糖苷和莨菪亭的影响不大,差异并不显著;TMV病毒感染极大地上调了芸香苷的质量分数,在TMV感病烟叶中,芸香苷质量分数比对照增加了近两倍。有文献报道[21]表明CMV病毒感染的植株中总酚化合物质量分数上升,但未说明具体是哪些酚类化合物上调或上调较大。本研究中TMV感染烟草叶片中的多数多酚类化合物质量分数也升高了,其总酚质量分数也明显增加,主要以芸香苷为主。
3 结论
①建立了利用高效液相色谱—三重四极杆质谱同时分析并定量检测烟叶中10种多酚类化合物的方法,包括山奈酚、花青素、氯化飞燕草色素、鼠李金、绿原酸、氯化飞燕草素3-O-β-吡喃葡糖苷、原花青素B2、氯化花青素鼠李葡糖苷、芸香苷、莨菪亭,该方法的精密度良好、可靠性较高。②利用该方法分析了TMV感染对烟叶多酚类化合物质量分数的影响,山奈酚、花青素、氯化飞燕草色素、氯化飞燕草素3-O-β-吡喃葡糖苷、芸香苷在感染TMV的植株中质量分数显著上升,原花青素B2、氯化花青素鼠李葡糖苷和莨菪亭在感染TMV的植株中质量分数并无显著变化,其他2种多酚类化合物质量分数出现轻微的上调和下调。③本方法可用于同时分析烟叶中的多酚类化合物。

