急性期胰岛素样生长因子-1对动脉瘤性蛛网膜下腔出血院内并发症及短期预后的预测作用
边立衡,赵性泉,2
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)虽然仅占所有卒中的5%,但病死率及致残率非常高[1]。随着微创神经外科及血管内介入治疗技术的进步,动脉瘤的处理已取得了长足的进步[2]。然而,aSAH患者的临床预后依旧不佳,这与aSAH影响患者内分泌功能有一定关系[1-3]。下丘脑和垂体被willis环围绕,对缺血敏感,aSAH后血管痉挛、脑积水、局部出血、静脉回流异常及手术操作会导致垂体和(或)下丘脑功能障碍,从而引起神经内分泌异常,影响患者预后[4-5]。生长激素(growth hormone,GH)缺乏是aSAH后最常见的单一垂体激素分泌异常,GH通过胰岛素样生长因素-1(insulin like growth factor-1,IGF-1)发挥作用[6-7]。有研究表明aSAH急性期IGF-1水平低的患者预后可能较差,但IGF-1水平与疾病严重程度无关[8]。本研究旨在探讨IGF-1水平对aSAH患者院内并发症和短期临床预后的预测价值。
1 研究对象与方法
1.1 研究对象 本研究为单中心、前瞻性队列研究,连续入组2014年10月-2015年11月在首都医科大学附属北京天坛医院就诊的发病72 h内的aSAH患者,所有患者接受DSA检查明确责任动脉瘤。入组标准:①符合国际疾病分类-10(international classification of diseases-10,ICD-10)对蛛网膜下腔出血的诊断标准[9];②年龄≥18岁;③发病72 h内入院并完成静脉血采集;④全脑DSA明确责任动脉瘤;⑤获得知情同意。排除标准:①年龄<18岁,或>80岁;②经证实的非aSAH患者;③发病时间不明或从症状出现到入院超过72 h;④发病72 h不能完成静脉血采集;⑤重大的合并症或晚期疾病。同时入选天坛医院体检中心18~80岁健康人对照,并签署知情同意。
1.2 基线、临床数据收集 收集患者临床基线信息,包括一般资料和病史,即性别、年龄、既往病史(高血压、糖尿病、高脂血症)、吸烟史(目前吸烟)、饮酒史(中重度饮酒,每天≥2个标准量)等;使用Hunt-Hess分级、GCS评分评价患者到院时神经功能状态;记录动脉瘤位置及处理方式。
1.3 实验室数据收集 患者到院后完成实验室指标检测,包括入院次日空腹血糖、发病7 d及14 d空腹血糖,超敏C-反应蛋白、同型半胱氨酸、三酰甘油、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、白细胞、血小板、血红蛋白、纤维蛋白原、部分凝血活酶时间、国际标准化比值、肌酐等。同时测定血浆人和肽素、IGF-1水平。
1.5 和肽素及胰岛素样生长因素-1测定 采集患者血样之前,患者或其家属签署知情同意。获得健康对照组知情同意。空腹至少8 h抽取静脉血,且不超过发病72 h,血液样本收集至含乙二胺四乙酸的试管中,在4 ℃条件下以1500 g的转速离心20 min,取上清(血浆)保存在-80 ℃冰箱中直至测定。所有样本重复2次测定,取平均值作为最终结果。实验由北京天坛医院中心实验室专业人员盲法完成。
血浆中和肽素浓度使用酶联免疫法试剂盒进行测定(美国Phoenix生物药品有限公司,分类号:EK-065-32)。该试剂盒使用“竞争原则”测定和肽素浓度。敏感度:最小检测浓度为0.17 ng/mL;测定线性范围:0.17~2.87 ng/mL。
血浆中IGF-1浓度使用酶联免疫法试剂盒进行测定(英国R&D生物药品有限公司,分类号:DG100)。敏感度:最小检测浓度为0.007~0.056 ng/mL(平均0.026 ng/mL);血浆样本测定线性范围:40~174 ng/mL(平均86 ng/mL)。
1.6 影像学资料收集 患者发病当天完成头颅CT检查,2名影像科医师进行盲法评价,独立进行Fisher分级的评价,若存在争议,则由上级医师复读后决定。
DSA明确责任动脉瘤,由2名影像学医师单独阅片,采用背靠背盲法判断动脉瘤位置及大小。前循环动脉瘤指位于前交通动脉、后交通动脉、大脑中动脉及大脑前动脉的动脉瘤;后循环动脉瘤指位于椎-基底动脉的动脉瘤。
1.7 结局及评价指标 出院时临床功能预后使用mRS评价,mRS评分>2分为预后不良。院内并发症包括迟发型脑缺血、脑积水、颅内感染、肺部感染、泌尿系感染、心血管事件、应激性溃疡、电解质紊乱、低蛋白血症、贫血、焦虑抑郁状态。
院内并发症的定义:①迟发型脑缺血:aSAH 3 d后出现的属于某支颅底动脉支配区的脑组织缺血,造成的神经功能缺损或GCS下降>2分,排除再出血、脑积水或全身状况恶化等原因,CT或MRI上显示明确的梗死病灶。②脑积水诊断标准:双侧脑室额角尖端距离>45 mm;两侧尾状核内缘距离>25 mm;第三脑室宽度>6 mm;第四脑室宽度>20 mm。以上标准满足任何一项且除外原发性脑萎缩即可诊断脑积水。③颅内感染:根据临床表现、外周血及脑脊液检查明确诊断,需要临床医疗记录证实。④肺部感染:根据临床表现、实验室检查、胸部X线或胸部CT及痰培养确诊,需要有医疗记录证实。⑤泌尿系感染:确诊依赖于细菌检查证实尿路中的细菌存在。符合以下指标之一即可诊断为尿路感染:新鲜中段非离心尿革兰染色后油镜观察>1个细菌/视野;新鲜清洁中段尿细菌培养计数≥105/mL;膀胱穿刺的尿培养阳性。⑥应激性溃疡伴消化道出血:既往无明显消化道溃疡,发病后出现呕血、黑便及失血性周围循环等临床表现,呕吐物或粪便隐血试验阳性。⑦电解质紊乱:与aSAH密切相关的低钠血症、高钠血症、低钾血症及高钾血症等。⑧低蛋白血症:总蛋白<60 g/L和(或)白蛋白<35 g/L。⑨贫血:主要是根据血红蛋白含量进行诊断,男性血红蛋白<120 g/L,女性<110 g/L。⑩焦虑抑郁状态:汉密尔顿焦虑抑郁自评量表≥7分。
1.8 统计学方法 所有统计处理使用SAS for Windows软件处理系统,P<0.05为具有统计学差异。计量资料符合正态分布的用表示,不符合正态分布的用中位数和四分位数表示;计数资料用率表示。单因素分析中,符合正态的计量资料组间比较用t检验,不符合正态分布的用秩和检验;计数资料用卡方检验。
分别以院内并发症和出院时预后作为因变量,研究收集的可能影响因素为自变量进行单因素Logistic回归分析,P<0.10的变量进入多因素Logistic回归分析。其中Hunt-Hess分级、GCS及Fisher分级作为二分类进行分析,和肽素及IGF-1在回归分析中作为连续变量进行分析。进入Logistic回归方程的统计量都给出未调整及调整后的OR及95%CI值。画出各指标预测临床预后及院内并发症的受试者工作特征(receiver operating characteristic,ROC)曲线,并计算多个变量联合的曲线下面积(area under the cure,AUC)。
2 结果
2.1 动脉瘤性蛛网膜下腔出血组与健康对照组的比较结果 共入组aSAH患者118例,所有患者完成入院时各项评价及院内信息采集,住院期间患者无死亡;共入选122例健康对照。aSAH组与健康对照组在年龄[(54.0±11.9)岁vs(55.4±13.6)岁,P=0.400]和性别分布(女性比例47.5% vs 56.6%,P=0.158)上差异无统计学意义。
aSAH组血浆和肽素浓度较对照组增高[0.624(0.324,0.939)ng/mL vs 0.368(0.221,0.546)ng/mL,P<0.0001],血浆IGF-1浓度较对照组低[69.00(50.98,93.85)ng/mL vs 81.05(69.40,102.78)ng/mL,P<0.0001]。
2.2 动脉瘤性蛛网膜下腔出血出院时预后不良的影响因素
2.2.1 出院时预后不良影响因素分析 单因素分析显示,影响出院时临床预后的变量有年龄、Hunt-Hess分级、GCS、Fisher分级、院内所有并发症、迟发型脑缺血、肺部感染、低蛋白血症、贫血、入院时空腹血糖、14 d空腹血糖、超敏C-反应蛋白及血浆IGF-1浓度(表1)。
调整后Logistic多元回归结果显示,IGF-1浓度越低、入院时Hunt-Hess分级3~5级、住院期间发生迟发型脑缺血及脑积水的患者预后不良风险增加(表2)。
2.2.2 患者出院时预后不良预测因素ROC曲线分析 对于出院时预后不良进行预测,血浆IGF-1降低(≤63.20 ng/mL)的AUC为0.687(95%CI 0.596~0.770,P=0.0003),Hunt-Hess分级的AUC为0.688(95%CI 0.596~0.770,P<0.0001),迟发型脑缺血的AUC为0.807(95%CI 0.724~0.874,P<0.0001)。此外,脑积水虽然对出院时预后不良产生影响,但预测价值却很有限,AUC为0.542(95%CI 0.448~0.634,P=0.1265)(图1)。根据以上4个变量对患者出院时预后不良进行预测的AUC为0.923。
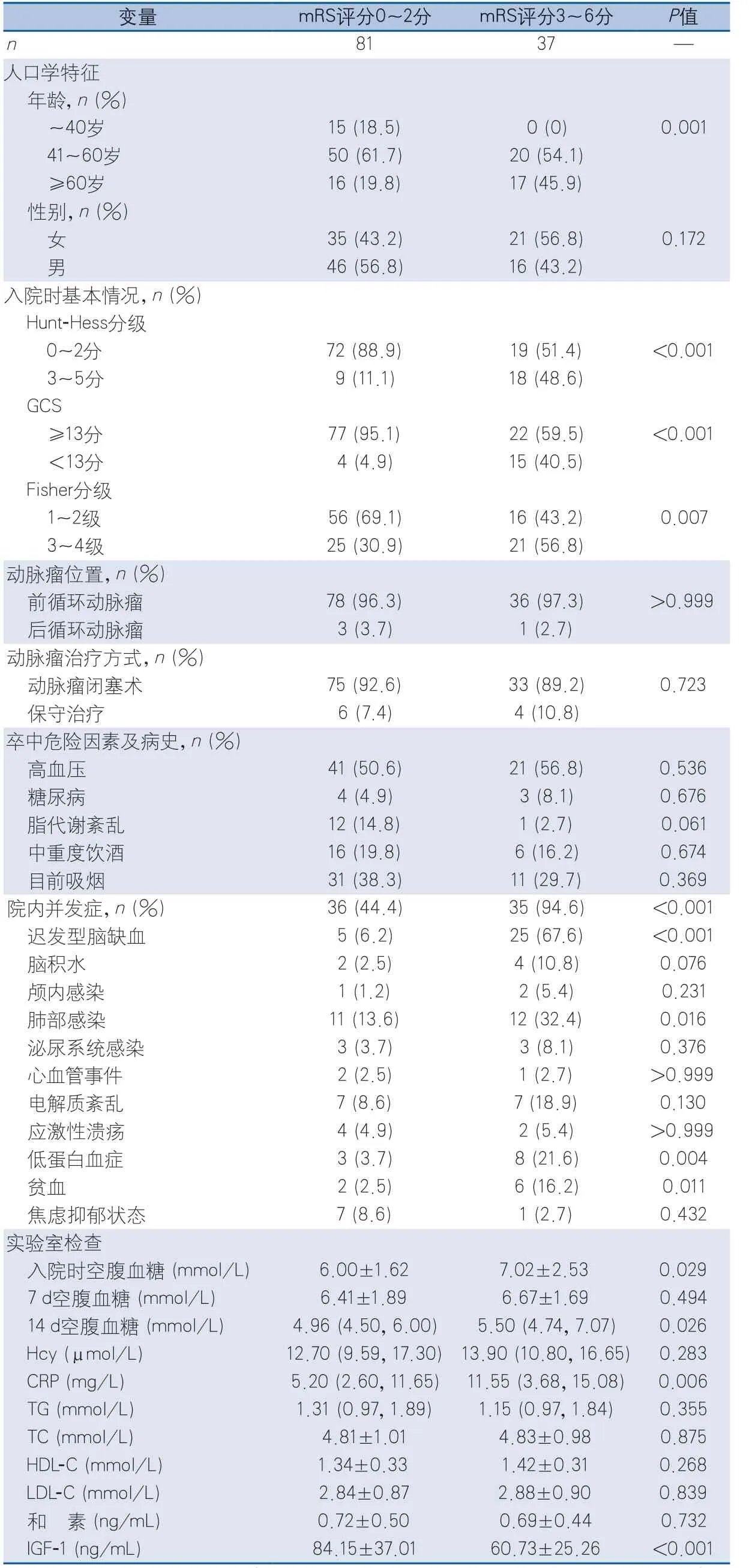
表1 患者出院时预后不良相关因素分析
以上4个预测指标中,除了脑积水外,其他3项指标AUC没有统计学差异(IGF-1 vs 迟发型脑缺血,P=0.1034;IGF-1 vs Hunt-hess分级,P=0.9952;迟发型脑缺血 vs Hunt-Hess分级,P=0.0615;迟发型脑缺血 vs 脑积水,P<0.0001;Hunt-Hess分级 vs 脑积水,P=0.0086;IGF-1 vs 脑积水,P=0.0101)。IGF-1与Hunt-Hess分级、迟发型脑缺血的预测价值基本相同。
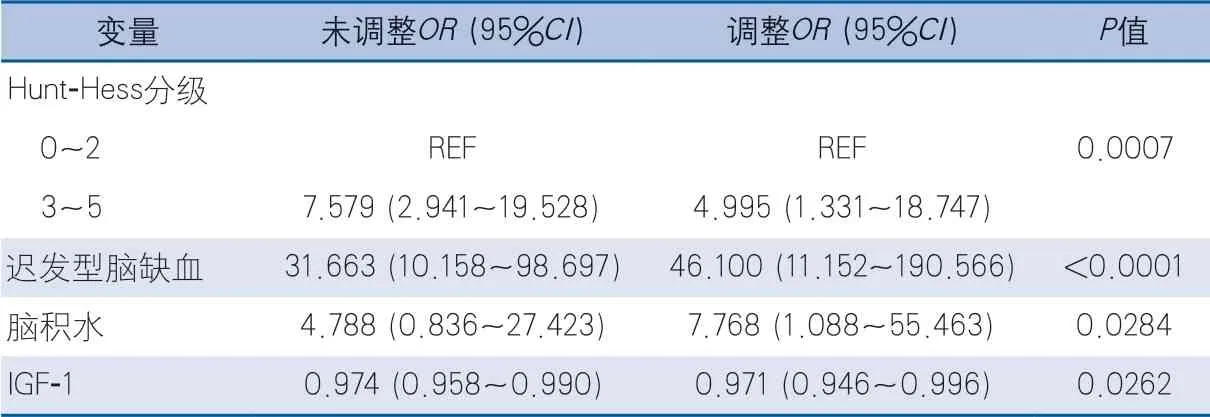
表2 患者出院时预后不良影响因素Logistic回归分析
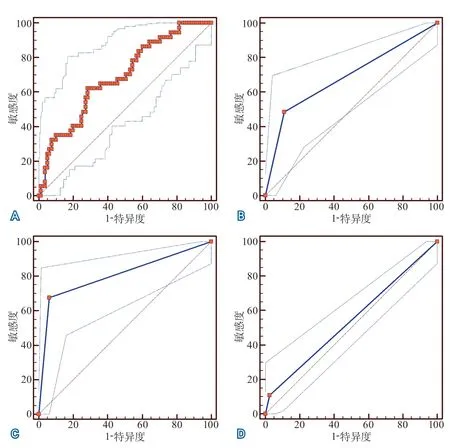
图1 患者出院时结局不良预测因素的ROC曲线
2.3 动脉瘤性蛛网膜下腔出血院内并发症相关因素分析
2.3.1 院内并发症影响因素 单因素分析显示,影响院内并发症的变量有Hunt-Hess分级、GCS、脂代谢紊乱、入院时空腹血糖及血浆IGF-1浓度(表3)。
使用Logistic回归对各个变量进行逐一分析,未调整时,影响院内并发症的变量主要为入院时Hunt-Hess分级、GCS及血浆IGF-1浓度。
将以上3个变量及性别、年龄、Fisher分级引入Logistic多元回归进入调整后得出,仅有血浆IGF-1浓度是院内并发症的独立影响因素。入院时Hunt-Hess分级3~5级和GCS均无统计学意义(表4)。
2.3.2 患者院内并发症预测因素ROC曲线分析 虽然在Logistic回归中,仅有IGF-1进入最后的方程,但由于Hunt-Hess分级及GCS对患者的院内并发症皆有重要预测作用,故同时作出以上3个变量的ROC曲线。对院内并发症进行预测,血浆IGF-1水平较低(≤118.6 ng/mL)的AUC为0.625(95%CI 0.531~0.712,P=0.0184),Hunt-Hess分级的AUC为0.602(95%CI 0.508~0.691,P=0.0045),GCS的AUC为0.581(95%CI 0.486~0.671,P=0.0087)(图2)。将以上3个变量放进方程中进行分析,AUC仅为0.668。
以上3个预测指标,IGF-1与Hunt-Hess分级、GCS的预测价值基本相同(IGF-1 vs Hunt-Hess分级,P=0.6909;GCS vs IGF-1,P=0.4231)。
3 讨论
本研究验证血浆IGF-1对aSAH短期预后及院内并发症的预测作用,发现aSAH后,血浆中IGF-1浓度较健康对照低;入院时IGF-1浓度可预测患者短期预后和患者院内并发症。
aSAH患者结局与主要神经功能缺损、心血管功能、神经内分泌功能及心理情绪障碍等有关。下丘脑和垂体供血动脉为终末动脉,对损伤特别敏感,容易受到出血的影响。脑积水、局部出血、微小梗死灶、静脉引流障碍、血管痉挛及外科手术操作都会对aSAH患者的垂体和(或)下丘脑造成影响,因此aSAH患者神经内分泌异常的发生率可能较高[4]。近些年来,研究人员对aSAH后神经内分泌变化进行了较多研究,虽然结论并不一致,但大多数研究认为GH分泌减少可影响患者长期预后[6,10]。GH通过IGF-1发挥作用,IGF-1不仅影响神经元生长,同时还影响神经细胞死亡、凋亡及神经调节[11]。许多疾病急性期IGF-1水平都出现下降,有研究表明IGF-1对脑梗死和脑出血预后不良有较高的预测价值[12-13]。aSAH急性期IGF-1显著下降的患者死亡率增高,故有人推测其在aSAH急性期脑损伤中起到重要作用。有研究证实aSAH后IGF-1水平下降,且患者功能预后与IGF-1下降水平有关,但该研究入组患者仅有30例,样本例数偏小[8]。本研究发现aSAH患者出院时预后不良的患者IGF-1水平较低。IGF-1与Hunt-Hess分级、迟发型脑缺血对预后不良的预测能力类似(AUC没有差异),优于脑积水的预测价值。这些研究结果说明,IGF-1水平与疾病严重程度有关系,可能与出血多的患者垂体或下丘脑受损明显有关。既往研究认为和肽素可反映中枢水平的机体应激情况,对于aSAH远期预后具有一定的预测价值,但本研究没有发现和肽素对aSAH患者住院期间的并发症及短期预后具有预测价值[14]。
在院内并发症方面,虽然在单因素分析中,Hunt-Hess分级、GCS、发病14 d空腹血糖及IGF-1浓度均有预测价值,但调整过其他因素后,仅有IGF-1降低可预测院内并发症。故IGF-1水平下降对于aSAH来说是强而有力的预测指标。这种血液标记物对疾病严重程度的反应较传统的Hunt-Hess分级、GCS及Fisher分级更加准确。
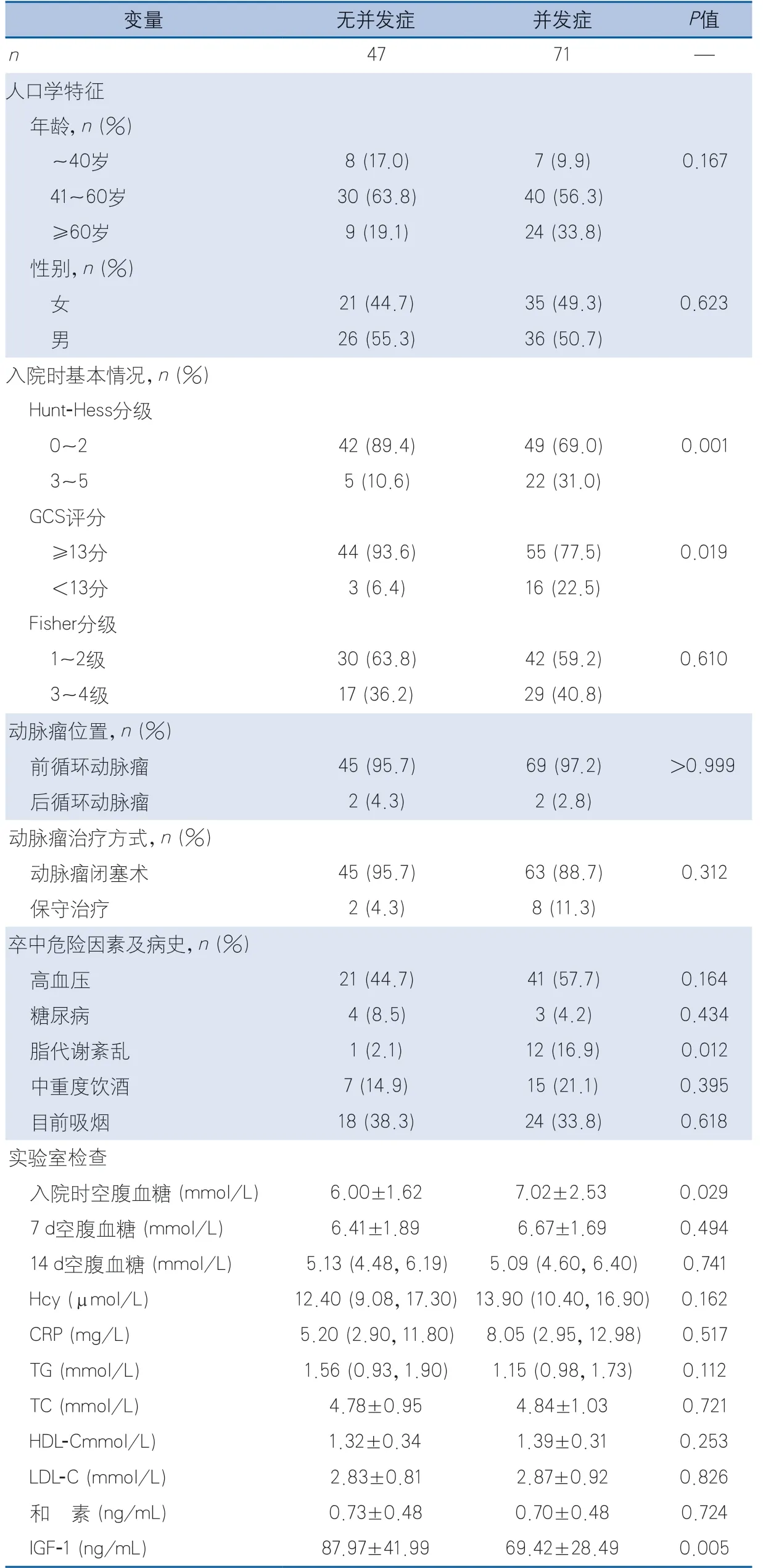
表3 患者院内并发症影响因素分析
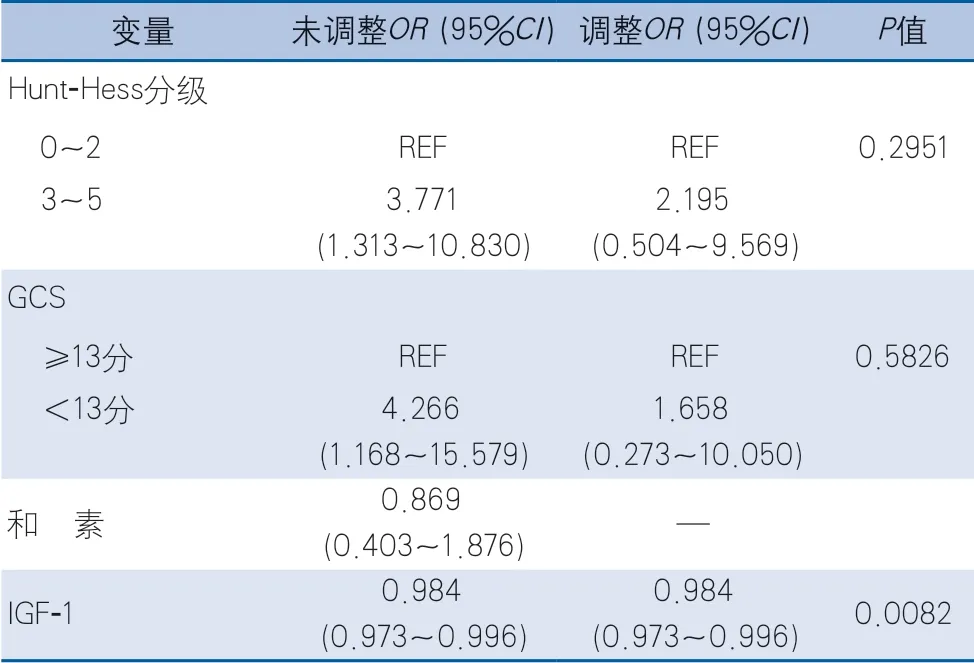
表4 患者院内并发症影响因素Logistic回归分析
本研究具有一定的局限性。首先,本研究仅有一个采血时间点,皆在患者接受动脉瘤填塞术之前,并没有动态观察IGF-1的变化;其次,虽然60.2%的患者出现院内并发症,但最常见的迟发型脑缺血也只有30例(25.4%),故样本量限制了对各种并发症进行逐一分析;第三,出院时随访时间尚短,事件发生率较低,没有死亡病例,故无死亡相关危险因素分析。
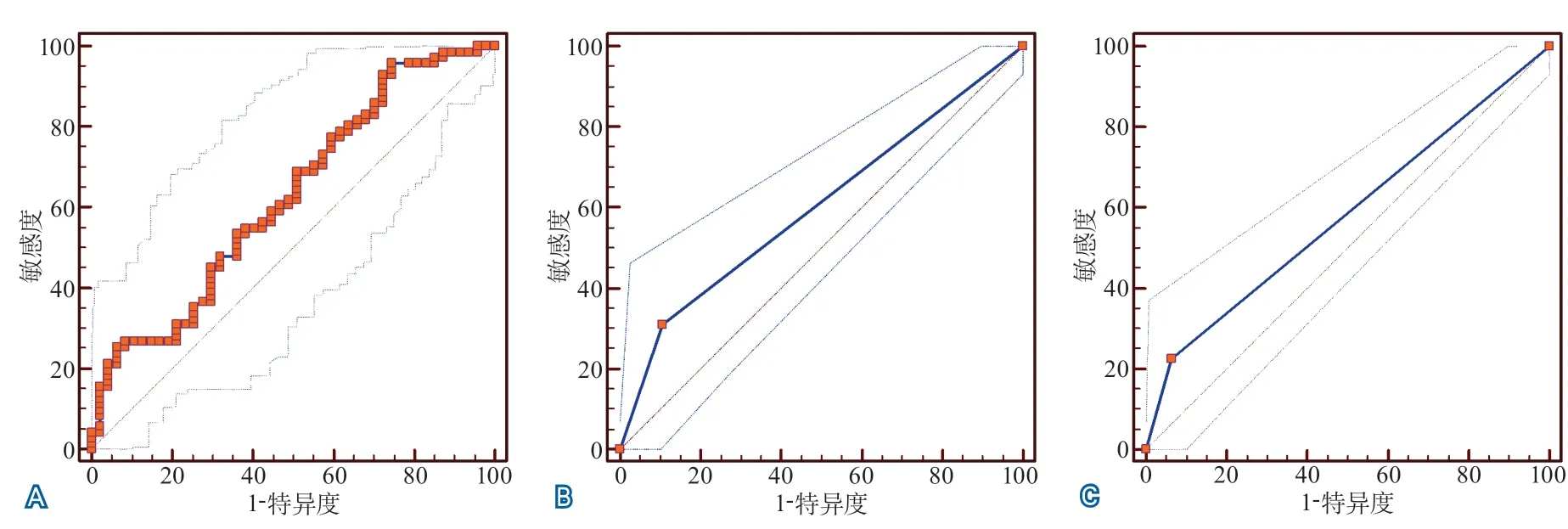
图2 院内并发症预测因素的ROC曲线
【点睛】本研究通过多因素分析发现血浆胰岛素样生长因子-1水平降低可以预测动脉瘤性蛛网膜下腔出血患者出院时预后不良及院内并发症的发生。

