山丹种子表面灭菌方法筛选试验初报
陈静 李发虎 李龙梅 侯佳

摘 要 山丹别名细叶百合,为百合科百合属卷瓣组的多年生草本植物。山丹抗性强、花期长,极具观赏价值,是北方地区难得的城市绿化、美化材料。为提高组织培养效率,加快山丹的工厂化育苗进程,以3年生细叶百合种子为试材,观察无菌播种中不同表面灭菌方法对污染率、种子生长情况的影响,结果表明在光照强度2 000 lx、温度(25±2) ℃的培养条件下,用75%乙醇消毒30 s配合0.1%NaClO处理15 min,可以取得较高的发芽率,保证较高的幼苗质量。
关键词 山丹;组织培养;品种改良;污染率;发芽率
中图分类号:S682.2+9 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2019.16.017
山丹(Lilium pumilum DC.)别名细叶百合,为百合科(Liliaceae)百合属(Lilium)卷瓣组的多年生草本植物。我国野生山丹种质资源丰富,在河北、河南、陕西、山西、山东、内蒙古、甘肃、宁夏、辽宁、吉林、黑龙江、青海、北京等多省(市)广泛分布[1]。山丹适应性强,具有较强的抗寒、抗旱性和抗病害能力,且花期长,是北方地区难得的城市绿化、美化材料。山丹具抗寒、抗病等优良性状,是百合抗性育种和品质改良的重要基因资源[2-4]。山丹中含有甾体皂苷、生物碱、磷脂、硝酸甘油酯、多糖等多种活性成分,具有抗抑郁、抗氧化、抗炎、抗癌等生物活性[5]。近年来人们逐渐认识到山丹广阔的应用前景,在组织培养和品种改良方面做了大量工作,推进其产业化进程。
百合属植物具有较高的再生能力,已经报道的组织培养方法达40多种[6]。组织培养可以有效提高山丹繁殖效率,改善品质退化等,目前已经建立了山丹离体快繁的再生体系,并对山丹组培苗的继代培养、生根培养及移栽条件进行了研究[7-10]。在实践操作中,山丹组织培养存在生长缓慢、愈伤组织诱导率低、分化缓慢等問题,不利于工厂化生产推广。前人的研究表明,山丹种子在20~25 ℃时,有较高的萌发率,近90%,栽培后,种子萌发率下降至不足60%。弱光(10~20 μmol·m-2·s-1)能有效缩短山丹种子萌发完全所需的时间,并提高种子萌发率[11-12]。
1 材料与方法
1.1 试验材料
试验材料为蒙草公司种质资源研发中心种质圃内栽培的3年生细叶百合种子。采种时间为2016年9月,将采收的细叶百合种子置于4 ℃低温黑暗处保存。本试验选择饱满、胚清晰(胚长≥1/2种长)的种子为材料,于2017年3—5月在内蒙古农业大学职业技术学院科技园区组织培养中心进行。
1.2 试验方法
1.2.1 预处理
试验参考马仪迪等[12]的巨球百合种子无菌播种方法进行。将种子置于添加洗洁精1~2滴的水溶液中浸泡30 min,去除干瘪的种子;流水冲洗2~4 h,用软毛刷轻轻刷洗种子表面,并用无菌滤纸吸干种子表面水分。
1.2.2 灭菌处理
在超净工作台内,首先用70%乙醇消毒30 s,再用无菌水振荡冲洗3次;以1%NaClO和0.1%的升汞做振荡处理(灭菌时间分别为0, 5, 10, 15, 20, 25, 30 min),再用无菌水荡洗3次,用灭菌滤纸吸干水分后,将种子接种到MS培养基上。试验采用单因素完全随机设计,每个处理重复3次,每个重复接种3瓶,每瓶接种5枚种子。
1.2.3 培养条件
培养基为MS培养基,添加6-BA 0.5 mg·L-1和NAA 0.1 mg·L-1这两种植物激素。无菌培养室光照度约2 000 lx,每天光照13 h,培养温度为(25±2)℃。每天观察种子发芽情况,以胚根露出种皮1~2 mm作为发芽标志。
1.2.4 数据记录与统计分析
培养14 d后观察组培苗的灭菌效果,统计各处理无菌苗的污染率。培养21 d后统计发芽率,并用螺旋测微尺测量胚芽长度。
污染率(%)=发生污染的种子数/接种的种子数×100;
发芽率(%)=发芽的种子数/接种的种子数×100。
2 结果与分析
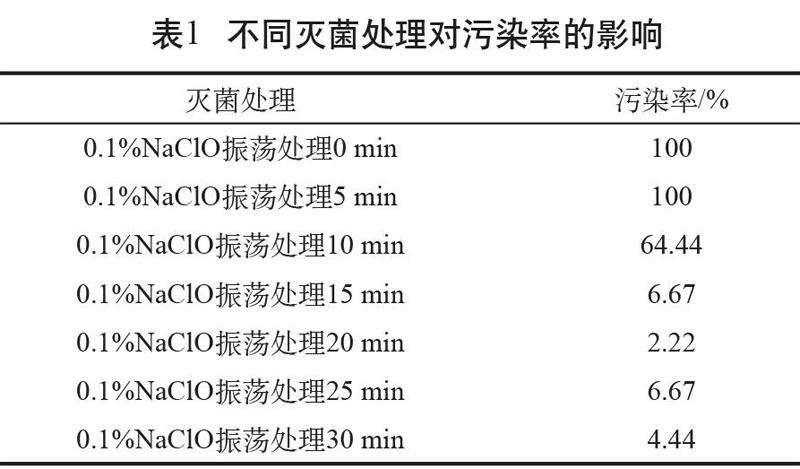
2.1 不同灭菌处理对污染率的影响
随着0.1%NaClO处理时间增加,污染率明显降低(见表1),其中振荡0 min、5 min处理的种子污染严重,污染率都为100%;振荡处理10 min的污染率明显降低,为64.44%;处理15 min后,污染率降到6.77%;随着处理时间的继续增加,污染率稳定在10%以下,分别为2.22%、6.67%、4.44%。
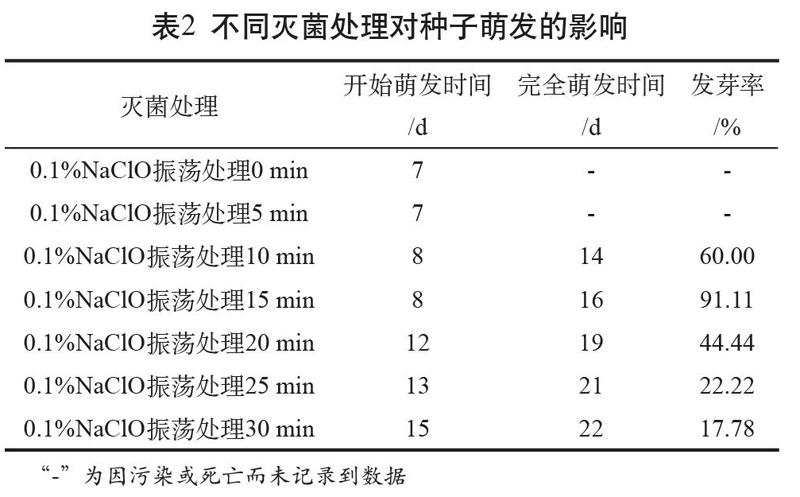
2.2 不同灭菌处理对种子发芽情况的影响
经0.1%NaClO处理时间在15 min以内的细叶百合种子,开始萌发时间变化不大,都为7~8 d,而处理20 min、25 min、30 min的种子开始萌发时间较晚,为12 d、13 d、15 d(见表2)。随着0.1%NaClO处理时间增加,细叶百合种子的完全萌发时间逐渐延长(除0 min、5 min处理因污染未记录数据),其中10 min和15 min两个处理的完全萌发时间最短,为14 d和16 d,30 min处理的完全萌发时间为22 d。发芽率记录结果显示,0 min、5 min处理因污染严重未记录到数据;10 min处理的发芽率明显增加,为60%;处理15 min的发芽率最高,为91.11%;之后随着处理时间增加,发芽率呈逐渐下降的趋势。
经0.1%NaClO处理不同时间的细叶百合种子,胚芽伸长情况为(0 min、5 min、30 min因污染、死亡或胚芽过短未得到数据)随着处理时间增加,胚芽长度先升增大后减小(见表3),其中处理15 min的胚芽最长,为1.545 0 cm。
3 小结
随着山丹独特的观赏价值、良好的生态适应性、药用和营养价值逐渐被市场认可,其生产规模将逐渐扩大,工厂化育苗生产将提上日程。与其他百合科植物相比,山丹组织培养增值率低、分化缓慢,在工厂化生产中存在瓶颈。百合种子发芽率高、生长迅速,但发芽持续时间长,可达40 d以上[11],生长情况也参差不齐,不符合规模化生产要求。无菌播种开始萌发时间短、发芽持续时间短,生长情况较为接近,可以作为山丹工厂化生产的有效切入点。
污染是无菌播种过程中的重要问题,决定无菌播种成败的关键。山丹种子常携带大量微生物且难以清除,故明确无菌播种中种子的生理状态,筛选最佳灭菌剂种类、灭菌时间及灭菌方法等都是需要解决的问题[13-14]。
试验结果表明,0.1%NaClO处理时间在5 min以内的,灭菌效果不理想;处理时间在15 min及以上的,灭菌效果较好,且随着灭菌时间延长,污染率逐渐降低,胚芽生长健壮。0.1%NaClO处理时间在15 min及以下的,开始萌发时间和完全萌发时间变化不大,处理20 min以上的开始萌发时间和完全萌发时间表现为随着处理时间延长而明显增加。随着0.1%NaClO处理时间的增加,山丹种子的胚芽长度先增大后减小,在15 min处理达到最大,之后呈明显下降趋势,这说明较长时间的0.1%NaClO处理对山丹种子的萌发会产生不良影响。
综上所述,山丹无菌播种在光照强度2 000 lx、温度(25±2) ℃的培养条件下,用75%乙醇消毒30 s配合0.1%NaClO处理15 min,可以取得较高的发芽率,保证较高的幼苗质量。
参考文献:
[1] 刘冬云,刘燕.山丹不同居群花器官的形态多样性研究[J].植物遗传资源学报,2012(6):997-1004.
[2] 李守丽,石雷,张金政,等.百合育种研究进展[J].园艺学报,2006(1):203-210.
[3] 张悦,王健鹂,王秀峰,等.野生细叶百合组织培养体系的建立[J].北方园艺,2015(11):95-97.
[4] 杨利平,孙晓玉.细叶百合的生殖特性和繁育规律研究[J].园艺学报,2005(5):153-156.
[5] 高淑怡,李卫民,高英.HPLC法测定百合、卷丹、细叶百合中3种甾体皂苷的含量[J].中药新药与临床药理,2012(6):675-678.
[6] 莫帼超.青海东南部部分山丹百合表型多样性分析[A].中国园艺学会球根花卉分会.中国球根花卉研究进展2011[C].中国园艺学会球根花卉分会:中国园艺学会,2011:8.
[7] 李小英,王文和,赵剑颖,等.百合‘白天使与山丹远缘杂交胚胎发育的细胞学研究[J].园艺学报,2010,37(2):256-262.
[8] 刘冬云,史寶胜,李银华,等.不同碳源及PP33、GA3对山丹组培苗鳞茎增大的影响,2005,2(28),32-35.
[9] 刘冬云,孟庆瑞,郭庭杰,等.山丹启动培养中生理生化特性的研究[J].植物生理科学,2005,7(21),204-207.
[10] 陈丽静,殷小娟,李俊岚,等.细叶百合鳞片诱导与遗传转化组培体系的建立[J].西南农业学报,2013(2):718-722.
[11] 杨利平,杨青杰,文惠民.细叶百合的种子萌发[J].东北林业大学学报,2002(5):70-72.
[12] 马怡迪,李岳,李丹青,等.巨球百合无菌播种影响因素的研究[J].湖南农业大学学报(自然科学版),2015(3):271-275.
[13] 王栋,买合木提,玉永雄,等.沟叶结缕草组织培养表面灭菌方法的筛选[J].安徽农业科学,2008,36(20):8560-8561.
[14] 黎萍,彭靖茹,苏文潘.木薯外植体表面灭菌与增殖培养的研究[J].安徽农业科学,2011,39(32):19698-19699.
(责任编辑:易 婧)

