GC-MS法对13种植物油中甾醇和脂肪酸的分布研究
熊小平 杨明 樊淑宏 罗婷婷 徐小平

摘要:该文建立GC-MS法对植物油中的甾醇和脂肪酸含量进行測定,研究常用植物油中甾醇和不饱和脂肪酸的分布规律。采用程序升温法,由安捷伦毛细管GC柱HP-5MSUI(30m×0.250mm×0.25μm)和HP-88(60m×0.250mm×0.2μm)分离植物油中的甾醇和脂肪酸。结果表明,植物油经皂化,正己烷提取后进样分析,在24~420μg/mL的范围内菜籽甾醇等5个甾醇的线性关系良好(R=0.9991~0.9995),检测限在1~2μg/mL;13种植物油中均检出β-谷甾醇(含量79.54~6185.42mg/kg),均未检出菜籽甾醇和麦角甾醇,其中橄榄油和小麦胚芽油中无豆甾醇,牡丹油和山茶籽油中无菜油甾醇。13种植物油均富含不饱和脂肪酸(76%~92%),同时含有较丰富的多不饱和脂肪酸(PUFA)的ω-3系和ω-6系,可按比例调配食用,补充机体修复所需。所建立的GC-MS检测法可快速灵敏地适用于植物油中的甾醇类和脂肪酸类组分的定量分析。
关键词:植物油;甾醇;脂肪酸;GC-MS
中图分类号:O657.6
文献标志码:A
文章编号:1674–5124(2019)02–0064–08
0 引言
植物甾醇和不饱和脂肪酸是近年来食药领域特别关注的天然组分,具有较高的食用和药用价值[1-3]。植物甾醇是一类天然功能活性物质,在植物油中含量较高[4],可作为质量指标用于植物油的定级、认证、油掺杂打假和追溯原始脂质和植物油的来源[5-6]。常见的植物甾醇有谷甾醇、菜油甾醇、豆甾醇、菜籽甾醇和麦角甾醇,β-谷甾醇和菜油甾醇比较丰富,占甾醇的65%和30%[2-3]。脂肪酸是植物油中含量最高的活性营养成分,多以甘油酯的形式存在[7],分为饱和脂肪酸(SFA)和不饱和脂肪酸(UFA),根据双键的数目分为单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)[8-9]。中国营养学会推荐脂肪酸日摄入量约20%~30%,且S∶M∶P≈1∶1∶1[10]。其中,ω-3和ω-6系PUFA具有更高的生理活性,且二者的比例对机体有重要影响[11],推荐比例ω-6∶ω-3为(4~6)∶1。ω-3摄入过多会损伤肠粘膜,而摄入ω-6过多易造成癌症、心血管疾病、关节炎以及自身免疫疾病的发生并抑制ω-3的抗抑郁作用[12-14]。因此,对植物油中的甾醇和脂肪酸进行检测是十分必要的。
有关植物油中甾醇和脂肪酸的分离检测已有不少报道,常见的甾醇测定方法有衍生后的GC法[15],其衍生化条件复杂,且对衍生化试剂要求较高;薄层色谱与GC-MS/FID结合的方法[16],其前处理步骤复杂,对实验人员的技术要求较高;还有报道采用高效液相对甾醇进行分析的方法[17],虽然能较为简便地测出甾醇总量,但对于甾醇的组成却无法分析。而针对脂肪酸GC-MS法是较为经典的方法[18],考察的脂肪酸的数量还可以有所增加。本研究拟建立GC-MS的方法,通过皂化等前处理后,对13种常见植物油的5种植物甾醇和37种脂肪酸进行检测,其前处理方法简单,实验操作简便,检测甾醇和脂肪酸的种类完善,对甾醇和脂肪酸的分布规律进行了系统考察。为植物油的质量控制和食用指导,提供相关物质基础和分析方法。
1 材料与仪器
1.1 材料
37种脂肪酸甲酯混标(Sigma-Aldrich);菜籽甾醇(Toronto Research Chemicals,98%);麦角甾醇、豆甾醇(98%,一飞生物);β-谷甾醇、菜油甾醇对照品(98%,PushBio-Technology);氢氧化钾、氢氧化钠、氯化钠(AR,成都市科龙化工试剂厂);无水乙醇(AR,天津市美琳工贸有限公司);正已烷、甲醇(色谱级,赛默飞世尔科技有限公司);14%BF3-甲醇溶液(Sigma-Aldrich);沙棘油、山茶籽油、橄榄油、青刺果油、亚麻籽油、杏仁油、紫苏油、火麻籽油、小麦胚芽油、葡萄籽油、牡丹油、月见草籽油、清脉油(成都悟道科技有限公司)。
1.2 仪器
XS205电子分析天平(瑞士MettlerToledo公司);HP-5MSUI气相色谱柱(30m×0.250mm×0.25μm),HP-88气相色谱柱(60m×0.250mm×0.2μm),GC-MS(7890A)(安捷伦科技有限公司)。
2 实验方法
2.1 GC-MS条件
2.1.1 甾醇测定
安捷伦HP-5MSUI毛细管柱(30m×0.250mm×0.25μm);进样器温度300°C;程序升温:120°C以12°C/min升至300°C,300°C保持20min;高纯氦气为载气;流量为1mL/min;进样量1μL,不分流进样;溶剂延迟7min。
2.1.2 脂肪酸测定
安捷伦HP-88气相色谱柱(60m×0.250mm×0.2μm);进样口温度260°C;升温程序:100°C以3°C/min升至150°C,保持2min,以3°C/min升至240°C;载气为高纯氦气;柱流量为1mL/min;进样量1μL,分流比40∶1;溶剂延迟4.2min。
2.1.3 质谱条件
离子源温度230°C;电离源为EI,电子能量70eV;传输线温度300°C;四级杆温度150°C;扫描质量范围为35~500amu。
2.2 对照溶液的配制
2.2.1 甾醇
分别取菜籽甾醇、麦角甾醇、菜油甾醇、豆甾醇、β-谷甾醇的对照品各10mg,精密称定,置于10mL量瓶中并用正已烷溶液稀释定容作为混合对照储备液。储备液置于4°C冰箱内保存备用,测定时取储备液用正己烷稀释成含5种甾醇对照品质量浓度为100μg/mL作为对照溶液。
2.2.2 脂肪酸
取37种脂肪酸甲酯混标100μL,置于10mL容量瓶中并用正已烷溶液稀释定容即得,用于气相色谱条件优化以及脂肪酸甲酯的定性。
2.3 供试品溶液的制备
2.3.1 甾醇
称取约0.5g植物油于试管中,加入2mol/L的KOH-C2H5OH溶液5mL,充分振荡后于75°C水浴皂化60min取出,冷却后加入5mL水,再用5mL正已烷充分涡旋提取,静置分层,吸取上层有机相,置离心管,于3000r/min离心20min,取上清液经0.22μm微孔滤膜过滤后供GC-MS分析。
2.3.2 脂肪酸
称取植物油约0.5g于试管中,加入0.5mol/L的NaOH-CH3OH溶液5mL,充分振荡后于60°C水浴皂化约30min至油滴消失,然后于60°C持续通入氮气吹干溶剂,加入14%BF3-CH3OH溶液5mL,通风橱80°C水浴5min,冷却后加入8mL正已烷充分涡旋提取,静置分层,吸取上层有机相,至离心管,于3000r/min离心20min,取上清液经0.22μm微孔滤膜过滤后供GC-MS分析。
2.4 数据处理方法
采用保留时间结合GC-MSNIST08谱库检索进行定性,甾醇采用外标法定量,脂肪酸采用面积归一化法进行定量。
3 结果和讨论
3.1 甾醇皂化条件的选择
由于植物油中的甾醇属于弱极性化合物,基质中的游离脂肪酸、脂肪酸甘油酯等都会对甾醇的测定产生影响;因此,本研究以火麻籽油为对象,采用皂化处理,通过测定不同条件下油中β-谷甾醇的含量来优化皂化条件。最终确定使用2mol/L的KOH-C2H5OH,在75°C的水浴下皂化60min作为最佳皂化条件。不同条件的皂化结果见表1。
3.2 GC-MS条件选择
3.2.1 甾醇扫描模式分析
甾醇采取全扫描模式是因为本研究只测定了5种常见的甾醇,若采取选择离子扫描模式无法检出其他可能存在的甾醇,而采取全扫描模式结合NIST库就有可能定性测定出除这5种甾醇外的其他非皂化物。虽然此次全扫描模式下,没有在13种植物油中检得有其他种类的甾醇,但是在亚麻籽油、青刺果油、橄榄油、月见草籽油、紫苏油和清脉油非皂化物中发现存在较大量类似环阿屯醇(19.897min)的物质,如图1所示,环阿屯醇是甾醇生物合成的一个重要前体化合物,具有抗炎、抗肿瘤、抗氧化、抗菌、抗阿尔兹海默症等生理活性[19],并且对于植物的生长发育具有显著影响[20]。
3.2.2 脂肪酸测定时分流比和数据处理方法讨论
实验初期使用混标溶液进行预实验,是因为不同植物油中含有脂肪酸种类有较大差异,而混标包含了常见的37种脂肪酸,以它为标准进行条件优化更加具有适应性。在前期预实验过程中,发现在
不分流和分流比为10∶1时,由于进入色谱柱的溶剂量过大,混标溶液中保留时间在4.5min的第1个脂肪酸甲酯峰会被溶剂峰掩盖,而在分流比为40∶1和100∶1的情况下,其不会被掩盖,考虑到节约载气,最终选定分流比为40∶1。
本文采用面积归一化法进行植物油脂肪酸数据处理也是经过大量的前期预实验而得出的,取37种脂肪酸甲酯混标对照进样,采用面积归一化法进行脂肪酸含量测定,将结果与说明中标示含量进行比较,发现两者存在差异,准确度在75%~125%范围内。这里产生的差异可能是来自于混标对照中的溶媒。混标对照的溶媒是二氯甲烷,其具有很强的挥发性,使得混标对照溶液配制过程中具有不可控性,且混标对照品一旦开封就算保存在4°C冰箱,二氯甲烷都会有一定的挥发。因为植物油中脂肪酸成分种类繁多,不同植物油中脂肪酸种类也不尽相同,若全部分别采用单标定量定性测定费时费力,且目前脂肪酸普遍采用GC-MS面积归一化法进行定性定量测定,所以本研究也最终采用面积归一化法对目标植物油中的脂肪酸进行分析,若后期需要对几种重要的脂肪酸进行定量,则可以再采用外标法对其进行准确定量。
3.3 方法学评价
3.3.1 甾醇
1)校正曲线、检测限和定量限
取混合对照储备液稀释成菜籽甾醇、麦角甾醇、菜油甾醇、豆甾醇、β-谷甾醇质量浓度为400,200,100,50,20μg/mL的5组对照品溶液。在2.1.1条件下进样,记录色谱图,分别以5种甾醇峰面积对质量浓度进行线性回归;不断稀释对照溶液进样以信噪比S/N=3作为检测限,S/N=10作为定量限,得到结果如表2所示。由表可知,在测定的范围内,各个甾醇成分的校正曲线的线性较好,且定量限和检测限符合要求,适用于定量分析。
2)重复性和回收率
重复性:取火麻籽油6份,按照2.3.1下方法配制供试品溶液6份在2.1.1条件下分别进样,记录色谱图,对菜油甾醇、豆甾醇、β-谷甾醇进行含量考察,试验结果见表3。表明该方法有良好的重复性。
回收率:取9份火麻籽油中加入适量菜籽甾醇、麦角甾醇、菜油甾醇、豆甾醇、β-谷甾醇对照品,使得含对照120%、100%、80%的高中低每个浓度3份样品,按照2.3.1下方法配制供試品溶液9份在2.1.1条件下分别进样,结果如表4所示,表明该方法具有良好的准确度。
3.3.2 脂肪酸
1)脂肪酸的鉴定
取混标对照溶液按照2.2.2下方法配置对照溶液,在2.1.2所述条件下进样,记录色谱图,通过NIST08谱库检索将其与对照品中含有的脂肪酸甲酯进行一一对应,结果如图2、表5所示。
2)重复性
取沙棘油6份,按2.3.2下方法配制供试品溶液6份,在2.1.2所述条件下分别进样,记录色谱图,由于沙棘油中脂肪酸种类较多,所以选取了沙棘油的7种主要脂肪酸,即棕榈酸、棕榈油酸、硬脂酸、油酸、11-十八碳烯酸、亚油酸和亚麻酸进行含量考察,测定RSD分别为1.6%、1.6%、2.9%、2.1%、4.0%、1.7%、1.8%,结果表明该方法具有良好的重复性。
3.4 含量測定
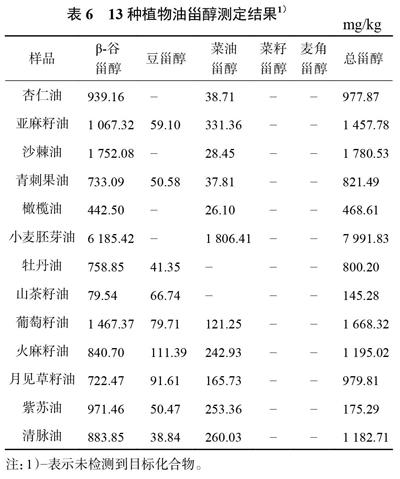
3.4.1 13种植物油中甾醇的分布分析
取甾醇对照品溶液和13种植物油的供试品溶液按照2.1.1条件下进样,纪录色谱图,如图3和图4所示。结果表明:菜籽甾醇、麦角甾醇、菜油甾醇、豆甾醇和β-谷甾醇在该条件均能出峰,并且得到有效分离,方法适用于13种植物油中甾醇含量的测定。
在该方法下对13种植物油中的甾醇含量进行检测,得到结果如表6所示。13种植物油均未检测到菜籽甾醇和麦角甾醇,而均测得有β-谷甾醇;小麦胚芽油中的菜油甾醇含量最高,为1806.41mg/kg,牡丹油、山茶籽油中则未检测到菜油甾醇;火麻籽油中豆甾醇含量最高为111.39mg/kg,杏仁油、沙棘油、橄榄油、小麦胚芽油中未检测到豆甾醇;β-谷甾醇含量最高的是小麦胚芽油为6185.42mg/kg,最低的是山茶籽油为79.54mg/kg。而十三种植物油中,甾醇总含量最高为小麦胚芽油,达7991.83mg/kg,山茶籽油最低,只有145.28mg/kg。
各种甾醇在植物油中的分布差别很大。麦角甾醇和菜籽甾醇都未能检出,结果也与文献相符合[21],麦角甾醇作为生物膜的重要组成部分,仅存在酵母等真菌的细胞以及麦角等少数植物中,而菜籽甾醇也仅存在于一些浮游植物和油菜籽陆生植物中。菜油甾醇、豆甾醇以及β-谷甾醇是大部分植物油中都比较常见的甾醇。13种植物油中,小麦胚芽油的总甾醇含量最高,是其他植物油中总甾醇的数倍,也是目前国际公认最好的油脂。其他植物油虽然总甾醇含量不如小麦胚芽油,但是甾醇种类相对丰富,各甾醇比例大小不一,仍然有各自独特的价值。
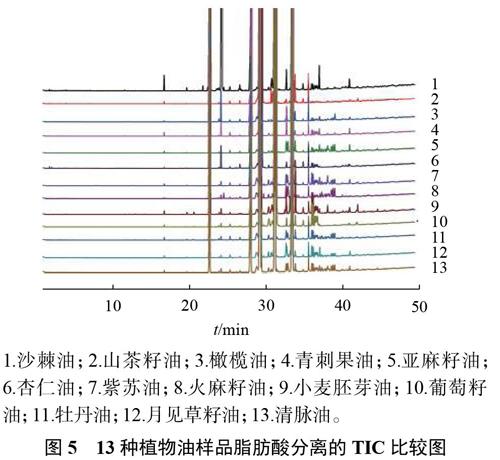
3.4.2 13种植物油中的脂肪酸分布分析
取13种植物油的供试品溶液按照2.1.2条件下进样,纪录色谱图,如图5所示,结果表明:各种脂肪酸甲酯均能出峰,并能得到有效分离。
取植物油按2.3.2下方法配制成供试品溶液后,在2.1.2条件下进样,记录色谱图,通过结合对照保留时间以及NIST08谱库检索对脂肪酸甲酯进行定性,对样品中存在的但混标中不含有的脂肪酸则直接用NIST08谱库检索进行定性,采用面积归一化法进行定量。对13种植物油的测定结果按照饱和脂肪酸(SFA)、不饱和脂肪酸(UFA)、以油酸为主的单不饱和脂肪酸(MUFA)、多不饱和脂肪酸(PUFA)、以亚麻酸为主的ω-3系多不饱和脂肪酸、以亚油酸为主的ω-6系多不饱和脂肪酸进行分类统计,计算各自分别所占的百分比,结果见表7。
由表可知,青刺果油的饱和脂肪酸含量最高,不饱和脂肪酸最低,分别为23.51%和76.48%;杏仁油含饱和脂肪酸最低,不饱和脂肪酸最高,分别为7.25%和92.75%;以油酸为主的单不饱和脂肪酸含量最高的是山茶籽油为83.60%,最低的则是葡萄籽油为12.53%;多不饱和脂肪酸含量最高的是葡萄籽油为75.24%,含量最低的为山茶籽油为7.00%;以亚麻酸为主的ω-3系多不饱和脂肪酸含量最高的是火麻籽油为61.83%,最低的是山茶籽油仅为0.11%;以亚油酸为主的ω-6系多不饱和脂肪酸含量最高是葡萄籽油为74.15%。
3.5 脂肪酸检测中ω-3和ω-6系多不饱和脂肪酸比例讨论
近年经过对ω-3和ω-6系多不饱和脂肪酸的深入研究发现两者之间的比例也对人体健康有着重要的影响。ω-3和ω-6系多不饱和脂肪酸在人体内代谢竞争同一种酶,其中一种摄入过多就会抑制和削弱另外脂肪酸的转化。过多的ω-3摄入会损伤肠粘膜造成肠炎甚至形成溃疡,而过多地摄入ω-6易造成癌症、心血管疾病、关节炎以及自身免疫疾病的发生并抑制ω-3的抗抑郁作用,中国营养学会建议ω-3∶ω-6的比值为1∶(4~6)。由实验结果(表8)可知13种植物油的ω-3∶ω-6比值均不在建议的范围内,多不饱和脂肪酸含量最高的葡萄籽油ω-3∶ω-6比值最低为1∶149.20,而同样含多不饱和脂肪酸很高的火麻籽油ω-3∶ω-6比值则是13种植物油中最高的约为1∶0.20。可以看出不同植物油其脂肪酸的组成比例有着很大的差别,单一的植物油并不能充分提供人体所需,所以目前倡导的一定比例的混合食用油是有充分依据的。
4 结束语
本文建立的皂化后的GC-MS法对13植物油中的5种甾醇和37种脂肪酸进行分布研究,具有前处理简单、操作简便、检测甾醇和脂肪酸种类完善等特点。该方法还具有良好的专属性、准确度和精密度,能准确测定植物油中甾醇和脂肪酸的含量。测定结果可作为质量指标用于植物油的认证、定级、油掺杂打假和追溯植物油的来源。也提示消费者在购买植物油时,不要选择单一来源的植物油,尽量选择对身体健康更有益处的调和油。
参考文献
[1] LERMA-GARCIA M J, SIMO-ALFONSO E F, RAMIS-RAMOS G, et al. Rapid deter mination of sterols in vegetable oils by CEC using methacrylate ester-based monolithic columns[J]. Electrophoresis, 2008(29): 4603-4611.
[2] ALBERICI R M, FERNANDES G D, PORCARI A M, et al. Rapid fingerprinting of sterols and related compounds in vegetable and animal oils and phytosterol enriched-margarines by transmission mode direct analysis in real time mass spectrometry[J]. Food Chemistry, 2016(211): 661-668.
[3] KOZ?OWSKA M, GRUCZYNSKA E, SCIBISZ I, et al. Fatty acids and sterols composition, and antioxidant activity of oils extracted from plant seeds[J]. Food Chemistry, 2016(213): 450-456.
[4] LIN Y, KNOL D, VALK I, et al. Thermal stability of plant sterols and formation of their oxidation products in vegetable oils and margarines upon controlled heating[J]. Chemistry and Physics of Lipids, 2017(207): 99-107.
[5] XU B, ZHANG L, MA F, et al. Deter mination of free steroidal compounds in vegetable oils by comprehensive two- dimensional gas chromatography coupled to time-offlight mass spectrometry[J]. Food Chemistry, 2018(245): 415-425.
[6] LERMA-GARCIA M J, SIMO-ALFONSO E F, MENDEZ A, et al. Fast Separation and Deter mination of Sterols in Vegetable Oils by Ultraperformance Liquid Chromatography with Atmospheric Pressure Chemical Ionization Mass Spectrometry Detection[J]. J. Agric. Food Chem, 2010(58): 2771-2776.
[7] TAHOUN I F. Rapid Method for Assessment of Olive Oil Adulteration with Some Vegetable Oils by Chromatographic Analysis of Fatty Acids Composition[C]//International Conference on Food and Biosystems Engineering, 2015: 44.
[8] JIANG L, ZHENG H, LU H. Application of UV spectrometry and chemometric models for detecting olive oil-vegetable oil blends adulteration[J]. Journal of Food Science and Technology, 2015, 52(1): 479-485.
[9] MA F, YANG Q, MATTHA?US B, et al. Simultaneous deter mination of capsaicin and dihydrocapsaicin for vegetable oil adulteration by immunoaffinity chromatography cleanup coupled with LC-MS/MS[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2016, 1021: 137-144.
[10] STEENHORST-SLIKKERVEER L, LOUTER A, JANSSENH G, et al. Analysis of nonvolatile lipid oxidation products in vegetable oils by normal-phase high-performance liquid chromatography with mass spectrometric detection[J]. Journal of the American Oil Chemists' Society, 2000, 77(8): 837-845.
[11] RYY C, LIU C P, HOU C J, et al. Comparison of fatty acid composition and oxidative stability of peanut oils prepared from spring and fall crops of peanuts[J]. Journal of Agricultural & Food Chemistry, 1995, 43(3): 676-679.
[12] Animal and vegetable fats and oils-Preparation of methyl esters of fatty acids: PN-EN ISO 5509: 2001[S]. Geneva: International Organization for Standardization, 2011.
[13]伍新齡,王凤玲,关文强.植物油脂肪酸甲酯化方法比较与含量测定[J].食品研究与开发,2015(7):84-87.
[14]张征,邹洁,颜春荣,等.不同甲酯化方法对植物油脂肪酸组成测定的影响[J].食品科学,2011,32(s2):61-65.
[15]LECHNERM, REITERB, LORBEERE.Determinationoftocopherolsandsterolsinvegetableoilsbysolid-phaseextractionandsubsequentcapillarygaschromatographicanalysis[J].JournalofChromatographyA, 1999(857): 231-238.
[16]陈帅,毕艳兰,汪学德,等.GC-MS/FID法分析玉米胚芽油中的甾醇和甾醇酯[J].中国粮油学报,2017(5):131-137.
[17]张丽霞,毕艳兰,张康逸.植物甾醇醇与甾醇酯的分离分析方法研究[J].粮油加工与食品机械,2006(2):53-55.
[18]刘冰.GC-MS分析测定5种植物油中脂肪酸成分研究[J].食品工业,2014,35(4):222-224.
[19]张忠廉,罗祖良,石宏武,等.植物药活性成分环阿屯醇药理、生理活性及其研究展望[J].中国中药杂志,2017,42(03):433-437.
[20]GAS-PASCUALE, BERNAA, BACHTJ, etal.Plantoxidosqualenemetabolism: cycloartenolsynthase-dependentsterolbiosynthesisinnicotianabenthamiana[J].PLoSONE, 2014, 9(10): e109156.
[21]盛漪,华伟,谷文英.植物甾醇资源在食品原料中分布[J].粮食与油脂,2002(5):40-41.

