氮掺杂碳点的开关型荧光传感器检测蔬菜中的生物硫醇
何 谐,雒雪丽,李春花,韩 雍,陈秀梅,李忠宏
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
蔬菜中的生物硫醇如谷胱甘肽(GSH)、半胱氨酸(Cys)、N-乙酰半胱氨酸(NAC)、γ-谷氨酰半胱氨酸(GGC)和卡托普利(CAP)等小分子物质在生理系统中起着重要的作用[1]。它们既可以作为抗氧化剂[2]保护细胞免受可能导致癌症和阿尔茨海默病的氧化损伤[3],也可以作为解毒剂和金属离子发生反应。其中,半胱氨酸在侧链上具有巯基,在酶促反应中起到亲核试剂的作用,还可以有效地预防和治疗放射性伤害[4]。还原型谷胱甘肽在细胞的生长、信号传导、基因调节和维持细胞正常功能的氧化还原平衡上起着关键作用[5]。如果将蔬菜或水果暴露在以消毒为目的的辐照和臭氧处理中,其所含有的硫醇可能会发生氧化且导致有毒副产品的产生。因此检测生物和环境样品中的小分子生物硫醇引起科学家们极大的兴趣[6]。
常见检测生物硫醇的方法包括电化学法[7]、比色法[8]、色谱-质谱联用/质谱法(LC-MS/MS)[9]、分光光度法[10]和高效液相色谱法[11]等。这些方法具有灵敏度高和检测限低等优点,但是电化学法、比色法、分光光度法对样品的需求量较大、检测用时较长,HPLC具有操作复杂、费时、所需仪器昂贵等缺点。荧光检测法作为一种既省时又绿色环保的测定方法,受到众多分析测试人员的青睐。
近几年来,荧光探针在生物硫醇检测和应用方面取得了有效进展[12]。目前,检测生物硫醇的荧光传感器主要包括有机染料、分子荧光和传统半导体量子点(QDs)。其中,有机染料容易光漂白,而QDs往往含有重金属元素,因此限制了它们的广泛使用。碳点(CDs)不仅具有与传统量子点类似的发光性能和纳米尺寸特性,还具较毒性较低、制备成本低廉、荧光稳定性和化学稳定性等优点[13],因此利用CDs作为信号源来开发光学纳米传感器成为研究热点。目前,许多基于CDs的传感平台是猝灭型荧光传感器[14]。荧光可以被分析物直接淬灭,根据CDs荧光强度的改变来检测分析物。然而这种检测模型易受环境刺激的影响导致方法的分析性能降低。而开关型荧光传感器模型是根据加入分析物后恢复的荧光进行检测,可以减少外界刺激造成的假阳性,因而具有更好的灵敏度[15]。
尽管研究人员已设计合成了许多识别硫醇的荧光探针,但是对于检测食品基质中生物硫醇的荧光探针未见报道。因此,本文以柠檬酸和尿素为原材料制备氮掺杂碳点(N-CDs),利用Hg2+对CDs荧光有良好的猝灭作用[16],而巯基和汞离子的亲和力更强,故生物硫醇可以将Hg2+从CDs表面竞争下来,从而使得CDs荧光恢复。基于以上原理,本文开发了一种荧光传感器选择性地检测蔬菜中的生物硫醇,对检测体系的pH、Hg2+浓度和孵化时间(荧光淬灭和恢复)进行优化,并对探针的抗干扰性能以及准确度进行初步评价。
1 材料与方法
1.1 材料与仪器
一水合柠檬酸、六水合三氯化铁、氯化钾、氯化锌、氯化钠 广东光华科技股份有限公司;HgCl2山东西亚化学工业有限公司;尿素、氯化锰、氯化镁、冰乙酸 成都市科龙化工试剂厂;抗坏血酸 广东化工摄影工程技术研究开发中心;甘氨酸 北京Solabio科技有限公司;谷胱甘肽、苯丙氨酸、硫酸奎宁、赖氨酸、色氨酸 上海阿拉丁生化科技股份有限公司;透析袋(截留分子量1 Da) 北京索莱宝公司;无水氯化钙 广东光华化学厂有限公司;三水合乙酸钠 四川西陇化工有限公司;所有试剂均为分析纯,未进一步纯化。
UV-2550紫外可见分光光度计 日本岛津公司;HC-3018R高速冷冻离心机 北京仪诺科兴科技发展有限公司;DGG-9030B电热恒温鼓风干燥箱 上海森信仪器公司;Perkin-Elmer LS-55荧光分光光度计 美国铂金埃尔默公司;JEM-2100透射电子显微镜(TEM) 日本JEOL公司;FE20/EL20 pH计 梅特勒-托利多仪器公司;KH-250E超声清洗器 昆山禾创超声仪器公司;Vetex70傅里叶变换近红外光谱(FT-IR) 德国布鲁克公司;CP-224C分析天平 奥豪斯仪器公司。
1.2 实验方法
1.2.1 N-CDs的制备 N-CDs通过水热法[17]并加以改进合成。具体步骤如下:将4.2 g柠檬酸和3.6 g尿素溶解于40 mL蒸馏水中,250 W超声10 min形成透明溶液,将该溶液转移至50 mL聚四氟乙烯内衬反应釜中,在200 ℃下保持4 h。待反应釜自然冷却至室温后,将所得溶液用0.22 μm的水系滤膜过滤后,避光储存于25 ℃下。
1.2.2 N-CDs的表征
1.2.2.1 形貌表征 采用透射电镜观察N-CDs的形貌和微观结构。
1.2.2.2 光学表征 采用荧光光谱法对制备得到的N-CDs进行发光性能表征。采用紫外光谱扫描法在200~800 nm波长范围内,对N-CDs的紫外吸收进行表征。
1.2.2.3 表面基团 利用FT-IR对N-CDs的表面基团进行表征。
1.2.2.4 量子产率的测定 以硫酸奎宁为参比物质,采用斜率比较法[18]计算N-CDs的量子产率。将硫酸奎宁溶于0.1 mol/L H2SO4中,其量子产率(QY)是54%。用紫外分光光度计测量所有溶液在360 nm处的吸光度值A(为了最小化重吸收保证测量准确,吸光度值小于0.1)。用荧光光谱仪测量所有溶液在360 nm激发波长下的荧光光谱,并记录所得荧光光谱在370~700 nm范围内的积分面积值,此值为积分荧光强度通过记录同一物质一系列浓度的积分荧光强度和吸光度值,以吸光度值为横坐标,积分荧光强为纵坐标在Oringin 8.0中作图,为系列点添加截距为0的线性拟合直线,得到直线的斜率。N-CDs的QY按照公式(1)计算:
Qx=Qst(Gradx/Gradst)(ηx/ηst)2
式(1)
其中,Q为量子产率,Grad为所拟合直线的斜率,η为溶剂的折射率。下标st为硫酸奎宁,x为N-CDs。在本体系中,由于硫酸奎宁溶解在稀硫酸中,N-CDs溶解在去离子水中,所以ηx/ηst≈1。
1.2.3 探针的制备与优化 采用单因素实验探讨检测体系pH、Hg2+浓度、孵育时间等因素对荧光猝灭效率、荧光恢复效率和荧光强度的影响,在优化条件下构建生物硫醇检测方法。所有试验重复3次。
1.2.3.1 pH设定 N-CDs浓度为1 mmol/L,醋酸盐缓冲液pH为3.6、4.0、4.6、5.0、5.6,向N-CDs溶液中加入浓度为400 μmol/L的Hg2+以猝灭荧光,室温反应10 min后在选定的荧光测试条件下扫描荧光光谱。同时,在相应体系中加入1 mmol/L 生物硫醇标准液以恢复荧光,室温反应10 min后扫描荧光光谱。根据所得荧光光谱,对数据进行处理。根据荧光猝灭效率(Effq,式2)和荧光恢复效率(Effr,式3)确定最佳pH。
Effq(%)=(F0-F)/F0
式(2)
Effr(%)=(Fr-F)/(F0-F)
式(3)
其中,F和F0表示在加入和不加入Hg2+的情况下N-CDs在432 nm处的荧光强度;Fr为加入生物硫醇到N-CDs/Hg2+传感体系后N-CDs在432 nm处的恢复荧光强度。
1.2.3.2 Hg2+浓度设定 N-CDs浓度为1 mmol/L,pH为优化值,向N-CDs溶液中滴加不同浓度的Hg2+储备液(100、200、300、400、500 μmol/L),反应10 min后评估Hg2+浓度对N-CDs的荧光猝灭作用。同时,在相应体系中加入1 mmol/L生物硫醇标准液以恢复荧光,室温反应10 min后扫描荧光光谱。根据所得荧光光谱,对数据进行处理。确定最佳Hg2+浓度。
1.2.3.3 孵育时间设定 荧光猝灭模式下孵育时间的优化:设定N-CDs浓度为1 mmol/L,pH和Hg2+浓度为优化值,在相应体系中加入Hg2+溶液,将荧光扫描模式切换成Time Drive(时间步长0.01 s,扫描时间30 min),得到加入Hg2+后荧光强度随时间变化的曲线确定最佳猝灭孵育时间。
荧光恢复模式下孵育时间的优化:设定N-CDs浓度为1 mmol/L,pH和Hg2+浓度为优化值,加入Hg2+溶液后室温孵育10 min。在相应体系中加入1 mmol/L生物硫醇标准液,在Time Drive荧光扫描模式下得到加入生物硫醇后荧光强度随时间变化的曲线确定最佳孵育时间。
1.2.4 标准曲线的建立 在优化条件下,将100 μL N-CDs溶液(1 mmol/L)和1 mmol/L的氯化汞溶液依次加入醋酸盐缓冲液(pH为检测生物硫醇的优化值,0.01 mol/L),并在室温下孵育10 min后加入不同浓度的生物硫醇标准液(0、100、150、200、250、300、350、400、450、500、600 μmol/L),室温振荡孵育10 min后,扫描荧光光谱。数据拟合得到荧光恢复因子F/F0(F0和F是分别在不存在和存在生物硫醇的情况下N-CDs/Hg2+传感体系在432 nm处的荧光强度)随浓度C变化曲线及决定系数R2、线性范围及LOD(式4)。
LOD=3δ/k
式(4)
式中:δ为空白信号的标准偏差(n=3);k为标准曲线斜率。
1.2.5 干扰实验 传感器的选择性对于实际蔬菜样品中生物硫醇的检测至关重要,实际蔬菜含有矿物离子、有机酸和氨基酸。因此,采用可能共存的干扰物质(苯丙氨酸、赖氨酸、甘氨酸、色氨酸、抗坏血酸、Ca2+、Mg2+、Zn2+、Fe3+、Mn2+、Na+和K+)来评价该方法的选择性。分别将100 μL N-CDs溶液(1 mmol/L)和1 mmol/L的Ca2+、Mg2+、Zn2+、Fe3+、Mn2+、Na+、K+和Hg2+溶液加入醋酸盐缓冲液(pH为检测生物硫醇的优化值,0.01 mol/L),并在室温下孵育10 min后用荧光强度响应[(F/F0)-1]评估干扰物对N-CDs的荧光猝灭作用。另外,将100 μL N-CDs溶液(1 mmol/L)和1 mmol/L的Hg2+溶液加入醋酸盐缓冲液(pH为检测生物硫醇的优化值,0.01 mol/L),室温下孵育10 min后再分别加入1 mmol/L的苯丙氨酸、赖氨酸、甘氨酸、色氨酸、抗坏血酸、GSH和Cys,室温下孵育10 min后用荧光强度响应[(F/F0)-1]评估干扰物对N-CDs/Hg2+的荧光恢复作用。
1.2.6 加标回收试验 依据文献[6]的方法处理荷兰豆和螺丝辣椒:荷兰豆和螺丝辣椒各取三个样品进行分析,将荷兰豆去皮洗净与螺丝辣椒洗净的果肉切块混合,分别从荷兰豆和螺丝辣椒的切片中取4.5 g置于醋酸盐缓冲液(分别放置于pH=5.0和pH=5.6)中,共4个分析样品,将样品用研钵研碎(研磨时间为15~20 min),并以10000×g离心15 min,然后取出1 mL上清液,用构建的探针检测处理后的分析物溶液。每个样品重复三次。
1.3 数据处理
使用2010版Excel和Nanomeasure软件对数据进行统计分析,使用Origin 8.0软件绘制图。使用Minitab 16.2.3软件分析数据,数据均表示为平均值,通过单因素方差分析评估所有数据的差异,当方差分析中的p值表明统计学意义时,通过Tukey检验评估差异,p<0.05的值被认为是统计学上显著的。本文所有实验均做三次平行(除优化孵育时间外)。
2 结果与分析
2.1 N-CDs的表征结果
从N-CDs的TEM图(图1)可以看出,所制备的N-CDs为准球形。

图1 N-CDs的TEM图
通过使用Nanomeasure软件对大约100个N-CDs纳米颗粒进行统计分析,从图2可知N-CDs的粒径分布范围为0.88~7.94 nm,平均直径为4.53 nm。
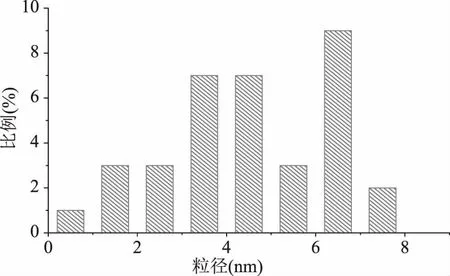
图2 N-CDs的粒径分布图
N-CDs的紫外吸收光谱和荧光光谱如图3所示,331 nm处的紫外吸收峰属于N-CDs表面C=O或C-OH的n-π*跃迁引起的。荧光光谱表明,N-CDs的最佳激发和发射峰分别是340和432 nm。该N-CDs的Stokes’位移为92 nm,这一较大的Stokes’位移可以有效避免激发和发射光谱之间的重叠而有利于后期的分析检测应用。从图3的插图可以看出,所制备的N-CDs在水中分散性良好,在365 nm的紫外灯管照射下发出强烈的蓝光。
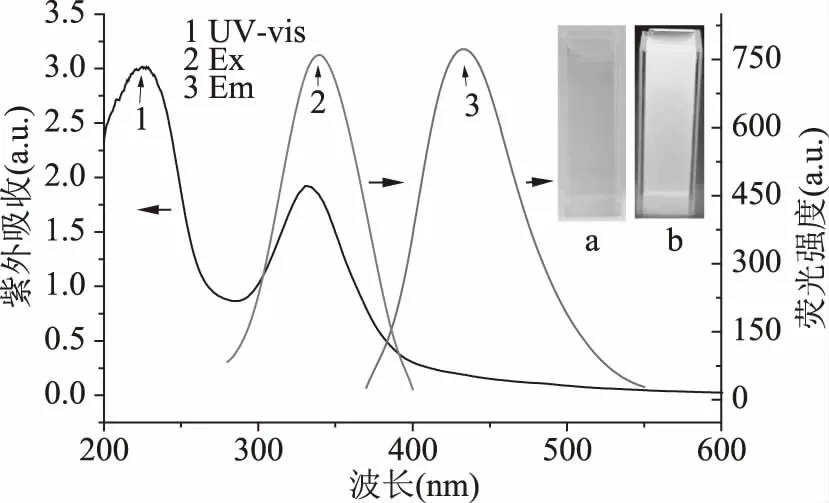
图3 N-CDs的紫外吸收光谱(1)、激发光谱(2)和发射光谱(3)
从N-CDs的红外光谱(图4)可以看出波数在3229、3360和3444 cm-1的峰属于-OH的伸缩振动,宽的羟基吸收带表明N-CDs表面上存在多个羟基结构,赋予CDs更高的极性和亲水性[19]。2985、2980和3040 cm-1的峰属于C-H的伸缩振动,1580、1490和1400 cm-1处的吸收峰表明N-CDs表面存在C=O/N-H、-COOH,1054 cm-1处的吸收峰属于C-O。FTIR结果显示-OH的伸缩振动发生移动,可能是Hg2+和N-CDs的-OH发生了络合作用导致N-CDs的荧光猝灭。
如图5所示,激发波长为340 nm,以硫酸奎宁为参比,N-CDs的QY为32.72%。掺杂后CDs的QY明显高于仅仅以柠檬酸为唯一碳源制备的CDs的QY。以上表征说明合成的N-CDs具有较高的极性、亲水性、量子产率以及较大的Stokes’位移,有利于检测蔬菜中的生物硫醇。
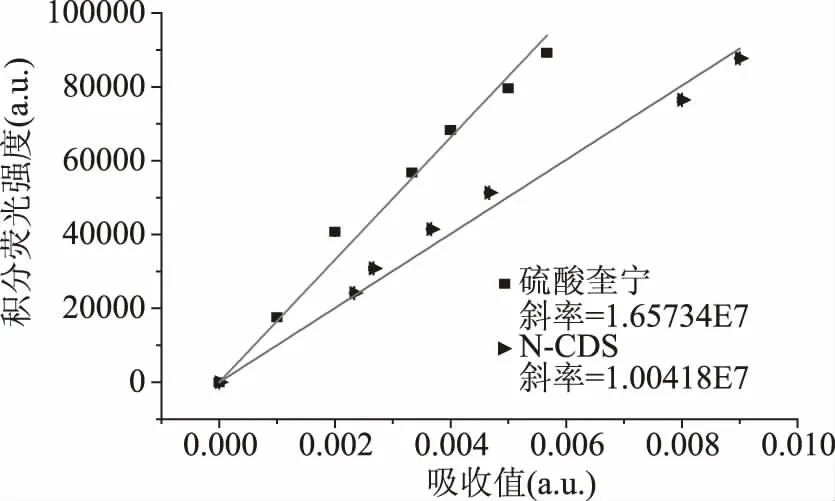
图5 N-CDs的量子产率
2.2 生物硫醇检测条件的优化
2.2.1 体系pH 生物硫醇在中性和碱性条件下稳定性差,其中半胱氨酸易被氧化为胱氨酸,谷胱甘肽易被氧化为氧化型谷胱甘肽,降低pH可使其稳定性增强,由于pH对生物硫醇和Hg2+有影响,因此需要对探针检测生物硫醇的pH进行优化。相应的曲线如图6所示。可以从图6看出在pH从3.6增加到4.0和从4.6增加到5.0时,荧光淬灭效率(Effq,见式2)以较低的速度增强,当pH从4.0增加到4.6时,Effq又快速增加。最后,Effq在pH5.0~5.6内无显著变化(p>0.05)。在pH3.6~4.6的范围内,羧酸酯基团和胺基团被质子化,导致N-CDs带负电。N-CDs表面羧基的质子化作用随着pH的增加而逐渐被去质子化过程所取代,导致带负电荷的羧基可吸引带相反电荷的Hg2+。N-CDs表面的-NH3+在pH从4.6增加到5.0的过程中趋于逐渐去质子化,从而增强了N-CDs之间的静电斥力,并增加了荧光强度。在pH5.0~5.6的范围内,N-CDs的荧光强度无显著变化(p>0.05),可能是由于-NH3+和-COOH去质子平衡。
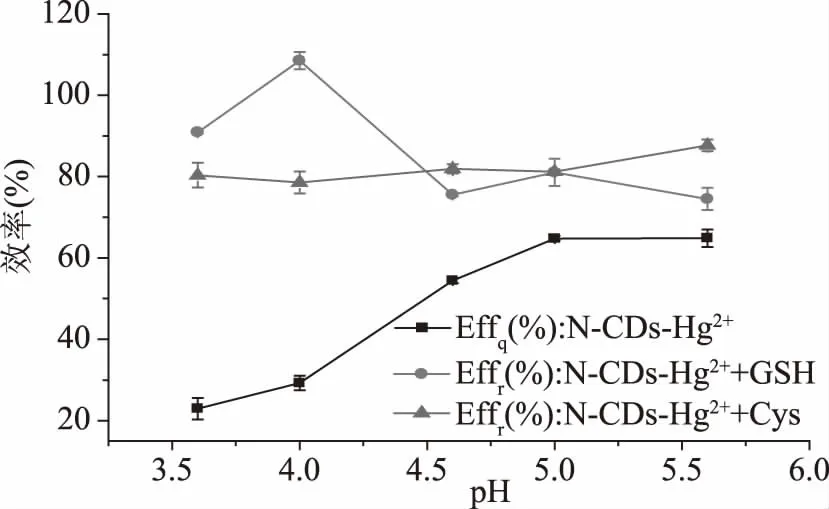
图6 N-CDs-Hg2+,N-CDs-Hg2++Cys/GSH在不同pH下对Effq和Effr的响应
当pH从3.6增加到4.0和从4.0增加到4.6时,GSH的荧光恢复效率(Effr,见式3)分别以较高的速度增强和降低,当pH从4.6增加到5.0和从5.0增加到5.6时,N-CDs-Hg2++GSH的Effr分别以较低的速度增强和降低。在pH为4.0、4.6和5.0时有较大的GSH的Effr,分别为104.1%、85.80%和84.80%。综合考虑N-CDs-Hg2+的Effq和N-CDs-Hg2++GSH的Effr,因此选择pH=5.0用于构建检测GSH的探针。同检测GSH,选择pH=5.6用于构建检测Cys的探针。
2.2.2 Hg2+终浓度 探讨了Hg2+的浓度对荧光猝灭和恢复的影响,相应的曲线如图7A和图7B所示。可以从图7A看出,在pH=5.0的条件下,检测GSH的Effq在测试的Hg2+浓度范围内逐渐升高,升高的速度逐渐降低,这表明Hg2+键合到N-CDs上的量逐渐增加接近饱和。在Hg2+浓度为200 μmol/L时,有最大检测GSH的Effr为88.20%。在N-CDs/Hg2+传感系统中,Hg2+浓度对于提高分析性能至关重要,当Hg2+浓度较低时,Effr对GSH测定的背景荧光值比较高,同时线性范围窄;高浓度的Hg2+又使得低浓度GSH恢复荧光的能力有限,直接影响到测定的灵敏性。综合考虑探针检测的灵敏度和线性范围及实验安全性,因此选择200 μmol/L Hg2+用于构建检测GSH的探针。
另外,从图7B可以看出,在pH=5.6的条件下,检测Cys的Effq在测试的Hg2+浓度范围内逐渐升高,升高的速度逐渐降低,这同样说明Hg2+键合到N-CDs上的量逐渐增加接近饱和。当Hg2+的浓度低于200 μmol/L时,检测Cys的Effr随着Hg2+浓度的增加逐渐变小,当Hg2+的浓度在200~400 μmol/L时,检测Cys的Effr随着Hg2+浓度的增加逐渐增加,在Hg2+的浓度为300~400 μmol/L时,检测Cys的Effr增加速度最低,当Hg2+浓度为400 μmol/L时有最大Effr为87.66%。当Hg2+的浓度继续增加时,检测Cys的Effr在400~500 μmol/L范围内逐渐降低。同检测GSH,综合考虑探针检测的灵敏度和线性范围及实验安全性,因此选择300 μmol/L Hg2+用于构建检测Cys的探针。
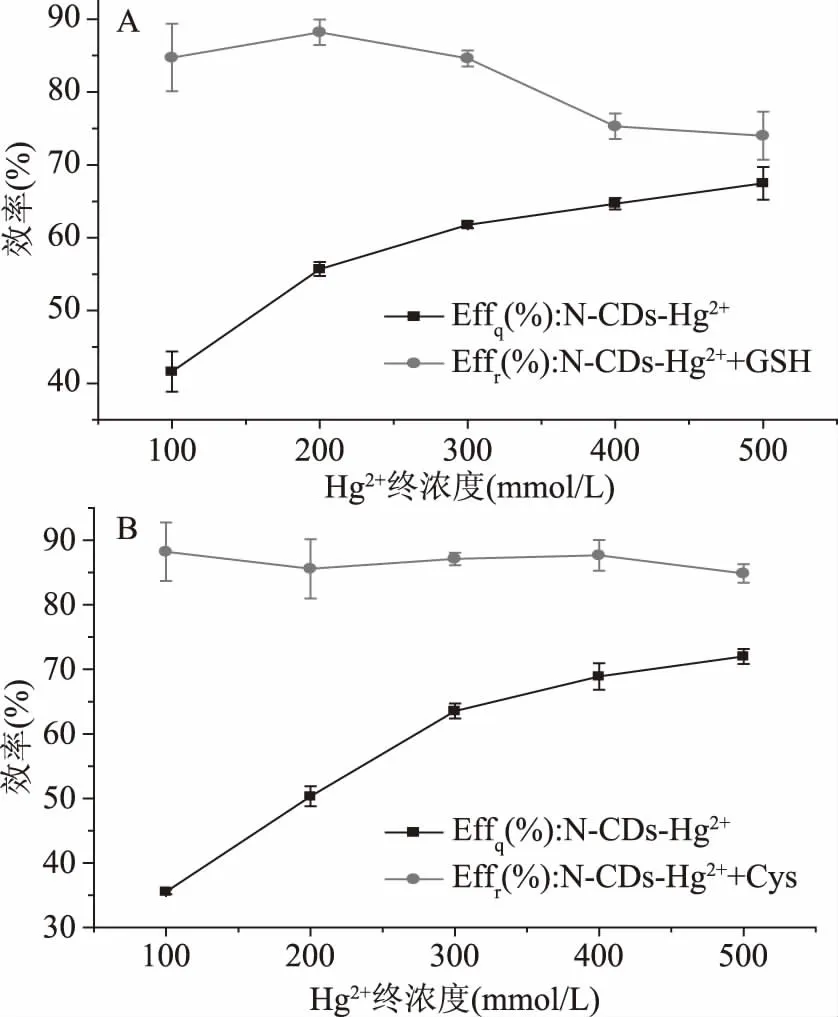
图7 (A)Hg2+终浓度对检测GSH的Effq和Effr的响应;(B)Hg2+终浓度对检测Cys的Effq和Effr的响应
2.2.3 孵育时间 研究孵育时间(猝灭和恢复时间)以评估荧光传感器对生物硫醇的响应时间,图8A为在pH=5.0条件下N-CDs的荧光强度随孵育时间(荧光猝灭/GSH恢复)变化的曲线。图8B为在pH=5.6条件下N-CDs的荧光强度随孵育时间(荧光猝灭/cys恢复)变化的曲线。从图8A可以看出,N-CDs荧光强度在加入200 μmol/L Hg2+后在0~460 s时呈下降趋势,随着时间的增加,N-CDs荧光强度在460 s后达到平衡(p>0.05),这意味着N-CDs表面的官能团(例如-NH2、-OH和-COOH)可以快速与Hg2+相互作用而引起荧光猝灭并在460 s后达到饱和。向N-CDs/Hg2+体系中加入1 mmol/L GSH后,当反应时间超过380 s后,荧光强度基本保持不变(p>0.05),表明380 s足以使GSH恢复N-CDs的荧光。因此,当检测GSH时,猝灭孵育时间为460 s,恢复的孵育时间为380 s。同检测GSH,当检测Cys时,猝灭孵育时间为440 s,恢复的孵育时间为400 s。因为仪器的噪音的影响,图中存在几个N-CDs荧光强度随着时间的增加而增加的时间段。
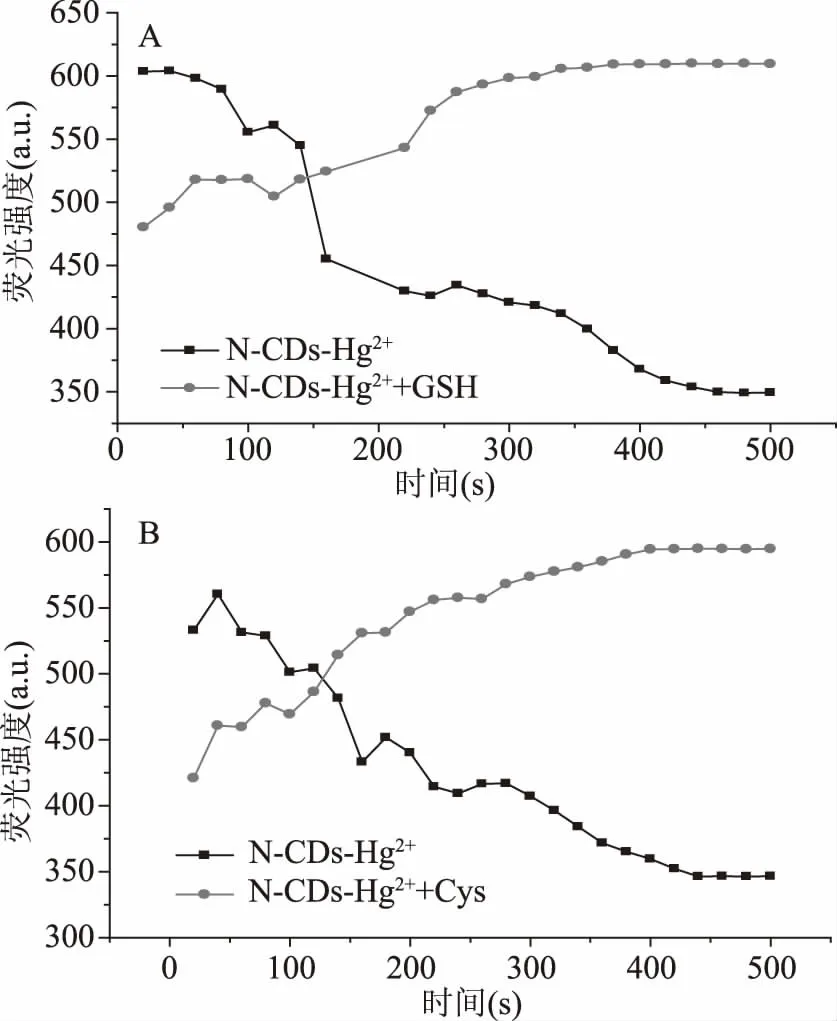
图8 (A)N-CDs的荧光强度随孵育时间(荧光猝灭/GSH恢复)的变化;(B)N-CDs的荧光强度随孵育时间(荧光猝灭/Cys恢复)的变化
2.3 标准曲线
在最优条件下,利用设计的可切换荧光“开-关-开”传感器对生物硫醇进行检测,N-CDs/Hg2+的荧光强度随着生物硫醇浓度的增加逐渐恢复。荧光恢复因子F/F0(F0和F是分别在不存在和存在生物硫醇的情况下N-CDs/Hg2+传感体系在432 nm处的荧光强度)同GSH浓度的曲线如图9所示。GSH浓度在0~300 μmol/L范围内,F/F0与GSH浓度之间具有良好的线性关系,决定系数(R2)为0.9948。线性方程表示为F/F0=0.00324[C]+0.9686,其中[C]是GSH的浓度,LOD为2.56 μmol/L。荧光恢复因子F/F0同Cys浓度的曲线如图10所示。Cys浓度在100~400 μmol/L范围内,F/F0与Cys浓度之间也具有良好的线性关系,决定系数(R2)为0.99207。线性方程表示为F/F0=0.00408C+0.61037,其中C是Cys的浓度,检测限(LOD)为3.46 μmol/L。
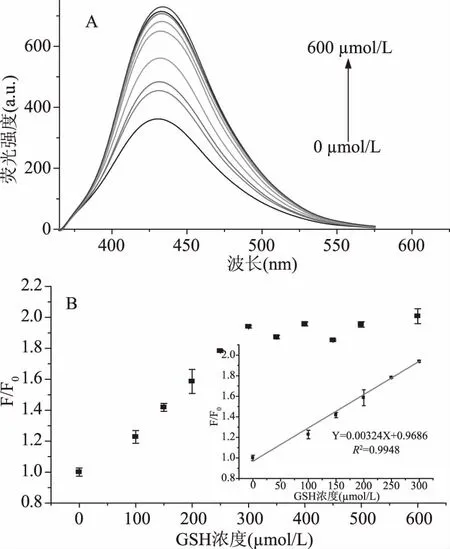
图9 不同GSH浓度下N-CDs/Hg2+传感探针的荧光发射光谱图
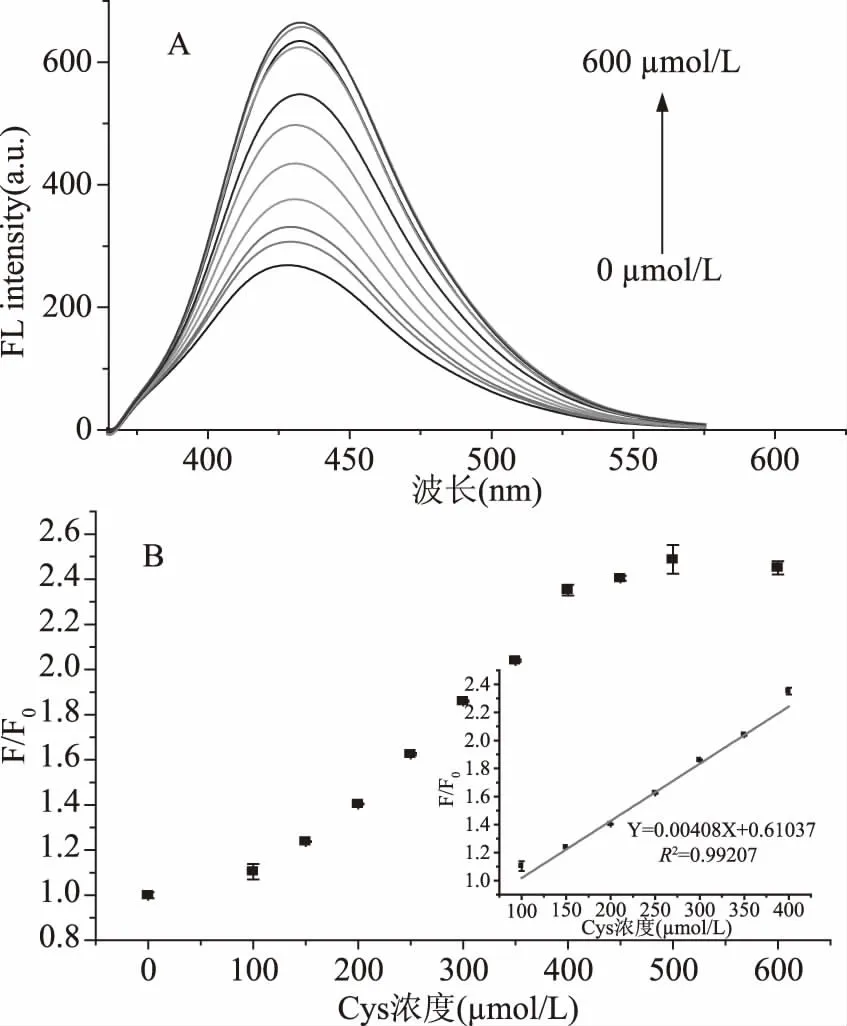
图10 不同GSH浓度下N-CDs/Hg2+传感探针的荧光发射光谱图
2.4 干扰试验
本文所开发的荧光传感器的选择性对于实际蔬菜样品中生物硫醇含量的测定具有重要影响。由于实际蔬菜样品中含有矿物离子,有机酸和氨基酸等,因此,采用可能共存的干扰(苯丙氨酸、赖氨酸、甘氨酸、色氨酸、抗坏血酸、Ca2+、Mg2+、Zn2+、Fe3+、Mn2+、Na+和K+)来评价该方法的选择性,并且荧光强度响应[(F/F0)-1]与干扰物种类关系的柱形图如图11所示。从图11(A)可以看出,Ca2+、Mg2+、Zn2+、Mn2+、Na+和K+对N-CDs荧光强度的影响可忽略不计(荧光相应<5%),而Fe3+对N-CDs的荧光强度的影响较弱,只有Hg2+能够较大程度地猝灭N-CDs的荧光强度,表明N-CDs对Hg2+具有高选择性。从图11(B)可以看出,苯丙氨酸、赖氨酸、甘氨酸、色氨酸和抗坏血酸对N-CDs/Hg2+荧光检测生物硫醇的影响可忽略不计(荧光相应<5%),结果表明,构建的传感器在存在干扰物时可用于蔬菜中生物硫醇的检测。

图11 N-CDs对Hg2+和干扰离子以及N-CDs/Hg2+对GSH和Cys以及干扰物的荧光强度响应
2.5 加标回收
将此传感器用于荷兰豆和螺丝辣椒中GSH和Cys的检测。GSH和Cys分别做三种不同浓度的加标回收试验,所有试验做三次平行,结果如表1所示,样品加标回收率都在80%~120%之间,证明此方法的准确度较好。
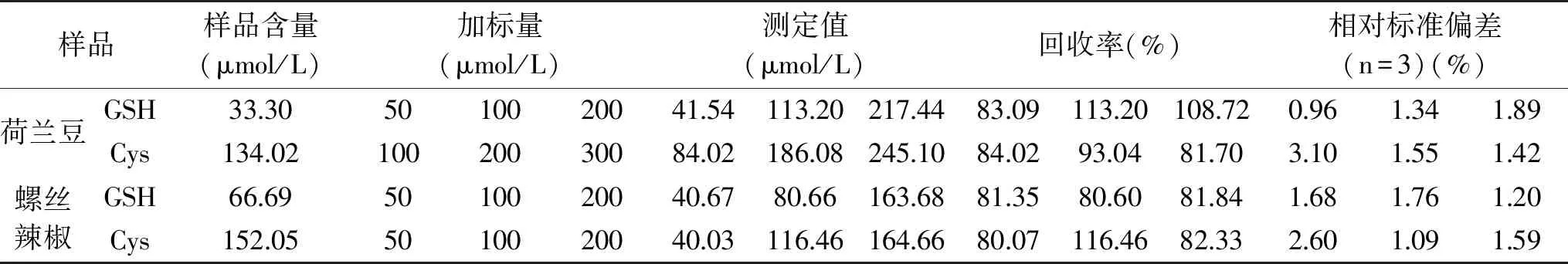
表1 加标回收试验结果
3 结论
本研究构建的N-CDs/Hg2+探针具有较好的稳定性,基于这种探针设计了特异性检测生物硫醇的方法。以检测体系pH、Hg2+浓度、孵育时间(荧光猝灭和恢复时间)为单因素,优化得到GSH的最佳检测条件为pH=5.0,Hg2+浓度为200 μmol/L,460 s荧光猝灭和380 s荧光恢复,最佳检测Cys条件为pH为5.6,Hg2+浓度为300 μmol/L,440 s荧光猝灭和400 s荧光恢复,在最优条件下该传感器对0~300 μmol/L的GSH和100~400 μmol/L的Cys具有线性响应,检测限分别为2.56、3.46 μmol/L。该方法的空白加标回收率为80%~120%之间。干扰实验表明蔬菜中可能存在的干扰物对传感器没有显著影响,因此该传感器用于检测蔬菜中的生物硫醇具有可接受的选择性。另外,该传感器具有快速的荧光猝灭和恢复响应、较高的灵敏度和准确度,为食品基质中生物硫醇的荧光快速检测提供一种新思路。

