金花葵花黄酮提取物不同溶剂萃取物的抗氧化活性
李现日,张 杰,张英美,金太文,康明秀,袁其朋
(1.北京化工大学生命科学与技术学院,北京 100029;2.金亨稷师范大学,平壤 999093;3.金日成综合大学,平壤 999095)
金花葵(Aureahelianthus)又名金芙蓉、菜芙蓉、野芙蓉,为锦葵科,秋葵属,一年生草本植物,在200多种秋葵植物中最具有食用、药用、保健等功能,有较高的商业价值[1]。研究发现,金花葵的花、茎、叶、种子中都含有丰富的生物活性物质,具有良好的抗氧化、降血脂、降血糖、抗肿瘤、镇痛、解热、抗炎、免疫调节、抗衰老、保肝等功能[2]。目前,针对金花葵中活性物质的主要研究为金花葵中多糖提取及其抗氧化活性研究[2-5]、金花葵中黄酮多种提取方法研究(有机溶剂回流提取、索式提取及辅助提取)[6-10],但关于不同溶剂对金花葵花中黄酮的萃取及萃取物的活性研究尚未报道。为了深入研究不同极性溶剂对金花葵花中黄酮萃取及活性的影响,本文对金花葵花黄酮乙醇提取物进行溶剂分级萃取,采用DPPH自由基法、羟基自由基法、还原能力法、超氧阴离子能力法和油脂抗氧化作用法,对不同萃取物进行体外抗氧化实验,分析抗氧化活性与各萃取物中黄酮含量的关系。以期为进一步开发和发展金花葵花中的黄酮提供理论基础和实验依据。
1 材料与方法
1.1 材料与仪器
金花葵花 购自北京顺义;1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;芦丁标准品(纯度≥98.0%) 成都普菲德生物技术有限公司;乙醇、石油醚、乙酸乙酯、正丁醇 均为分析纯,北京化学试剂厂;硝酸铝、氢氧化钠、亚硝酸钠、抗坏血酸、磷酸二氢钠、磷酸氢二钠、邻苯三酚、水杨酸、过氧化氢、硫代巴比妥酸、三羟基氨基甲烷、铁氰化钾、三氯乙酸等 均为国产分析纯,国药集团化学试剂有限公司。
UV2450型紫外分光光度计 日本岛津公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;CA-1115A型冷却水循环装置 上海爱朗仪器有限公司;BT-255电子分析天平 德国Sartorius公司;DZF-6020型真空干燥箱 上海益恒实验仪器有限公司;TDL-40B台式离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 金花葵花不同萃取物的制备 采用宋琳琳等[7]的方法,略有改动。金花葵花自然干燥5 d,粉碎,过80目筛,4 ℃备用。称取金花葵花粉末10.00 g,每次用75%乙醇200 mL 70 ℃水浴回流提取2 h,共三次,合并提取液,经减压浓缩得浸膏。
采用云成悦等[11]的方法,萃取流程如图1。先将乙醇提取浸膏用0.5 L去离子水溶解,后加入0.25 L的石油醚进行振荡,静置20 min,待完全分层后收集上层的石油醚相,下层水相按上述方法再萃取四次;剩余水相按上述步骤依次用乙酸乙酯、正丁醇进行萃取,依次得到石油醚萃取液、乙酸乙酯萃取液、正丁醇萃取液及最后的水相溶液,将相同萃取剂的萃取液合并进行减压浓缩,得萃取物浸膏,然后置于干燥器中。将金花葵花各萃取物用去离子水配制不同浓度梯度(0.20、0.40、0.60、0.80、1.00 mg/mL)的萃取物溶液,用于后续抗氧化活性测定实验。
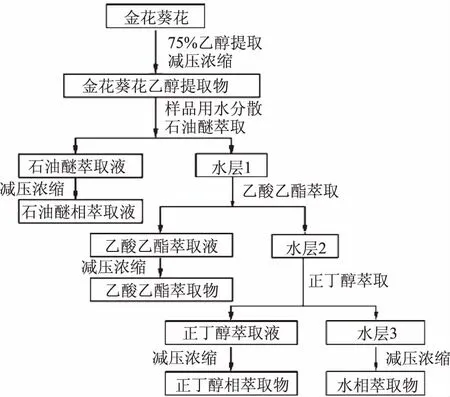
图1 金花葵花不同萃取物的制备流程
1.2.2 总黄酮含量测定 采用Viacava等[12]的NaNO2-Al(NO3)3-NaOH 比色法,略有改动。称取芦丁标准品8.00 mg,置于50 mL 量瓶中,用70%乙醇溶解并稀释至刻度摇匀,得芦丁标准品初始液。精密吸取 0.5、1.0、2.0、3.0、4.0、5.0 mL标准品初始液,分别置于10 mL 容量瓶中,加70%乙醇稀释至5.0 mL,加入0.4 mL 5% NaNO2摇匀,静置6 min,加入0.4 mL 10% Al(NO3)3摇匀,静置6 min,加入0.4 mL 4% NaOH,最后加去离子水定容10 mL,摇匀后静置15 min,在 λ=510 nm处测定吸光度A。以吸光度(Y)为纵坐标、芦丁标准品溶液的浓度(X)为横坐标,绘制标准曲线,得回归方程Y=2.4254X-0.0273(R2=0.9996),把测定样品吸光值代入方程,得到总黄酮含量。
1.2.3 体外抗氧化活性实验
1.2.3.1 DPPH自由基清除能力的测定 采用Priyanka等[13]的方法,略有改动。用去离子水配制不同浓度梯度0.20、0.40、0.60、0.80、1.00 mg/mL的各萃取物溶液,并用抗坏血酸(VC)溶液作为对照。取样品溶液0.5 mL,加入2 mL 0.1 mg/mL DPPH无水乙醇溶液,混匀室温避光反应30 min,在517 nm处测定样品吸光度Ai,空白组Aj以等量去离子水代替DPPH溶液,对照组VC以等量去离子水代替样品溶液,平行测定3次,取平均值。清除率计算公式如式(1)。
清除率(%)=[1-(Ai-Aj)/Ac]×100
式(1)
式中:Ac对照组吸光值;Ai样品溶液的吸光值;Aj空白组吸光值。
1.2.3.2 羟基自由基清除能力的测定 采用Chen[14]的方法,略有改动。原理基于H2O2和Fe2+混合发生Fenton反应产生·OH。在10 mL的试管中依次加入2 mL 5 mmol/L的FeSO4溶液,2 mL不同浓度梯度0.20、0.40、0.60、0.80、1.00 mg/mL的萃取物溶液,VC溶液作为对照,加入1 mL 8 mmol/L H2O2溶液混匀启动反应,室温静置10 min,最后加入2 mL 5 mmol/L的水杨酸溶液作为捕获剂,混匀并静置30 min后,取适量上清液,510 nm测吸光度Ai,空白组Aj以等量去离子水代替水杨酸溶液,对照组Ac以等量去离子水代替样品溶液。平行测定3次,取平均值。清除率计算公式如式(2)。
清除率(%)=[1-(Ai-Aj)/Ac]×100
式(2)
式中:Ac对照组吸光值;Ai样品溶液的吸光值;Aj空白组吸光值。
1.2.3.3 还原能力的测定 采用Yildirim等[15]的铁氰化钾还原法,略有改动。不同浓度梯度0.20、0.40、0.60、0.80、1.00 mg/mL的各萃取物溶液和VC溶液作为对照,分别取不同浓度梯度的溶液2 mL,加入2 mL pH=6.6 0.2 mol/L磷酸盐缓冲液和2 mL 1%铁氰化钾溶液,50 ℃水浴20 min。水浴结束后加入2 mL 10%的三氯乙酸,混匀后3000 r/min离心10 min。取上清液2 mL加入试管中,再依次加入2 mL去离子水以及0.5 mL 0.1%三氯化铁在试管中,混匀反应10 min,在700 nm处测定吸光度。
1.2.3.4 清除超氧阴离子能力的测定 采用Liang等[16]的方法,略有改动。取5 mL 0.1 mol/L pH=8.2 Tris-HCl的缓冲液与0.5 mL不同浓度梯度0.20、0.40、0.60、0.80、1.00 mg/mL各萃取物溶液及VC溶液,用去离子水补充至9.5 mL,置于10 mL比色管中混匀,25 ℃水浴20 min,取出后立即加入0.5 mL在25 ℃预热过的3 mmol/L邻苯三酚,迅速摇匀后倒入比色皿中,用4 mL 10 mmol/L HCl为空白液,在320 nm波长处,每隔30 s测吸光度一次,共计4 min,以吸光值A对反应时间t作线性关系图,斜率即为Vt,计算出抗氧化剂对超氧阴离子的清除率。清除率计算公式如式(3)。
清除率(%)=[1-V1/V0]×100
式(3)
式中:V1样品吸光值斜率;V0邻苯三酚吸光值斜率。
1.2.3.5 油脂抗氧化作用的测定 采用刘丹丹等[17]方法,略有改动。硫代巴比妥酸(TBA)法是目前测定脂质过氧化常用的方法。脂质中的不饱和脂肪酸被氧化为过氧化脂质,后期生成大量的丙二醛(MDA),其可与TBA 缩合,在pH=3.0时显粉红色,在532 nm 处有特征吸收,可根据吸光度值A判断脂质过氧化的程度。分别将2 mL 1.00 mg/mL的萃取物、VC和去离子水置于具塞锥形瓶中,依次加2 mL 2.5% 亚油酸溶液,4 mL pH=7.4 0.05 mol/L PBS缓冲溶液,2 mL去离子水,0.5 mL 5 mmol/L H2O2,以无水乙醇作为对照。混匀后置于37 ℃培养箱中避光培养。每隔24 h取1 mL样品,加入1 mL 10%三氯乙酸,静置20 min,加入1 mL 0.3%硫代巴比妥酸溶液,混匀后沸水浴加热20 min,室温下冷却后加入2 mL正丁醇,充分摇匀,3000 r/min离心15 min,取上清液于532 nm测定吸光度。
1.3 数据统计分析
所有实验数据均为3次重复实验结果的平均值。采用Origin 8.0和SPSS Statistics 22软件进行数据统计分析。
2 结果与分析
2.1 不同极性溶剂萃取物的质量及黄酮含量
不同极性溶剂萃取物的质量测定结果如图2所示。由图2可知,提取物中极性大的成分较多,故萃取物质量:乙醇提取物>水相>乙酸乙酯相>正丁醇相>石油醚相。不同极性溶剂萃取物中黄酮含量如图3所示。由图3可知,金花葵花乙醇提取物经不同极性溶剂分级萃取后,各萃取相中黄酮含量差异明显,黄酮含量顺序为:乙酸乙酯相>正丁醇相>乙醇提取物>石油醚相>水相。黄酮含量范围为11.5%~48.3%,乙酸乙酯相和正丁醇相中黄酮含量显著高于其它组(p<0.05)。其中乙醇提取物中黄酮含量为30.4%,乙酸乙酯相中黄酮含量为48.3%,黄酮含量提高倍数约为1.6倍,接近金花葵花黄酮经聚酰胺树脂纯化1.9倍[9]。液-液萃取法是近年来备受关注的纯化技术,不仅在一定程度上提高了纯度,还具有高效节能等优点[18-19]。
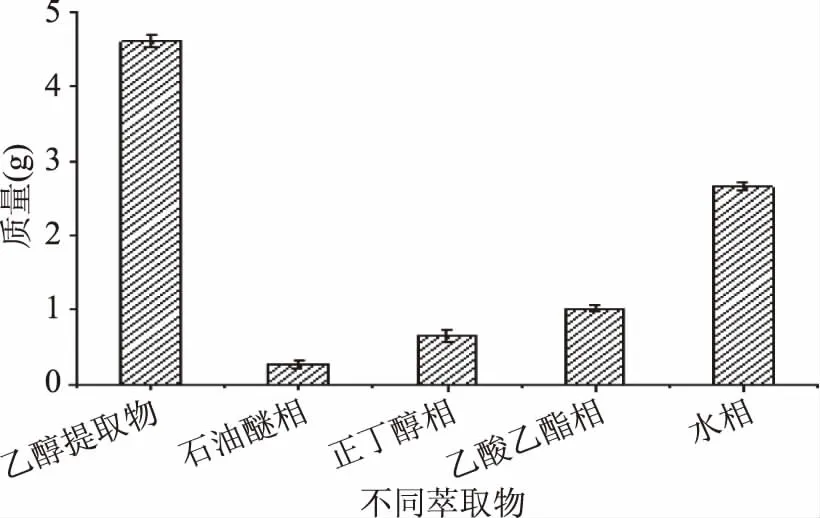
图2 不同萃取物质量的比较
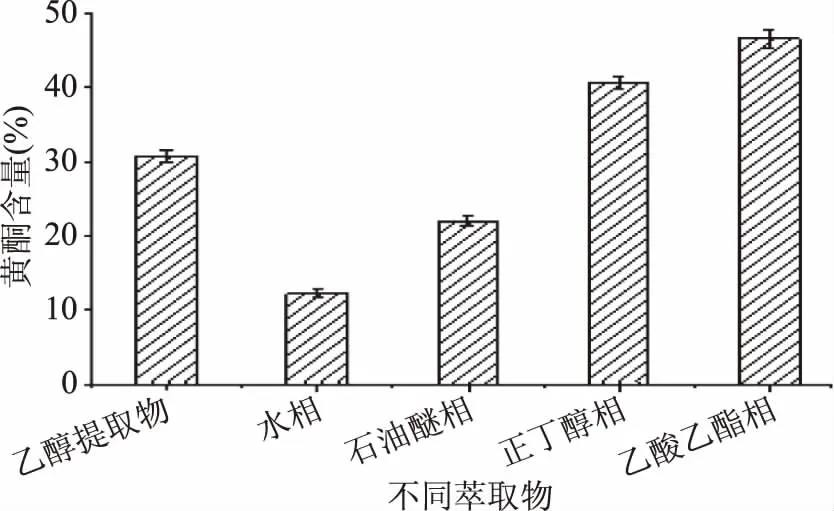
图3 不同萃取物黄酮含量的比较
2.2 不同极性溶剂萃取物体外抗氧化活性测定结果
2.2.1 DPPH自由基清除能力 由图4可知,金花葵花不同极性溶剂萃取物对DPPH自由基的清除作用存在剂量依赖效应,在0.20~1.00 mg/mL的浓度范围内,随着各萃取物浓度的增加,清除率也相应地增加。同一浓度下,各萃取物对DPPH自由基的清除顺序为:乙酸乙酯相>正丁醇相>乙醇提取物>石油醚相>水相,与其黄酮含量趋势一致。比较VC与各萃取物,发现VC、乙酸乙酯相、正丁醇相对DPPH清除能力显著高于其它萃取物(p<0.05)。各萃取物浓度为1.00 mg/mL时,其清除率分别为乙酸乙酯相97.5%、正丁醇相96.8%、乙醇提取物87.3%、石油醚相82.2%、水相81.3%。金花葵花各萃取物清除DPPH自由基的机理是其具有供氢体,可以提供质子还原具有氧化性的自由基,终止自由基的连锁反应,从而起到抑制或清除自由基的作用[20]。

图4 金花葵花不同极性溶剂萃取物清除DPPH自由基能力
2.2.2 羟基自由基清除能力 由图5可知,金花葵花不同极性溶剂萃取物对羟基自由基的清除作用存在剂量依赖效应,在0.20~1.00 mg/mL的浓度范围内,随着各萃取物浓度的增加,羟基自由基清除率随之升高。同一浓度下,各萃取物对羟基自由基的清除顺序为:乙酸乙酯相>正丁醇相>乙醇提取物>石油醚相>水相,与其黄酮含量趋势一致。比较VC与各萃取物,发现VC、乙酸乙酯相、正丁醇相对羟基自由基清除能力显著高于其它萃取物(p<0.05),尤其是乙酸乙酯相清除能力仅次于VC。各萃取物质量浓度1.00 mg/mL时,其清除率分别为乙酸乙酯相92.5%、正丁醇相90.8%、乙醇提取物81.3%、石油醚相70.5%、水相68.3%。
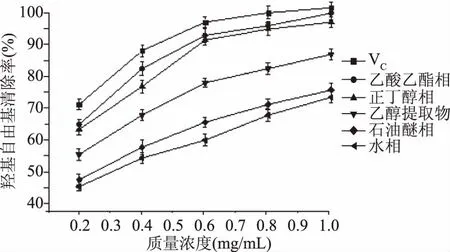
图5 金花葵花不同极性溶剂萃取物清除羟基自由基能力
2.2.3 金花葵花各萃取物的还原能力 由图6可知,金花葵花不同极性溶剂萃取物的还原能力存在剂量依赖效应,在0.20~1.00 mg/mL的浓度范围内,随着各萃取物质量浓度的增加,还原能力也相应地增加。各萃取物还原能力顺序为:乙酸乙酯相>正丁醇相>乙醇提取物>石油醚相>水相,与其黄酮含量趋势一致。乙酸乙酯相和正丁醇相还原能力显著高于其它相(p<0.05)。在质量浓度为1.0 mg/mL时,金花葵花各萃取物的还原产物的吸光度分别为乙酸乙酯相2.48 Abs、正丁醇相2.26 Abs、乙醇提取物1.73 Abs、石油醚相1.32 Abs、水相1.28 Abs。

图6 金花葵花不同极性溶剂萃取物的还原能力
2.2.4 超氧阴离子清除能力 由图7可知,金花葵花不同极性溶剂萃取物对超氧阴离子的清除作用存在剂量依赖效应,在0.20~1.00 mg/mL的浓度范围内,随着各萃取物浓度的增加,超氧阴离子清除率随之升高,与其黄酮含量趋势一致。金花葵花各萃取物清除超氧阴离子能力不同,在质量浓度为1.0 mg/mL时,乙酸乙酯和正丁醇相清除超氧阴离子的能力分别为97.2%、96.8%,显著高于石油醚相和水相的68.5%、63.1%(p<0.05)。
2.2.5 抗油脂氧化能力 丙二醛为油脂过氧化的次级产物,油脂在氧化初期,丙二醛的产量随着氧化程度加深而增加。丙二醛显色测定法与丙二醛产量密切相关,因此在油脂氧化初期,次级代谢产物较少会影响丙二醛显色法的显色,氧化后期时丙二醛累积较为充足,显色变化较为明显,测定较为准确[21]。金花葵花各萃取物添加量均为0.1%亚油酸时,各萃取物的抗油脂氧化能力如图8所示。亚油酸的丙二醛吸光值与时间呈正相关,即时间越长,丙二醛吸光值越大。各萃取物抗油脂氧化能力均显著高于对照亚油酸(p<0.05),即丙二醛吸光值越小,抗氧化能力越强。各萃取物抗油脂氧化能力顺序为:乙酸乙酯相>正丁醇相>乙醇提取物>石油醚相>水相,尤其是乙酸乙酯相、正丁醇相有较强的抗油脂氧化作用,并且和VC抗油脂氧化能力相近。综合以上结果,说明金花葵花各萃取物均具有抗油脂氧化能力,能有效延缓食用油脂的脂质过氧化,其中乙酸乙酯相和正丁醇相效果显著,这可能是跟萃取物中黄酮含量有关[22]。综合以上结果,金花葵花各萃取物中黄酮含量越多,其抗油脂氧化能力越强[23]。
2.3 抗氧化活性指标间的相关性分析
利用SPSS软件对金花葵花各萃取物的质量浓度为1.00 mg/mL时,进行了五种抗氧化活性指标的相关性分析,结果见表1。从表1可知,还原能力与DPPH自由基、羟基自由基、超氧阴离子的清除能力、抗油脂氧化能力呈极显著相关性,相关系数在0.969~0.995之间(p<0.01)。综合看来,金花葵花各萃取物对五种体系的抗氧化活性测定结果基本一致,存在的些微不同一方面可能是因为提取得到的黄酮是混合物,抗氧化活性成分较为复杂;另一方面可能是因为不同抗氧化指标的检测机理不同[24]。

表1 五种抗氧化活性指标相关性分析
2.4 总黄酮含量与抗氧化活性指标的相关性分析
金花葵花各萃取物的质量浓度为1.00 mg/mL时,其黄酮含量与抗氧化能力的相关性见表2。从表2可知,总黄酮含量与还原力、清除DPPH自由基、羟基自由基、超氧阴离子的能力和油脂抗氧化作用显著相关性(p<0.05),相关系数在0.937~0.980之间,说明金花葵花黄酮具有较高的体外抗氧化能力。黄酮结构中的邻位酚羟基很容易被氧化成醌类结构,使得黄酮具有较强捕捉自由基的能力和抗氧化活性,并且抗氧化活性强弱与其黄酮含量、种类、结构有关[25]。

表2 萃取物黄酮含量与抗氧化活性的相关性分析
3 结论
本文对金花葵花黄酮乙醇提取物进行分级萃取,而后对各萃取物的清除DPPH自由基能力、清除羟基自由基能力、还原能力、清除超氧阴离子能力和油脂抗氧化能力进行测定,研究金花葵花黄酮不同极性溶剂萃取物的体外抗氧化能力。研究表明,金花葵花黄酮得到较好地分离(11.5%~48.3%),其中乙酸乙酯相和正丁醇相萃取物中黄酮含量显著高于其它相(p<0.05),且具有较好的抗氧化能力。在0.20~1.00 mg/mL的萃取物质量浓度范围内,随着质量浓度的增加,抗氧化能力相应增大。萃取物质量浓度为1.0 mg/mL时,乙酸乙酯相和正丁醇相的抗氧化能力接近VC。抗氧化活性检测方法之间相关系数为0.969~0.995(p<0.01),萃取物中黄酮含量与抗氧化活性之间相关系数为0.937~0.980(p<0.05),说明金花葵花黄酮具有较高的体外抗氧化能力。综上所述,乙酸乙酯和正丁醇的萃取物抗氧化能力较好,可作为分离抗氧化活性物质的重点,为天然抗氧化剂的开发提供了理论基础,同时为金花葵花的综合开发和利用奠定了实践基础。

