加拿大天然健康产品管理的模式及启示
田 明,赵静波,张孜仪,3
(1.北京大学政府管理学院,北京 100871; 2.国家食品药品监管总局高级研修学院,北京 100073; 3.中南财经政法大学公共管理学院,湖北武汉 430073)
加拿大作为世界上最早对功能性食品有明确法律规定的国家之一,在功能性食品的管理方面有着丰富的经验。随着经济的发展和社会的进步,人们的物质和文化水平不断提高,进而对健康问题越来越重视,功能性食品行业在这样的环境下蓬勃发展。各国对功能性食品的定义各不相同,例如我国将此类产品归为特殊食品并定义为保健食品,美国将此类食品定义为膳食补充剂,韩国和日本分别叫做健康功能食品和保健功能食品,加拿大则称之为天然健康产品,核心管理法规为《天然健康产品条例》,管理部门是加拿大卫生部的下属机构天然和非处方健康产品局(NNHPD)。加拿大天然健康产品原料管理采用名单制,与我国食品安全法要求的保健食品应当建立名称、用量及对应功效的原料目录吻合。
本文将对加拿大天然健康产品及其原料的管理进行梳理和分析,以便我国的保健食品管理工作者和法规制定部门借鉴。
1 加拿大天然健康产品的范畴及相关法律
1.1 加拿大天然健康产品的范畴
加拿大与我国保健食品定义范畴类似的产品主要归属到天然健康产品类别,还包含极少部分允许健康声称的普通食品。天然健康产品涵盖的范围比较宽,维生素矿物质补充剂、顺势疗法药物、传统药物、氨基酸、益生菌和特定的个人护理产品均隶属此类别。不包括处方药、皮下注射用药和根据《烟草法》管理的物质或者根据其它立法,如《控制药品和物质法》管理的物质[1]。
《天然健康产品条例》规定天然健康产品定义,包括用途和原料两个方面。天然健康产品的用途,包括:诊断、治疗、减轻和预防疾病、精神失常等异常状况或疾病症状,恢复或纠正器官功能,或调节器官功能等功效。天然健康产品的原料允许使用的类别见表1。

表1 天然健康产品可含有的物质Table 1 Substances that natural health products can contain
1.2 加拿大天然健康产品的相关法律
针对天然健康产品,加拿大以《食品和药品法案》[2]为框架,以《天然健康产品条例》[3]为核心发布了一系列配套管理的法规和办法,包括《天然健康产品途径》[4]、《天然健康产品许可申请的管理》[5]、《进行现代健康声称的天然健康产品许可办法》[6]和《作为传统药物使用的天然健康产品许可办法》[7]。
2 加拿大天然健康产品的原料管理
加拿大卫生部根据《天然健康产品条例》附录一(见表1)设立的天然健康产品可含物质的名单对原料实施管理。基于已掌握的天然健康产品信息,相关国际标准和药典等明确的信息的积累,加拿大卫生部进一步建立了原料及其功能相结合目录,即天然健康产品专论(monographs)。专论中还规定了原料名称、来源、用量范围、适宜人群、质量要求等标准化信息。天然健康产品专论均收录到加拿大卫生部的天然健康产品成分数据库中,以便于公众进行查询[8]。
天然健康产品专论包括单一成分专论(Single Ingredient Monographs)和产品专论(Product Monographs)。前者为只含有单一确定功效成分的标准化信息;后者适用于含一种以上的功效成分或某一类功效成分(如多种维生素、益生菌等)组成的产品的标准化信息。由于已收录到数据库中的天然健康产品专论,其功效成分的安全性和功效的科学性已获验证,因此申请者可引用专论来支持其产品的申请。加拿大卫生部现已发布了超过270个专论,随着已掌握天然健康产品信息的不断积累,加拿大卫生部将继续修改及增补专论,公众可以向NNHPD提出增加专论的建议[9],但NNHPD暂未提供具体提交建议的指引或方法。
天然健康产品申请者若使用成分目录以外的成分,需在产品申请前向NNHPD提交成分列入成分目录的请求[10],只有成分被认定可接受,并加入到成分目录后,申请人方可继续提交产品的申请。因此随着申请的积累,数据库中可用成分目录也会相应进行增补。
依据《进行现代健康声称的天然健康产品许可办法》,在保证安全性的前提下,允许申请者对天然健康产品原料进行复配,其中包括以下的情况。
允许列入到条例中(见表1)的物质进行复配,但需符合以下要求:a. 原料的复配不会导致产品风险的增加;b. 不会导致产品功能的下降;c. 不会产生相互矛盾的使用效果。
允许列入到单一成分专论的原料进行复配,但需符合以下基本要求(包括但不仅限于):a. 由于部分声称的功能需在一定的推荐使用条件下才能体现,因此要求引用自专论的使用条件的具体要求是相同或可相容的(包括:服用方式、剂型、剂量、适宜人群、持续使用期限、风险信息等);b. 在确保复配产品中所有功效成分安全性的基础上,要求至少对其中一种功效成分进行健康功能声称;c. 产品风险信息中的限制性要求不能与健康功能声称相冲突。当出现以下情况时,包括:发布复配产品不良反应报告、出现新证据或引起消费者担忧,NNHPD可以要求申请者提供额外的证据以进一步证明产品的安全性和功效性。
3 加拿大天然健康产品的声称管理
加拿大允许天然健康产品进行健康声称,但须在申请天然健康产品许可过程中同时进行申报。健康声称管理的重点放在申请产品安全性和功能声称的科学性和真实性评价上。申请者需依据规定针对申请产品的健康声称提供不同强度的安全性和功效性支持性证据。
3.1 加拿大天然健康产品的声称途径
依据加拿大现行的法规,天然健康产品申请者可以从三个途径申请天然健康产品的健康声称,包括:参考NNHPD认可的已明确的信息,其中主要参考天然健康产品专论中的健康声称进行申请;依据《进行现代健康声称的天然健康产品许可办法》的要求进行现代健康声称申请;依据《作为传统药物使用的天然健康产品许可办法》的要求进行传统健康声称申请。
3.2 加拿大天然健康产品现代健康声称的划分及要求
现代健康声称可划分为三类,包括针对严重、一般性、轻微疾病等不同的健康状态的声称;针对诊断、治疗、治愈、降低风险、预防、一般健康维持/支持/促进和抗氧化等不同健康作用的声称;针对低疗效作用的一般健康声称。
申请者依据《进行现代健康声称的天然健康产品许可办法》对产品进行现代健康声称时不能对以下四类天然健康产品进行现代健康声称,包括传统药物、顺势疗法药物、参考NNHPD标签标准证明的天然健康产品和以及《天然健康产品条例》中“60 d处置”条款中所定义的天然健康产品,“60 d处置” 条款中所定义的天然健康产品指在申请的天然健康产品中仅含有一种功效成分,且该成分为专论中的功效成分,或申请的天然健康产品中含有多种功效成分,且这些成分为专论中多种功效成分的组合。
根据健康声称及产品/成分整体风险的不同,申请者需提交不同强度的安全性和功效性证据。因此采用基于风险评估的方法对申请产品进行分类管理,依据申请的产品的风险高低分为高、中、低三个类别(见图1)。如划分为低风险类别的产品,不能进行支持暗示治疗、预防或治愈主要疾病的声称;高风险类别的产品能够进行支持治疗、治愈或预防严重疾病的声称;中风险类别的产品介于两者之间。
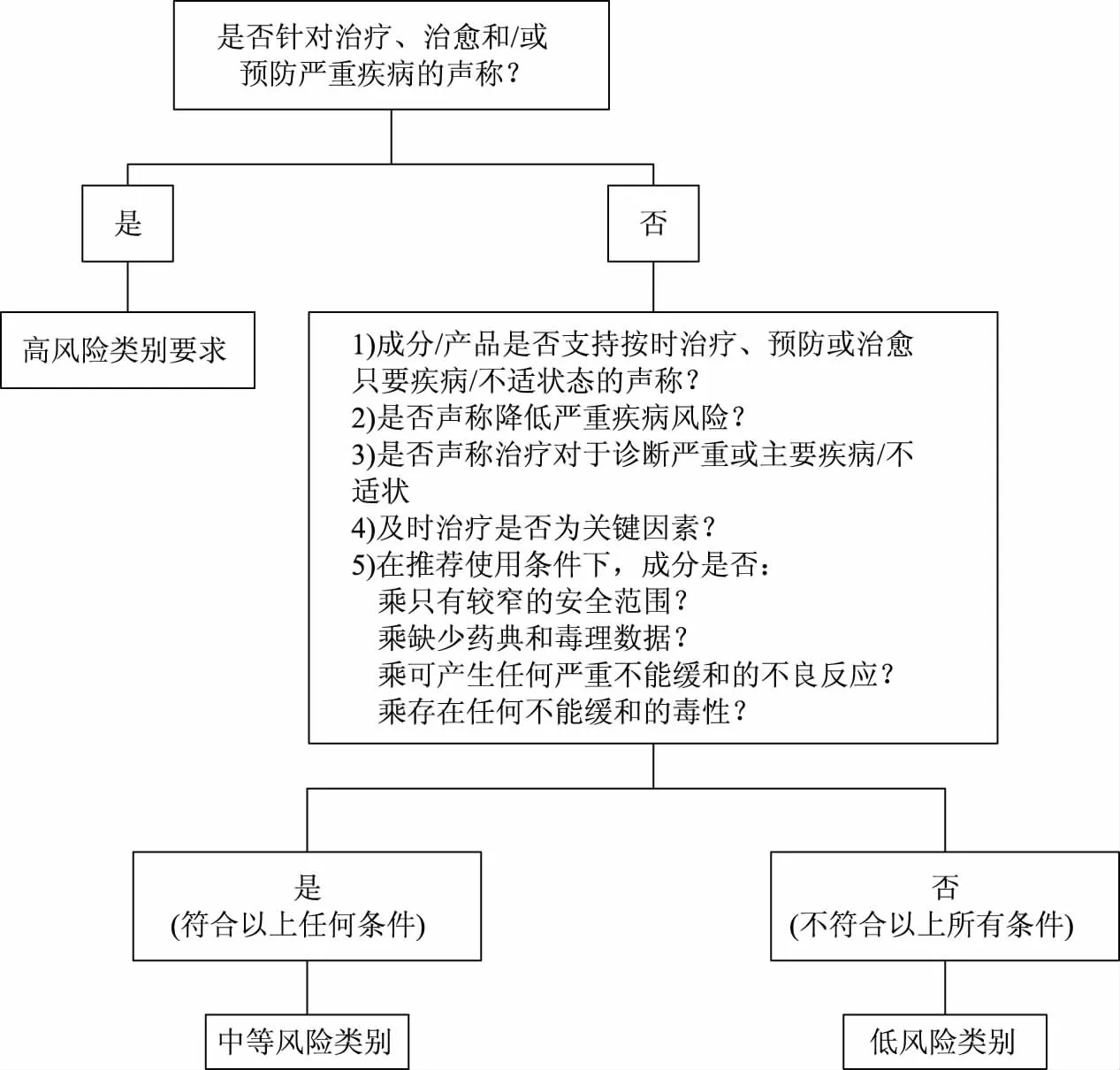
图1 安全性和功效性证据风险等级的风险评估方法Fig.1 Risk assessment method for safety and efficacy evidence risk level注:需针对每一个功效成分、每一个声称和每一个产品进行评估。
3.3 加拿大天然健康产品传统健康声称的要求
对于传统声称的管理,作为传统药物使用的天然健康产品允许进行传统声称,相关办法要求申请产品的理论依据来源于单一公认的传统医药体系,如传统中医体系,传统印度治疗体系,包括产品的原料、原料组合及其制备方法等。安全性方面已明确的信息包括专著、临床试验报告和实验观察报告等;功能声称方面包括传统中医药原料专著和中国药典等。同时不允许对严重疾病(包括但不仅限于《食品和药品法案》Schedule A所列的严重疾病,如癌症、糖尿病和哮喘等)作传统使用声称。
依据《食品和药品法案》规定,天然健康产品不允许针对公众进行涉及《食品和药品法案》Schedule A所列严重疾病的治疗或治愈声称,严重疾病包括:癌症、高血压、充血性心力衰竭、糖尿病等。《标签要求检查表》规定NNHPD不再审查标签中的广告词,需由申请人确保产品标签中不得出现对产品进行虚假、误导或欺骗性的广告声称。上市销售的天然健康产品标签信息还要求须符合《标签要求检查信息》所有要求。
4 加拿大天然健康产品的审批管理
天然健康产品上市管理主要采取分级注册的管理方式,审查的重点放在产品的安全性和功能声称上。2012年公布的《天然健康产品途径》引入了新的分级管理方式,以便为行业提供更有效和灵活的产品上市途径。新管理方式依据产品的安全性和功效性证据确定性的高低对申请产品进行分级管理,证据确定性越高的产品所需审查的时间越短,实施越简化的管理方式[4]。NNHPD主要基于已获许可的超过80000个天然健康产品的信息及已明确的信息(Pre-cleared information,PCI)确定申请产品安全性和功效性信息确定性的高低,其中已明确的信息主要包括专论、药典、标签标准、国际标准等公认的信息。据此产品申请分为三个类别并分别采取不同上市前管理方式(见图2),分别为:
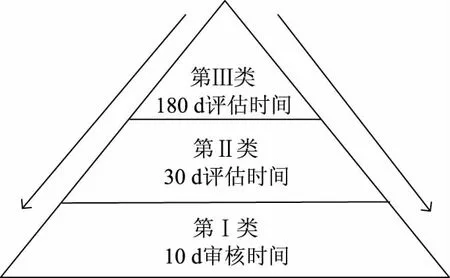
图2 天然健康产品申请许可分类及受理时间Fig.2 Natural health product application permit classification and acceptance time
第Ⅰ类:安全性和功能性证据确定性高,采取简化注册管理方式;
第Ⅱ类:安全性和功能性证据确定性为中等,采取注册管理方式;
第Ⅲ类:安全性和功能性证据确定性低,采取严格注册管理方式。
4.1 注册程序及资料要求
如表2,由于第Ⅰ类申请的产品确定性高,完全符合单个天然健康产品专论(包括单一成分专论或产品专论)的所有要求,包括来源原料、服用方式、剂型/剂量、允许声称的功能、质量指标等参数,所以第Ⅰ类申请的产品要求相对简化。申请者可通过电子申请系统eSB提交的资料,主要包括:电子版产品许可申请表(ePLA)及整合在其中的专论证明(monograph attestation),并在申请表中选择“药典类(Compendial)”申请。针对第Ⅰ类,只要完整性符合要求,申请人将在10个工作日内收到产品许可证,同时在授予一个八位数的天然健康产品编码“NPN 12345678”标注于产品标签上。如果申请中存在关于管理内容方面的缺陷,申请人将会收到不受理通知书。如果申请人要求重新提交申请,必须按照一次新的申请进行处理。
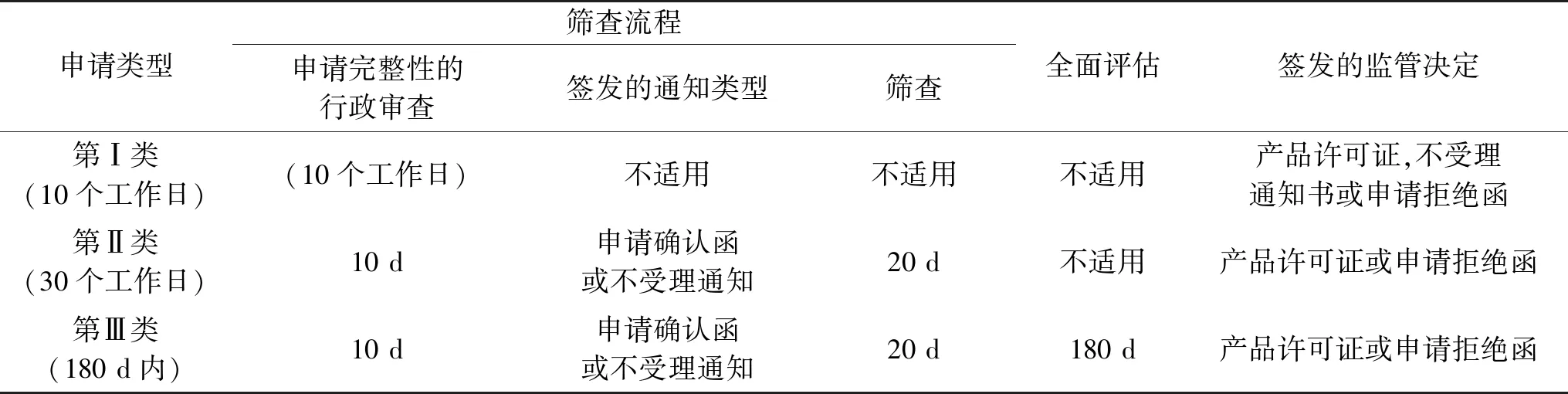
表2 天然健康产品许可申请管理的流程Table 2 Natural health product license application management process
第Ⅱ类申请的产品所使用的每种原料均符合对应的单一专论,但产品的各方面情况需通过多个专论的组合才能得到支持,无法通过单一专论进行支持。目前,NNHPD正在努力拓宽第Ⅱ类申请的适用范围,如产品所使用原料的安全性已得到NNHPD充分认可但尚未建立专论的情况。由于第Ⅱ类申请的产品确定性为中等,所以NNHPD需对申请产品进行30d的基于风险的评估和审查。申请者除需提交电子版产品许可申请表和单独的专论证明表证实产品中原料与多个专论的符合情况外,还需提交不能被专论证实的原料安全性和功能声称证据。审查基本程序包括:a)NNHPD检查申请资料的完整性(10 d内);b)资料完整,向申请人发出申请确认函,不完整,发出不受理通知书;c)依据《产品许可指引文件》[11]筛查资料,及筛查申请产品的安全性和功效性证据;d)符合要求,NNHPD核发产品许可证和授予天然健康产品编码(30 d内);e)申请存在关于管理内容方面的缺陷,发送申请拒绝函;f)若NNHPD认为Ⅱ类申请的产品的安全性和功能声称证据存在较高不确定性,将按照第Ⅲ类申请的要求继续对产品进行全面评估。
由于第Ⅲ类申请的产品存在较高的不确定性,因此NNHPD需对申请资料中的安全性和功能声称的支持性证据进行全面评估。在进行全面评估前,NNHPD也需对提交的资料的完整性进行检查和符合性进行筛查。经全面评估后(180 d内),NNHPD将发信通知申请者进一步的情况:a)确认符合要求后,发送产品许可证和授予天然健康产品编码;b)评估中发现资料存在重要缺陷或信息缺失,发送申请拒绝函。三种类型天然健康产品许可申请的管理流程及NNHPD的流程详见表2。
4.2 评估审查重点
第Ⅰ类申请的产品其安全性和功能声称确定性高,因此NNHPD主要审查申请资料的完整性,不对资料进行评估。
第Ⅱ类申请的产品,其安全性和功能声称确定性为中等,因此NNHPD除需审查产品原料与专论的符合情况,还需审查和评估不能由专论支持的原料/原料组合的安全性和功能声称证据。
第Ⅲ类申请的产品,其安全性和功效性证据的确定性较低,其原因包括但不限于以下的情况:a)产品含有新成分或成分组合;b)产品针对严重疾病/不适状态进行的此前未获许可的声称;c)产品可能存在显著的安全性问题。第Ⅲ类申请的产品,若部分功效成分或组合可由专论支持,则申请者可提交独立的专论证明表格证明其与专论的符合性;针对专论不支持的部分,申请者需依据产品功能声称强度不同而提交相应的支持性证据。如申请者可根据《进行现代健康声称的天然健康产品许可办法》中《不同风险类别的最低可接受安全性和功效性证据表》提交支持性证据。其中规定高风险类别需至少提交一份临床Ⅲ期或Ⅳ期的试验报告(随机,对照和合理设计的)或其他相当的证据;中风险类别需至少提交一份临床Ⅱ期的试验报告及两份强度相当或更高的报告;低风险类别至少提交一份临床Ⅱ期的试验报告及两份强度相当或更高的报告。此外,申请者还可能需针对使用条件包括服用方式、剂型、剂量等和功效成分的化学形式、物理形式,成分来源等提交相应的支持性材料。例如针对剂型,若为不常见的剂型且其成分不稳定则需提供剂型的安全性证据;若剂型可影响到产品的药物动力学,需提交对产品功效性是否存在潜在影响的功效性证据。
随着新天然健康产品安全性和功效性证据信息的不断积累和增加,NNHPD将会相应地对专论进行修改和增补。随着发布专论的积累,获认可的已明确信息不断增加,NNHPD将推动高不确定性的申请类别向低不确定性的申请类别转移,如第Ⅲ类向第Ⅱ类转移,第Ⅱ类向第Ⅰ类转移。
5 加拿大天然健康产品及其原料管理对我国保健食品的启示
加拿大的保健食品及其原料管理,在管理模式上和我国有很多相似之处,两国都强调政府在保健食品质量和安全方面的监管作用,因而采取了名单制为核心的审查、评估体系,并建立了严格的管理保健食品的声称制度。但是,通过上文的分析可以看到,加拿大的保健食品无论在原料目录的设置上还是产品声称的程序和内容上都做了更为细致的制度安排,具体而言,加拿大的管理模式对我国保健食品原料及其管理有如下几点启示。
5.1 扩展保健食品原料目录范围,加快原料目录修订进程
首先,应填补原料目录中原料复配规定的空白。加拿大的原料目录中有关于原料复配的规定是有必要的,因为目录表中某些原料的复配可能导致产品风险增加、功能下降或者产生矛盾的使用效果,而绝大多数保健品都是复配而成的。因而,让产品申请者在不同条件下提供相应的安全性和功效性方面的证明,能较为有效地避免或减少因原料复配带来的风险。
其次,就单一的原料来看,我国原料目录需要进一步完善和扩充。例如,出现在加拿大原料目录中的必需脂肪酸和益生菌等原料,实际上已经被我国的保健食品广泛的使用了,并多次通过了国家食品药品监督总局的评审,但目前仍然没有进入保健品原料的目录。2015年修订的《中华人民共和国食品安全法》第七十七条规定“对使用保健食品原料目录以外原料的保健食品作出准予注册决定的,应当及时将该原料纳入保健食品原料目录”。应该加快目录修订、增订的进程,尤其是那些已经被多次注册过的原料,有计划地推进目录修订工作。更为完备的保健品原料目录,既能提高保健食品原料管理的规范化程度,又将大大提高审查审批的效率。
5.2 建立简易注册程序,合理规划评审资源
加拿大的保健食品审批,依据产品安全性和功效性信息确定性高低分为三个类别,分别接受三种不同严格程度和不同时长的审核。我国目前对保健食品的审批主要有注册与备案两个程序:注册适用于使用保健食品原料目录以外原料的保健食品,首次进口的保健食品(属于补充维生素、矿物质等营养物质的保健食品除外);备案适用于使用的原料已经列入保健食品原料目录的保健食品,首次进口的属于补充维生素、矿物质等营养物质的保健食品[12]。
我国注册、审核的程序设计思路和加拿大是一致的,都以“原料信息的确定性”作为区分程序繁简的依据;不同之处在于加拿大用以判断确定性的依据是“已获许可的超过80000个天然健康产品的信息及已明确的信息”,而我国的判断依据主要是待评审原料是否在原料目录中、产品是否为进口产品。
我国做法的优点在于规则清晰明了,便于申请人区分,但同时使得那些曾经通过审评、但尚未进入原料目录的原料被重复的审评。而实际上,曾经通过审评本身已经能够说明该原料比那些从未接受过审评的原料具有更高的确定性。所以,让两者适用同样严格的程序,即降低了审批效率,也不利于集中有限行政资源在更需要仔细评审的地方——那些初次被评审的原料。
因此,建议在现有程序上,借鉴加拿大分流产品申请的做法,建立简易注册程序——将那些原料尚未纳入原料目录,但先前已经通过评审(或通过一定次数评审)的原料,制作“临时原料清单”,将使用这些原料的保健食品纳入简易程序,规定较短的审评时间。稳妥起见,如果简易程序审评期间发现可能导致不通过的问题,可径行转为普通注册程序。适用简易程序还是普通程序也可由申请人选择,提高制度灵活性。
5.3 建立多级声称管理,理顺声称类别的逻辑层次
加拿大的健康产品声称管理中,天然健康产品依据产品的安全性和功效性来划分产品的风险——高、中、低,传统声称也要经过相应的风险评估。这种声称并不指向产品的具体功能,而是指向产品的功效性和安全性这种程度性指标。与之对应的是中国要求所有保健食品需一律声明“本品不能代替药物”。该声明虽然也起到了风险的提醒作用,严格区分了保健食品和药品,但它却模糊了不同类型保健品之间的功能性和安全性的差异。其本意是想保护消费者不受虚假、夸大宣传的影响,但因为简单的二分法提供不了更多信息,同样不利于消费者依据自身需要选择更为个性化的产品。同时,也让功效和安全性良莠不齐的保健食品混在其中。因此,是否可以尝试在现有“本品不能代替药物”的基础上,增加对保健食品功效性和安全性不同层级的、更为细致的声明。
因为加拿大的声明是依据程度划分的,因而不同声称之间天然具有排他性。而我国声明制度是依据产品功效建立的,由27个功能声称组成,27个声称之间没有分层。也就是说,这些功效实际上是列举式的,它们之间不可避免的存在交叉或包含等逻辑上不周延的情况。例如,相比于增强记忆力,增强免疫力、抗氧化功能相对而言是一个宽泛的概念,应该作为一个类别的声称,而增强记忆力则应该处于某个类别声称下的某个具体声称。否则,则给了商家夸大甚至虚假宣传的空间。因此,建议重新梳理我国的功效声称名录,让声称管理更加严谨、规范。

