自发性冠状动脉夹层临床特点分析
许浩博,高晓津,郭超,王娟,刘蓉,胡奉环,乔树宾,高润霖
自发性冠状动脉夹层(spontaneous coronary artery dissection, SCAD)是一种相对罕见且病因尚不完全明确的冠状动脉性疾病,其病理生理机制为自发形成的血管夹层或壁内血肿,从而导致管腔狭窄及闭塞[1-2]。随着冠状动脉造影的普及和冠状动脉腔内影像学的进展,SCAD 被更多的报道并引起临床医师更多的关注。相关研究表明,SCAD 与动脉粥样硬化、围产期、结缔组织病、纤维肌发育不良等因素有关[3-4]。统计资料显示SCAD 患者年龄较轻,以女性多见,合并传统的冠心病危险因素相对较少[5-6]。但以上数据基本来自欧美人群,而有关SCAD 在亚洲人群中发病特点的报道目前仍然较少。阜外医院于1990 年发表了SCAD 的病例报告,但SCAD 治疗策略的选择目前仍未达成共识[7-8]。为此,本研究回顾性分析了阜外医院SCAD 患者的病例资料,进一步探讨其临床特点和治疗策略的选择。
1 资料与方法
对象:回顾分析阜外医院2004 年1 月至2017年11 月间,病历系统中出院诊断为冠状动脉夹层的病例共58 例。除外医源性冠状动脉夹层20 例,主动脉夹层累及冠状动脉者12 例,冠状动脉粥样硬化斑块破裂所致冠状动脉夹层者1 例,既往靶血管行介入治疗的患者1 例,共发现SCAD 病例24例。SCAD 的诊断标准如下:冠状动脉造影显示管腔内线性、螺旋状或局限性的透亮区而无论有无造影剂滞留或血管内超声(IVUS)/光学相干断层成像(OCT)证实有假腔或壁间血肿[9],同时需除外医源性夹层、主动脉夹层累及冠状动脉、创伤性夹层及动脉粥样硬化斑块破裂所引起的夹层。对于女性SCAD 患者,根据世界卫生组织定义其产后期为产后6 周以内,围产期定义为怀孕28 周至产后1 周期间[10]。由2 位高年资主治医师阅读并判别冠状动脉造影影像。
根据最新SCAD 分型标准[1]进行病变分型:1型:冠状动脉造影示动脉管腔内线性、螺旋状或局限性的透亮区而无论有无造影剂滞留或排空延迟;2型:冠状动脉造影示动脉管腔呈弥漫(通常20~30 mm)且光滑的狭窄,狭窄严重程度不定;3 型:冠状动脉造影示局限或管状的狭窄,类似动脉粥样硬化表现,需腔内影像学证实壁内血肿或假腔的存在;4 型:冠状动脉造影示冠状动脉完全闭塞,通常发生于血管远端,需血管再通后协助诊断并除外血栓栓塞。
方法:记录患者的基本资料,包括病史、入院前基线资料、临床表现、入院检查结果等。对患者进行回顾性随访,并记录患者临床症状有无缓解、主要不良心脑血管事件(MACCE)的发生等。其中MACCE 定义为全因死亡、心原性死亡、心肌梗死、缺血驱动的血运重建和脑卒中/短暂性脑缺血发作。患者合并动脉粥样硬化定义为在夹层病变所累及血管外的其他血管内,通过造影或IVUS/OCT 检查证实存在动脉粥样硬化。采用电话或门诊形式对患者进行随访,共有21 例患者完成随访。本文计量资料采用均数±标准差或中位数表示,计数资料以百分比表示。
2 结果
24 例SCAD 患者临床特征(表1):24 例患者平均年龄(48.1±13.3)岁,其中女性8 例(33.3%),女性患者中,1 例处于产后期,2 例生产次数≥4 次。体重指数(BMI)平均值为(25.6±4.6)kg/m2。有吸烟史的患者11 例(45.8%),且均为男性。高血压患者8 例(33.3%),合并糖尿病患者3 例(12.5%)。总胆固醇平均值为(3.9±1.0)mmol/L,低密度脂蛋白胆固醇为(2.2±0.9)mmol/L。11 例(45.8%)患者有陈旧性心肌梗死,3 例(12.5%)患者有既往脑血管疾病史。2 例(8.3%)患者合并类风湿性关节炎。以急性冠状动脉综合征起病的患者18 例(75.0%),其中ST 段抬高型心肌梗死(STEMI)和非ST 段抬高型心肌梗死(NSTEMI)均为4 例(16.7%),不稳定性心绞痛10 例(41.6%)。超声心动图结果显示患者的平均左心室射血分数(LVEF)为(57.2±12.2)%,LVEF<50%的患者6 例(25.0%)。
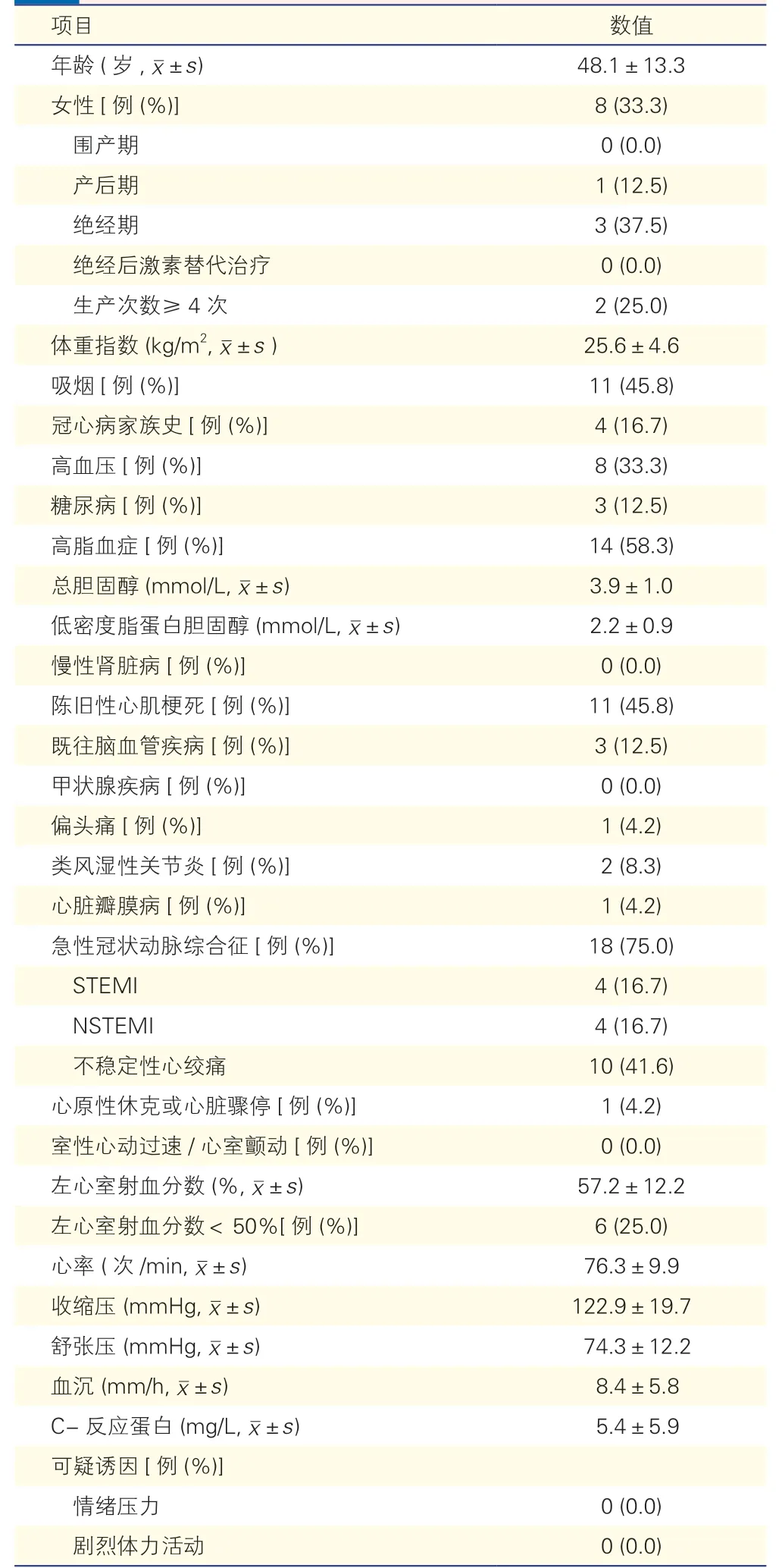
表1 24 例患者的基线资料和临床表现
冠状动脉造影结果和病变特征:SCAD 患者的冠状动脉造影结果见图1。其特点如表2 所示,有8例(33.3%) 患者合并冠状动脉粥样硬化,2 例(8.3%)患者应用IVUS/OCT 检查协助诊断。有1 例(4.2%)患者合并冠状动脉解剖异常,右冠状动脉开口于左冠窦。4 例(16.7%)患者合并多支冠状动脉夹层病变。在24 例SCAD 患者中共发现夹层病变28 处,右冠状动脉夹层占15 处(53.6%),左主干夹层占3 处(10.7%),且左主干夹层均累及左前降支,单纯左前降支夹层7处(25.0%),左回旋支夹层2处(7.1%),对角支或钝缘支夹层占1 处(3.6%)。在28 处夹层中,累及血管近段的病变15 处(53.6%),弥漫病变(≥两个血管节段)7 处(25.0%)。22 处(78.6%)病变血管TIMI 血流3 级,TIMI 血流1 级和0 级均为3处(10.7%)。根据SCAD 夹层分型,所有28 处夹层均为1 型夹层病变。
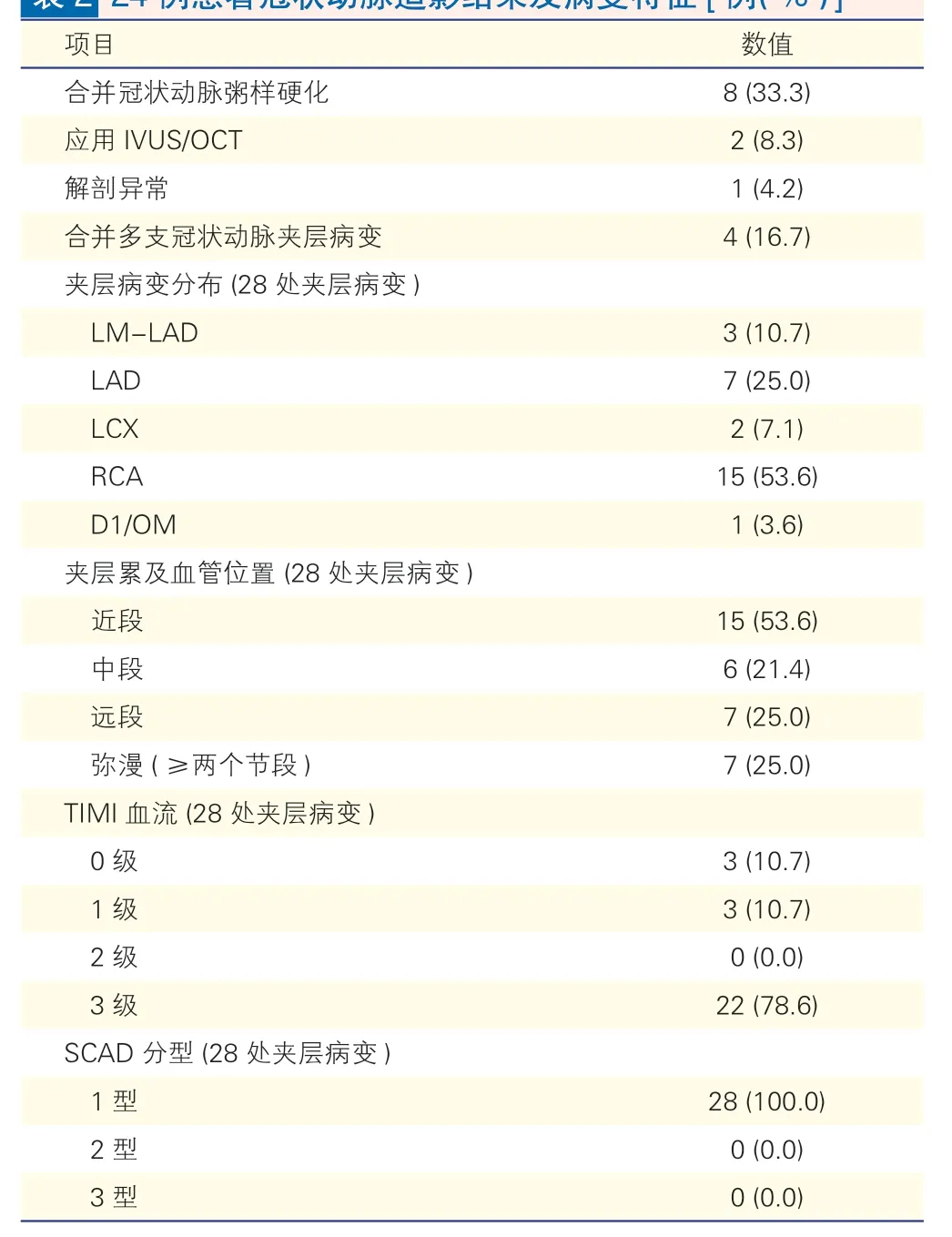
表2 24 例患者冠状动脉造影结果及病变特征[例(%) ]
治疗策略及预后(表3):24 例患者中,6 例(25.0%)初始血运重建方式为经皮冠状动脉介入治疗(PCI),PCI 成功率为83.3%(5/6),1 例病变PCI失败后行冠状动脉旁路移植术(CABG) 治疗,平均置入支架为(2.4±1.1)枚。初始血运重建治疗为CABG 和溶栓的患者均为2 例(8.3%),余14 例给予药物保守治疗 。在TIMI 血流小于3 级的6 处病变中有4 处行血运重建治疗,其中2 处行PCI,1 处行CABG,1 处进行溶栓。TIMI 血流3 级的22 处病变中共有6 处行血运重建治疗,其中4 处行PCI 治疗,CABG 和溶栓各1 处。所有患者在出院后均接受冠心病二级预防药物治疗。应用双联抗血小板药物治疗的患者19 例(79.2%),应用他汀类药物的患者22例(91.7%)。另有20 例(83.3%)的患者接受β 受体阻滞剂治疗,18 例(75.0%)的患者接受硝酸酯类药物治疗。共有21 例(87.5%)患者完成随访,随访时间中位数为31(4~168)个月,仅1 例(4.2%)患者在随访期间发生脑梗死。
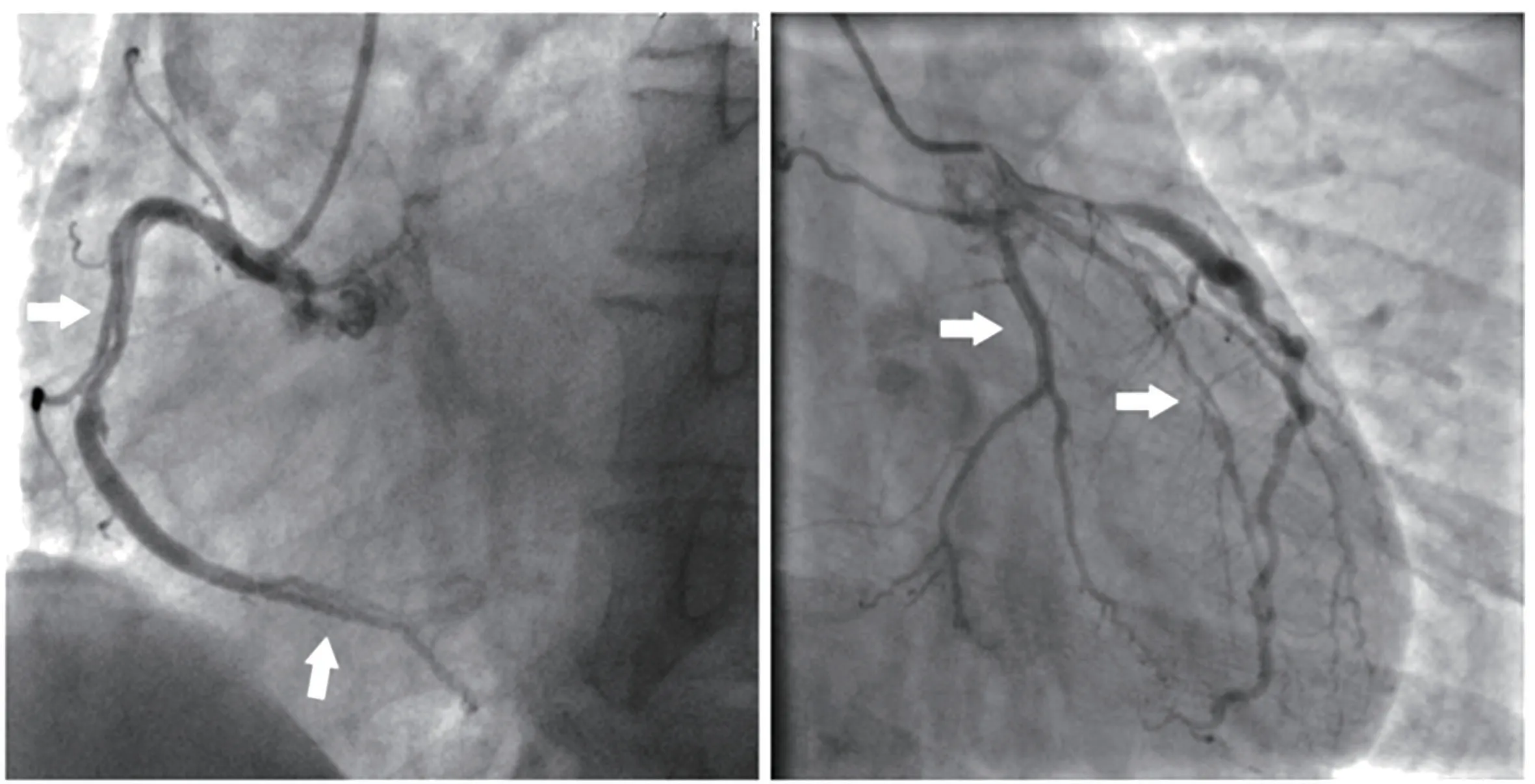
图1 自发性冠状动脉夹层造影结果
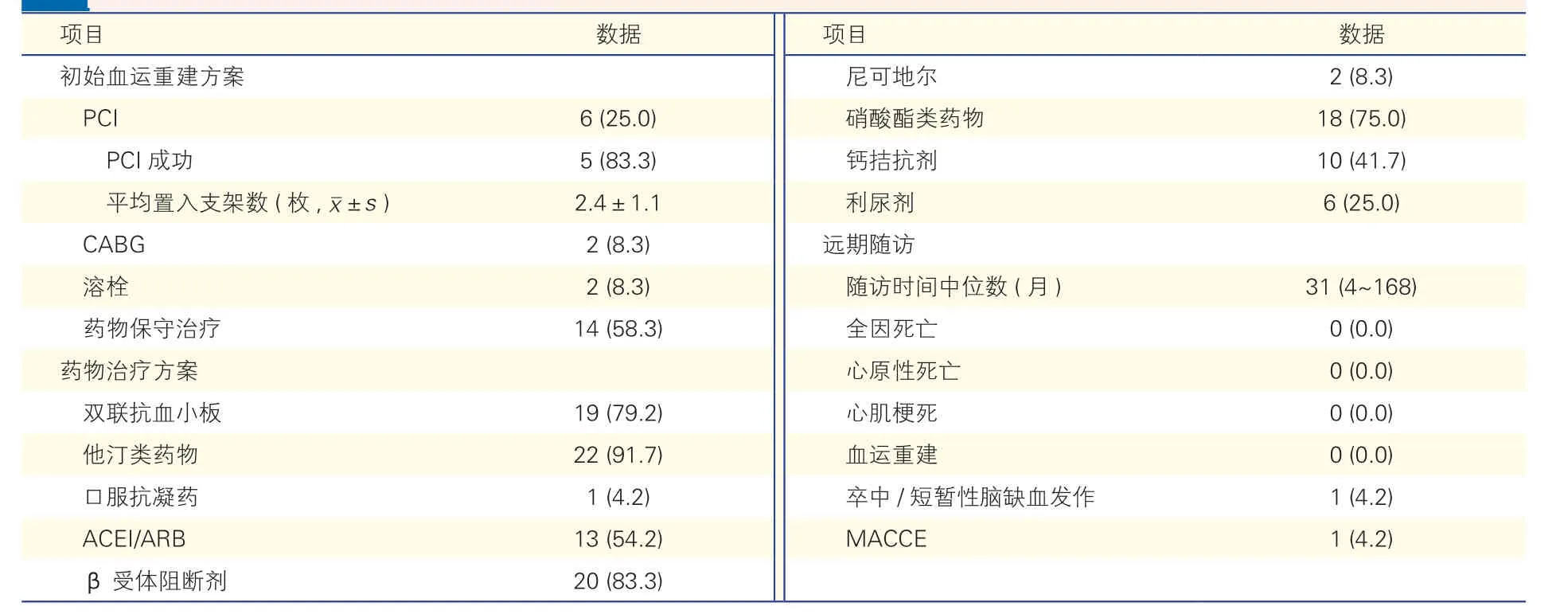
表3 24 例患者治疗及预后[例(%)]
3 讨论
随着冠状动脉造影检查的广泛应用,人们已经认识到SCAD 是引起急性冠状动脉综合征的重要原因之一,尤其是在中青年女性和缺少冠心病危险因素的人群中[1]。多项病例研究结果提示SCAD 的实际发病率可能更高,且其治疗原则不同于冠状动脉粥样硬化性心脏病。本研究回顾分析了阜外医院自2004 年至2017 年间诊断为SCAD 的患者24 例。分析显示,SCAD 患者年龄较轻,平均年龄(48.1±13.3)岁,女性患者8 例(33.3%)。其中18 例(75.0%)的患者以急性冠状动脉综合征起病,14 例(58.3%)的患者给予药物保守治疗。随访时间中位数为31 个月,MACCE 事件1 例(4.2%)。
国外研究显示SCAD 患者中女性所占比例较高,有些研究结果显示甚至可达90.8%[11]。年龄一般较轻,平均年龄(52.5±9.6)岁,其中合并高血压和高脂血症的患者分别占36.4%和25.7%[6]。在本研究中,SCAD 患者年龄同样较轻,平均年龄为(48.1±13.3)岁,合并高血压患者占33.3%,低密度脂蛋白胆固醇平均为(2.2±0.9)mmol/L,以上结果与既往研究基本相符。但本研究中女性患者所占比仅为33.3%,这一结果可能与研究对象为东亚人种有关。一项日本的SCAD 研究中,女性患者所占比例同样低于西方人群,为58.0%[5]。但是,我们也应当考虑到,冠状动脉腔内影像技术在我国开展较晚,近几年逐渐增加,因此可能导致早期相当一部分SCAD 患者漏诊。同时,一些中青年女性在发生胸痛时往往不被认为是急性冠状动脉综合征,这可能也与女性患者所占比例低有一定关系。本研究中发现11 例(45.8%)的患者有吸烟史,且均为男性,故推测吸烟可能是男性SCAD 患者的一项危险因素。目前研究发现,纤维肌发育不良(fibromuscular dysplasia,FMD)可能是SCAD 的首要发病原因,有研究发现高达70.0%的SCAD 患者合并FMD[12]。但在本研究中,所有患者均未行选择性外周动脉造影检查,仅4 例患者行外周动脉超声检查,未发现合并FMD,但FMD 的实际发病情况不详。此外,本文中11 例(45.8%)的SCAD 患者有陈旧性心肌梗死,提示该部分患者在就诊前就已经发生心血管事件,但未引起重视。
在影像学检查方面,如表2 所示,8 例(33.3%)的SCAD 患者合并冠状动脉粥样硬化。研究表明冠状动脉粥样硬化可能是SCAD 发生的原因之一[13-14]。同时,也有部分学者在研究SCAD 时除外了合并冠状动脉粥样硬化的患者[6]。一项来自日本学者的研究中发现,对13 例SCAD 患者进行OCT 检查,其中12 例患者的夹层血管近端可见动脉粥样硬化表现,但未发现易损斑块[5,15]。而另一项研究中,研究者虽除外了合并冠状动脉粥样硬化的患者,但其IVUS/OCT 应用率仅为13%[16]。故随着冠心病发病年轻化和发病率的逐年增加,SCAD 发生于合并有冠状动脉粥样硬化的血管是非常可能的,但SCAD 是否源于易损斑块的破裂则需要腔内影像学进一步证实。然而,IVUS/OCT 的应用也存在潜在风险,如操作过程中夹层扩大或真腔闭塞,故推荐仅在造影无法明确诊断且管腔直径足够大时建议使用,而发生于冠状动脉远段的夹层往往由于管腔细小而无法最终通过IVUS/OCT 明确诊断[2,17]。在本研究中,28处夹层均为1 型夹层,而在既往SCAD 研究中,1型夹层所占比例约为25%~48%[6]。我们认为本研究结果的不同主要与IVUS/OCT 应用率低有关,2 型或3 型夹层病变因未行IVUS/OCT 检查而未能证实。在本研究中,15 例(53.6%)的夹层发生于右冠状动脉,而在Saw 等[6]研究中,累及右冠状动脉的夹层病变占23.0%。一项中国的SCAD 研究中,共有患者21 例,仅19%的病变累及右冠状动脉[18]。我们推测受累血管分布的不同可能与病变类型的不同和样本量大小有关,还需进一步扩大样本量来明确SCAD 受累血管的分布情况。
关于SCAD 的治疗策略,因缺少大规模的随机对照研究,目前仍未统一。较广泛接受的观点是对于血流动力学稳定且病变低危的患者推荐保守治疗[13,16]。研究显示,大多数SCAD 病变在进行造影随访时可自行愈合[1,16,19]。如患者存在持续缺血、左主干病变或血流动力学不稳定,则建议根据个体化选择血运重建治疗方案[1]。在本研究中,TIMI 血流小于3 级的6 处病变中有4 处行血运重建治疗,而TIMI 血流3 级的22 处病变中仅6 处行血运重建治疗。故在本研究中,是否对患者进行血运重建主要依据冠状动脉血流情况,这一结果与上述治疗策略基本相符。在SCAD 的药物治疗方面,目前仍缺少循证医学的证据,尤其在是否需要双联抗血小板药物治疗和抗血小板治疗时程上。目前较为认可的观点是如患者进行血运重建治疗,则术后需接受标准的抗血小板治疗[2,20]。本研究中19 例(79.2%)的患者接受双联抗血小板药物治疗,这一比例与其他研究中双联抗血小板应用的比例相符。本研究中另有22 例(91.7%)的患者接受他汀药物治疗,20例(83.3%)的患者接受β 受体阻滞剂治疗,18 例(75.0%)的患者接受硝酸酯类药物治疗。然而,以上药物中仅β 受体阻滞剂被证明与SCAD 的复发呈负相关[6]。故对SCAD 患者的最优药物治疗方案仍需进一步研究。尽管血运重建策略和药物治疗方案未完全统一,SCAD 的预后相对较好。Rogowski 等[19]对63 例SCAD 患者随访4.5 年,所有患者均存活并且无缺血症状。本研究中共有21 例患者完成随访,随访时间中位数为31 个月,仅1 例患者在随访中出现脑梗塞,并未观察到心原性死亡、再发心肌梗死、血运重建、夹层复发等事件,MACCE 发生率为4.2%。本研究随访结果与其他研究一致,提示SCAD 预后相对较好。
本研究总结了我院近年来收治的SCAD 患者的发病特点、治疗策略和预后,为SCAD 的诊断和治疗提供了一定的临床参考。而随着冠状动脉造影及冠状动脉腔内影像学检查的广泛应用,人们对SCAD 的认识将进一步增加。本研究存在以下局限性:首先,本研究为回顾性的单中心研究,病例均来自于医院病历查询系统,病例跨越年份大,病例数相对较少,仅在一定程度上反应了SCAD 患者的病例特点,还需进一步扩大样本量并且进行多中心研究。其次,本研究中腔内影像学应用率低,可能存在相当数量的漏诊病例。最后,研究中所有患者均为1 型SCAD,其他类型SCAD 的病例特点本文中未能体现。因此,在临床工作中需要对SCAD 提高警惕,尽量减少漏诊,积累更多数据来进一步改善SCAD 的诊断和治疗现状。

