青海湖微生物群落的共生模式 ※
石 晴,韩 睿,邢江娃,李永臻,沈国平,永 胜,朱德锐*
(1.青海大学医学院基础医学研究中心,西宁 810016;2:青海大学农林科学院,西宁 810016)
青藏高原的湖泊类型众多,按照湖泊水体的矿化度不同可分为淡水湖(<1g/L)、咸水湖(≥1g/L)以及盐湖(≥50g/L)。[1]根据离子组成不同,盐湖又可分为氯化物型(如察尔汗盐湖)、硫酸盐型(硫酸钠亚型如运城盐湖,硫酸镁亚型如茶卡盐湖)和碳酸盐型(如扎布耶盐湖)三类。[2]微生物群落是水生环境中的基本组成部分,主要包括细菌、古菌和真核生物等,在地球生物化学循环中发挥着至关重要的作用。目前,高通量测序(High-throughput sequencing)技术因具有测序深度大、准确性强及重复性好等特点,已广泛应用于湖泊微生物多样性、群落结构和微生物—生境互作等方面的研究。如Salmaso等[3]采用Illumina Miseq高通量测序平台分析阿尔卑斯山以南湖泊浮游细菌群落组成的季节性变化;Jones等[4]利用454焦磷酸测序揭示低盐度湖泊中细菌与真核生物之间的互作关系和共生模式。
青海湖(99°36′-100°16′E,36°32′-37°15′N)是我国最大的内陆咸水湖,位于青藏高原东北部,盐度为14.3~16.0 g/L,面积为4 583 km2,海拔为3 196 m,pH介于8.8~9.3。[5]青海湖由40多条河流补给,主要支流是布哈河、沙流河、哈尔盖河、泉吉河和黑马河,具有季节性补给特征。近年来,针对青藏高原硫酸镁亚型湖泊(如茶卡盐湖、小柴旦盐湖和柯柯盐湖)的微生物多样性和群落结构分析已有诸多报道[6-8]。青海湖隶属硫酸钠亚型咸水湖,水体中栖息的细菌和古菌群落、环境因子与物种的相关性以及互作关系尚不明确。
本研究采用高通量测序技术全面探究青海湖细菌和古菌的群落结构、物种与环境因子的相关性及种群间的互作关系,为盐湖微生物资源的综合利用提供理论参考依据。
1 材料与方法
1.1 样品采集及处理
课题组于2017年7月采集青海湖水样(附带盐湖底泥),采样点分别位于布哈河附近(99°48′32″E,36°59′29″N。Q1)、沙岛附近(100°39′26″E,36°51′47″N。Q2)、蓝宝石附近(99°45′46″E,38°8′42″N。Q3)及未知地点(99°47′34″E,36°44′37″N。Q4),水样采集深度介于15~25 cm。水样理化参数(总有机碳TOC,总有机氮TN,总盐度TS;pH;Na+,K+,Mg2+,Ca2+,Cl-,SO42-,CO32-)测定由上海微谱化工技术服务有限公司完成,检测标准参照离子色谱分析方法通则(JY/T 020-1996)。
1.2 基因组DNA提取与PCR扩增
水样采用0.22 μm灭菌滤膜真空抽滤,将滤膜剪切,参照试剂盒(QI Aamp Fast DNA Stool Mini Kit,上海赛百盛公司)说明书抽提基因组DNA。分别对细菌和古菌16S rRNA基因的V3-V4区和V3-V5区进行PCR扩增(美国ABI Gene Amp 9700),细菌引物为338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′);古菌引物为344F(5′-ACGGGGYGCAGCAGGCGCGA-3′)和915R(5′-GTGCTCCCCCGCCAATTCCT-3′)。PCR扩增采用TransStart Fastpfu DNA Polymerase(北京全式金生物技术公司),反应条件为95 ℃180 s,95 ℃ 30 s,55 ℃ 30 s及72 ℃ 45 s,细菌和古菌分别进行27个和32个循环,最后于72 ℃延伸10 min。采用AxyPrep DNA凝胶回收试剂盒(美国Axygen公司)纯化PCR产物,产物用电泳法检测。
1.3 测序数据优化处理与OTU聚类
PCR产物采用Quanti FluorTM-ST蓝色荧光定量系统(美国Promega公司)检测定量,按照每个样品的测序量要求,进行相应比例的混合后,由上海美吉生物科技有限公司完成高通量MiSeq测序(Illumina MiSeq PE300)。测序获得的双端序列,根据Reads之间的Overlap关系进行拼接(Merge),同时对Reads质量和Merge效果进行质控过滤。根据序列首尾两端的Barcode和引物序列区分并优化有效序列。利用Usearch 7.0软件,按照97%相似性对非重复序列进行OTU聚类。
1.4 Alpha多样性分析和样本与物种关系分析
通过Mothur v.1.30.1软件,对菌群多样性指数Simpson和Shannon、菌群丰度指数Chao1和Ace以及测序深度指数Coverage进行计算分析。基于Qiime平台和RDP classifier贝叶斯算法对OTU代表序列进行分类学分析,参照Silva数据库,分别在门(Phylum)、纲(Class)与属(Genus)水平上统计各样本的群落组成,利用Circos-0.67-7软件绘制样本与物种关系图。
1.5 环境因子相关性分析
通过计算环境因子与物种间的Spearman和Pearson相关系数,构建青海湖细菌和古菌属的相关性Heatmap图。热图的X轴和Y轴分别表示环境因子和物种,计算获得R与P。R以颜色区间展示,绿色代表负相关,红色代表正相关,颜色的深浅表示数值的大小。
1.6 共线性网络分析
以共线性网络分析物种(species-node)与环境样本(sample-node)的共存关系,采用Networkx网络分析工具包,计算网络直径(Diameter)、紧密系数(Closeness Centrality),分析网络拓扑的节点度分布(Degree Distribution)状况和节点联通性(Degree)、介数中心性(Betweeness Centrality)等。网络节点的中心系数值的大小与网络重要性呈正相关。
1.7 物种相关性分析
选取属水平总丰度前50的物种,计算物种之间的Spearman相关系数,构建相关优势菌属的关联网络(相关系数阈值>0.5,且P<0.01)。利用Cytoscape软件将相互作用网络图可视化,并将不同的物种模块化。节点的大小表示物种丰度大小,同一分类物种(门水平)显示同种颜色,连线颜色表示物种间的正负相关性(红色表示正相关,绿色表示负相关),线的粗细表示Spearman相关系数大小(线粗表示物种相关性高),线的多少表示物种与其他物种的联系密切程度。
1.8 序列提交
本研究所得序列均已提交至NCBI数据库。细菌BioSample登录号为SAMN09949693-SAMN09949695和SAMN09949730;古菌BioSample登录号为SAMN09949732和SAMN09949765-SAMN09949767。
2 结果
2.1 青海湖理化特征分析
采用离子色谱法分析青海湖4个样本理化指标(表1),水体离子以SO42-、Cl-及Na+为主,属于硫酸钠亚型湖,与郑绵平[2]报道一致。样本Q1~4的TS为10.05~10.86 g/L、TOC为5.9%~6.5%、TN为0.19%~0.23%,pH为8.80~8.86。对比分析表明,样本Q2的TOC、TN及pH均高于样本Q1、Q3、Q4,而TS及Na+、K+、Mg2+、Ca2+、Cl-、SO42-、CO32-相对偏低。

表1 青海湖不同水样的理化指标Table1 Physicochemical characteristics of different water samples in Qinghai Lake
2.2 青海湖细菌与古菌的多样性分析
通过Silva数据库对97%相似水平的OTU代表序列进行分类统计,4个样品获得细菌743个OTU(33门66纲395属)、古菌592个OTU(12门19纲68属)。通过样品的微生物多样性指数综合分析(表2),表明样品细菌与古菌测序深度Coverage值均在99%以上,说明样本测序基本覆盖所含物种,足以代表样本中微生物的真实情况。Ace指数(449±60)、Chao指数(454±60)、Shannon指数(4.20±0.42)和Simpson指数(0.05±0.03)显示青海湖细菌群落丰度及多样性较高(于古菌而言),但各样本因采样环境以及位点差异,其物种丰度和多样性存在一定的差异。
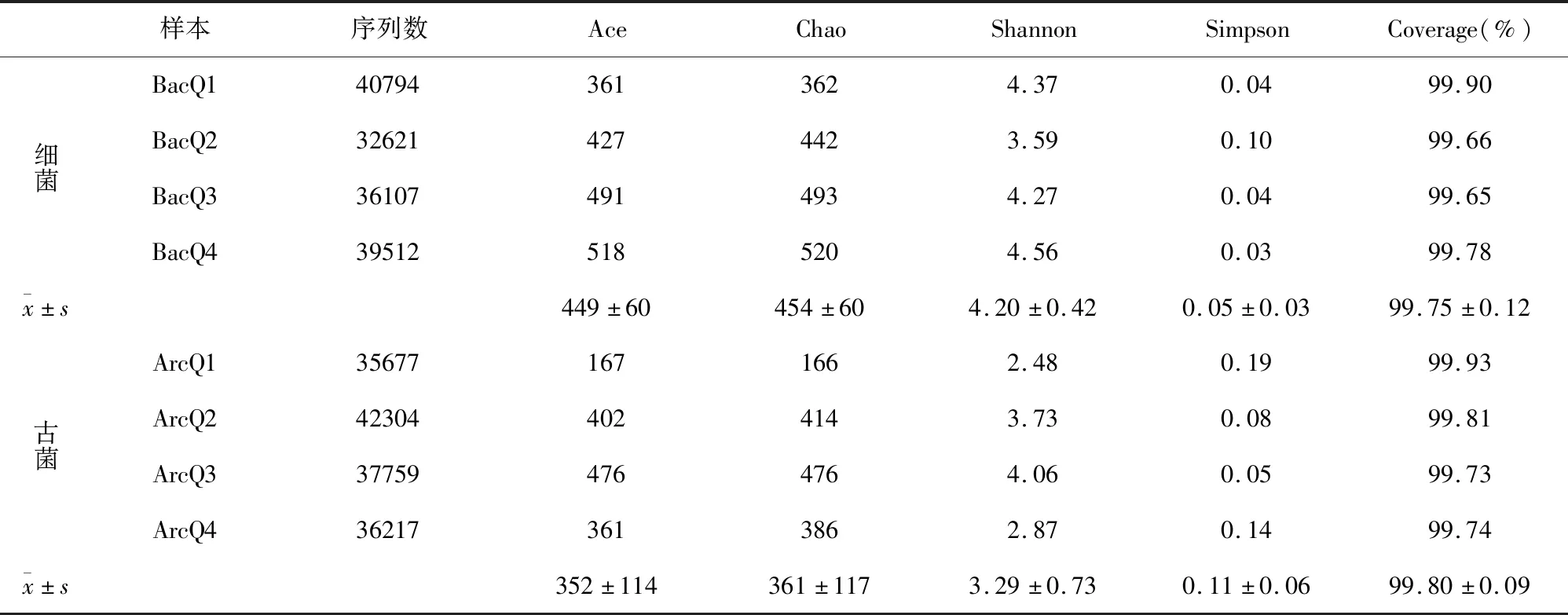
表2 青海湖不同样品细菌和古菌的多样性分析结果Table2 Diversity analysis of bacteria and archaea in different samples from Qinghai Lake
2.3 青海湖细菌与古菌的物种组成分析
根据物种注释结果进行门、纲与属水平的丰度统计(图1)。分析表明:青海湖细菌类群变形菌门(Proteobacteria,60.53%)占绝对优势,其次为拟杆菌门(Bacteroidetes,17.39%)、放线菌门(Actinobacteria,11.61%)和厚壁菌门(Firmicutes,2.56%)。在纲分类水平上(图1-A),细菌丰度较高的有α-变形菌纲(Alphaproteobacteria,28.16%)、γ-变形菌纲(Gammaproteobacteria,18.58%)、放线菌纲(Actinobacteria,11.61%)和Flavobacteriia(9.98%)及β-变形菌纲(Betaproteobacteria,8.55%),在各样本中丰度比例不同。在属分类水平上(图1-B),各样本组成差异较大,样本Q2和Q4的优势种群为Loktanella,分别占30.01%、14.57%;而样本Q1和Q3的优势种群分别为Pseudarthrobacter、Nitrincola(21.51%),分别占13.93%、21.51%。
青海湖古菌优势类群为广古菌门(Euryarchaeota,40.96%)、未确定分类的沃斯古菌门(Woesearchaeota DHVEG-6,34.44%)以及奇古菌门(Thaumarchaeota,20.91%)。在纲分类水平上(图1-C),样本Q1和Q2中丰度最高的分别为Soil Crenarchaeotic Group(SCG,82.10%)和Woesearchaeota DHVEG-6 norank(84.73%);样本Q3和Q4中的Methanomicrobia丰度最高,分别占53.98%、72.98%。在属分类水平上(图1-D),样本Q1的优势种群为SCG norank(74.84%);样本Q2中的Woesearchaeota DHVEG-6 norank(84.73%)为绝对优势种群;样本Q3及Q4的优势种群为Methanosarcina(甲烷八叠球菌属)和Woesearchaeota DHVEG-6 norank,样本Q3以Woesearchaeota DHVEG-6 norank(35.64%)的丰度为最高,样本Q4以Methanosarcina(64.72%)的丰度为最高。
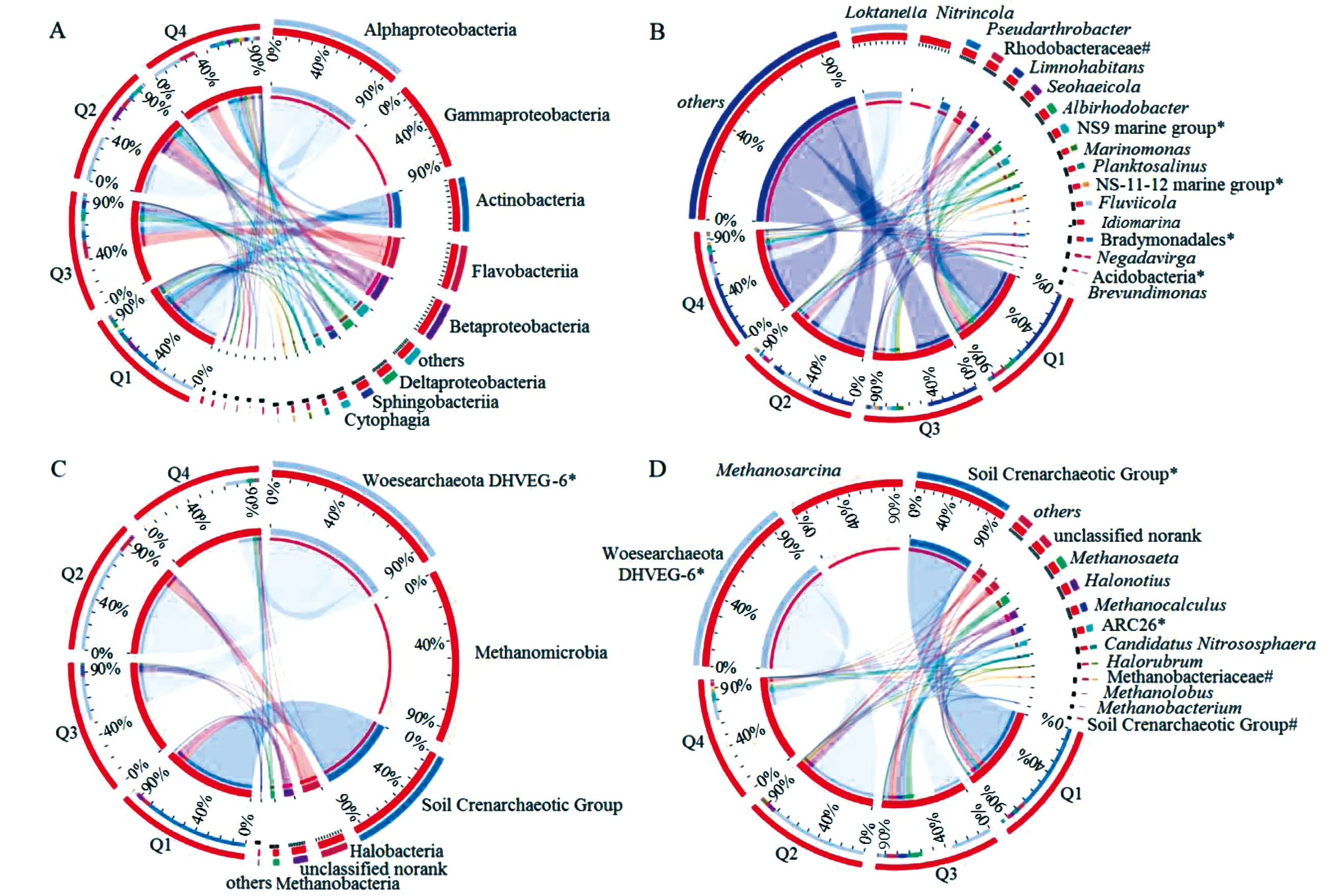
A、B、C、D分别为细菌纲、细菌属、古菌纲、古菌属;#为未确定分类菌属;*为未指定分类菌属
图1青海湖细菌和古菌群落组成结构图
Figure1Community structure of bacteria and archaea in Qinghai Lake
2.4 优势物种与湖泊环境因子相关性分析
对样本属分类水平的物种(丰度前50)进行监督式多元分析,并构建环境因子与物种间的Heatmap图(图2)。对细菌属水平的群落结构与环境因子的相关性(图2-A)分析结果显示:样本Q2和Q4的优势种群Loktanella的分布与TOC/pH(r=0.2,p=0.8)及TN(r=1,p=0)呈正相关;样本Q3的优势种群Nitrincola的分布与TN及CO32-、SO42-、Cl-、Ca2+、Mg2+、Na+、K+呈正相关(r=0.4,p=0.6);样本Q1的优势种群Rhodobacteraceae unclassified的分布与TOC及pH呈正相关(r=0.6,p=0.4)。此外,Roseibacterium和Hoeflea的分布与TN呈显著正相关(r=1,p=0)。
对古菌属水平的群落结构与环境因子的相关性(图2-B)分析结果显示:样本Q2和Q3的优势种群Woesearchaeota DHVEG-6 norank的分布与TOC/pH(r=0.4,p=0.6)及TN(r=0.8,p=0.2)呈正相关;样本Q3和Q4的优势种群Methanosarcina(r=1,p=0)、样本Q1的优势种群SCG norank(r=0.2,p=0.8)及样本Q3的优势种群Methanosaeta(甲烷丝菌属,r=0.8,p=0.2)的分布与TS呈正相关,Methanosaeta的分布还与CO32-、SO42-、Cl-、Ca2+、Mg2+、Na+、K+呈显著正相关(r=1,p=0)。相似性聚类分析结果显示:Halomicroarcula、Halorubellus和Haloarcula(盐盒菌属)等的分布与TOC和pH呈显著正相关(r=1,p=0);Methanocella、Methanomethylovorans和Methanobacterium(甲烷杆菌属)等的分布与TS呈显著正相关(r=1,p=0)。
2.5 共线性网络分析
通过Networkx软件对青海湖4个样本中的物种丰度信息进行相关性分析,获得物种在样本间的共存关系(图3)。细菌(属)共线性网络分析结果显示(图3-A):4个样本共有的种群数目为79个。Loktanella属为4个样本共有且占绝对优势,权重值为10654,其次为Pseudarthrobacter(3350)和Rhodobacteraceae unclassified(2892)。古菌(属)共线性网络结果显示(图3-B):4个样本共有的种群数目为25个。影响最大的种群为Woesearchaeota DHVEG-6 norank(权重值为38600),其次为Methanosarcina(26949)和SCG norank(21334)。
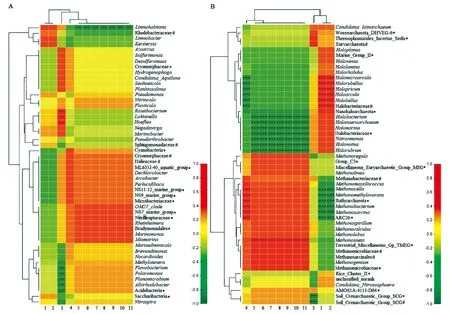
#为未确定分类菌属;*为未指定分类菌属;X轴编号1~11分别为TOC、pH、TN、TS、CO32-、SO42-、Cl-、Ca2+、Mg2+、Na+、K+;P若小于0.05则用*标出,*:0.01
Figure2Correlation between community structure of genus(A)and archaea(B)and environmental factors in Qinghai Lake

图3 青海湖细菌(A)和古菌(B)的共线性网络图Figure 3 Co-occurrence network of bacteria(A)and archaea(B)in Qinghai Lake
2.6 物种相关性网络分析
利用Cytoscape软件将青海湖细菌和古菌群落丰度前50的不同物种模块化,构建青海湖物种相关性网络图(图4)。结果显示:细菌物种相关性网络(图4-A)由44个节点、160条边及6个相互作用模块构成。44个节点隶属于类群Proteobacteria、Bacteroidetes、Actinobacteria、Saccharibacteria、Firmicutes与Acidobacteria(酸杆菌门),以Proteobacteria和Bacteroidetes所属种群居多。比较结果表明,模块Ⅰ、Ⅱ、Ⅲ、Ⅳ中的种群互作关系较为紧密。模块Ⅰ:Limnobacter与Kerstersia呈正相关;属群1[Cryomorphaceae unclassified、Perlucidibaca、ML635J-40 aquatic group norank、Dechlorobacter、Halieaceae unclassified、Arcobacter(弓形杆菌属)、Microbacteriaceae norank(微杆菌科)、NS9 marine group norank、NS11-12 marine group norank]彼此呈正相关;而Limnobacter和Kerstersia与属群1均呈负相关。模块Ⅱ:Saccharibacteria norank与属群2[Sulfurimonas、Azoarcus(固氮弓菌属)、Cryomorphaceae norank、Hydrogenophaga(噬氢菌属)、AquilunaCandidatus、Desulfuromusa、Planktosalinus、Seohaeicola]呈负相关;属群2彼此呈正相关。模块Ⅲ:Rhodobacteraceae unclassified与其余种群均呈负相关。模块Ⅳ:Hoeflea、Roseilbacterium、Loktanella种群间呈正相关,而与其余菌属均呈负相关。
古菌物种相关性网络(图4-B)由43个节点、122条边及10个相互作用模块构成。43个节点隶属于Eryarchaeota、Thaumachaeota、Bathyarchaeota、Diapherotrites、Miscellaneous Eryarchaeotic Group(MEG)和未分类属,以Eryarchaeota所属种群居多。相较其他模块而言,模块Ⅰ、Ⅱ中的种群互作关系最为紧密。模块Ⅰ中,Methanosarcina与属群3(Halapricum、Halobacteriaceae unclassified、Halomicroarcula、Halobellus、Halorubellus、Haloarcula)呈负相关,与属群4(Methanobacterium、Bathyarchaeota norank、ARC26 norank、Methanomethylovorans、Methanocella)呈正相关。属群3彼此间呈正相关,而与属群4均呈负相关。模块Ⅱ中,属群Halobacterium、Halanaeroarchaeum、Halorubrum(盐红菌属)、Natronomonas(嗜盐碱单胞菌属)、Halomarina、Halonotius、Halobacteriaceae norank间呈正相关,而与Methanosaeta均呈负相关。

#为未确定分类菌属;*为未指定分类菌属
3 讨论
咸水湖(或盐湖)环境中,存在着丰富的微生物群落。研究发现其细菌优势类群多为Firmicutes、Proteobacteria、Bacteroidetes、Actinobacteria、Verrucomicrobia[9,10]。因水质理化特征等不同,水体中群落组成又有所差异。已报道硫酸钠亚型盐湖,如山西运城盐湖[11]和内蒙古姆州诺尔盐湖[12]的优势类群为Proteobacteria、Firmicutes、Bacteroidetes。本研究中,青海湖细菌类群Proteobacteria(60.53%)占绝对优势,其次为Bacteroidetes(17.39%)、Actinobacteria(11.61%)和Firmicutes(2.56%),与同类型盐湖报道基本一致,仅丰度比例有所不同。青海湖优势种群与茶卡盐湖和小柴旦盐湖完全不同,后两者共有的优势种群为Bacillus(芽孢杆菌属)、Bacillus(海洋芽孢杆菌属)和Pseudomonas(假单胞菌属),而其优势菌属为Loktanella(11.84%)、Nitrincola(6.78%)和Pseudarthrobacter(3.72%),这可能与盐湖矿化度的不同致微生物群落结构组成存在差异有关。Loktanella作为青海湖第一优势菌属,属于革兰氏阴性菌,Trappen等[13]确定其分类学地位隶属于α-变形菌纲-红细杆菌目-红细杆菌科。截至目前,Loktanella共计有22个种分类,其属大多数种成员分离自淡水和海洋生态系统,如海水[14]、海底沉积物[15]及海洋生物膜[16]等。青海湖属咸水湖,其较低的矿化度可能与海洋系统的水环境化学特征具有一定的相似性,致使Loktanella菌属广泛存在。
嗜盐古菌是极端环境中的主要类群之一,诸多研究表明咸水湖(盐湖)中古菌优势类群为Euryarchaeota、Thaumarchaeota、Crenarchaeota(泉古菌门)和Nanohaloarchaeota(纳古菌门)[17-20];优势种群以Natronomonas、Halorubrum、Haloarcula、Haloplanus(盐盘菌属)、Halorhabdus(盐棍菌属)和Halobacterium为主[21-23]。本研究中,青海湖古菌类群除聚集于Euryarchaeota(40.96%)、Thaumarchaeota(20.91%)外,且存在大量未确定分类的沃斯古菌门Woesearchaeota DHVEG-6(34.44%);优势种群为Woesearchaeota DHVEG-6 norank(34.44%)、Methanosarcina(24.05%)、SCG norank(19.04%),与已报道的优势种群完全不一致。青海湖优势类群沃斯菌门Woesearchaeota隶属于DPANN(Diapherotrites,Parvarchaeota,Aenigmarchaeota,Nanohaloarchaeota,Nanoarchaeota)类群,具有高度的多样性,尚无纯培养菌株。经系统发育树分析表明,Woesearchaeota有26个潜在的亚群[24],这些亚群主要分布在内陆缺氧环境中[25-27]。青海湖的特殊地理特征(高原低氧环境)可能为Woesearchaeota的高丰度存在提供有利条件。
研究表明,湖泊微生物群落组成及物种多样性与温度、光照强度、酸碱度及盐度等多种环境因子有关[28,29],其中盐度或矿化度认为是影响群落结构的主要因素。Oueriaghli等[30]对西班牙东南部高盐环境Rambla Salada进行研究,发现盐度和氧气是细菌群落的主要环境影响因素;Bryanskaya等[31]研究新西伯利亚地区盐湖微生物多样性时发现,盐度是影响群落结构的主要因素但不是唯一因素。本研究中,青海湖细菌优势种群Loktanella及Nitrincola的分布主要与TN呈正相关,古菌优势种群Methanosarcina、SCG norank及Methanosaeta的分布主要与TS及离子浓度(CO32-、SO42-、Cl-、Ca2+、Mg2+、Na+、K+)呈正相关。对比分析发现,细菌群落与盐度呈正相关的物种居多。古菌群落中,产甲烷古菌(如Methanobacterium)的分布多与TS及离子浓度呈正相关,盐杆菌目属成员(如Halapricum)的分布多与TOC及pH呈正相关。在不同的盐环境中,影响微生物群落的环境因素有所差异,这可能与属群的代谢形式和生存机制有关。
近年来,关于咸水湖(盐湖)的研究多侧重于分析其微生物群落组成以及与环境因子的关系,网络分析尚未广泛应用于探索复杂群落中微生物类群之间的共生模式。目前,有关淡水湖[32,33]中物种相关性的报道较多,涉及咸水湖的较少。本研究中,共线性网络显示:细菌属Loktanella和古菌属Woesearchaeota DHVEG-6 norank共存于4个样本中且丰度最高,推测为青海湖绝对优势种群。物种相关性网络显示:细菌和古菌连接节点最多的分别是其模块Ⅰ中Limnobacter、Kerstersia及Perlucidibaca等11个属和Methanosarcina、Halapricum及Halomicroarcula等12个属,认为是青海湖关键属。研究表明,通过网络中微生物间的相互作用可以推测[34-36],处于互利共生关系的微生物呈正相关关系[37],而处于竞争关系的微生物呈负相关关系[38]。因此,青海湖细菌核心类群Proteobacteria(如Arcobacter)、Bacteroidetes(如NS9 marine group norank)和Actinobacteria(如Microbacteriaceae norank)多以互利共生关系存在。在古菌核心类群Euryarchaeota中,同甲烷代谢相关的甲烷微菌纲Methanomicrobia(如Methanosarcina)、甲烷杆菌纲Methanobacteria(如Methanobacterium)与嗜盐古菌的盐杆菌纲(如Halapricum)以竞争关系存在,而盐杆菌纲属成员及甲烷代谢相关菌属的内部彼此呈共生关系。产甲烷菌属与盐杆菌纲属成员通过何种方式相互影响,有待后续研究阐明。

