B2O3-SiO2-Na2O缓释材料的合成工艺参数优化及其缓释机理
黄长兴, 崔骏, 裴元生
B2O3-SiO2-Na2O缓释材料的合成工艺参数优化及其缓释机理
黄长兴, 崔骏, 裴元生
(北京师范大学 环境学院, 教育部水沙科学重点实验室, 北京 100875)
为优化工艺参数、减少原料损失和控制生产成本, 本研究采用单因素法研究不同升温速率、保温时间、熔制温度和起始温度对硼酸盐缓释材料(BCRM)在制备过程中B2O3挥发量和气泡生成情况的影响规律。运用X射线衍射分析、红外光谱和X射线光电子能谱仪表征缓释前后BCRM理化性质变化, 通过Korsmeyer-Peppas模型分析BCRM缓释机理。结果表明, 在起始温度1050 ℃、保温时间2 h和熔制温度1050 ℃的最优工艺参数下, B2O3挥发量可降低至1.08%, BCRM澄清透明, 无气泡生成, 缓释性能良好。此外, 温度会影响BCRM的缓释机理, 在30和35 ℃时, 释放机理为Super Case II转运; 在40 ℃时, 释放机制为non-Fickian扩散。但在不同温度下, 硼累积释放率均高于95%。
硼酸盐; 工艺参数优化; B2O3挥发; 缓释机理
硼酸盐材料具有化学稳定性易调节、熔制温度较低、水溶性和生物相容性良好等特点, 已引起医学和材料科学研究人员的广泛关注[1-2]。具有控制释放特性的硼酸盐生物玻璃, 在骨和软组织工程领域有较高的应用价值[3]; 硼酸锌和硼砂具有防治白蚁的功能[4]。硼酸盐材料在缓释、杀虫等方面的应用, 为其在工业水处理领域的应用提供了新的研究思路。
B2O3与SiO2、Na2O等物质共熔形成硼酸盐玻璃, 在水溶液中可缓慢溶出硼活性物质, 其缓释速率可调, 可制成性能优异的缓释型固体材料[5-6]。一般B2O3-SiO2-Na2O体系的硼酸盐缓释材料具有缓释、抑菌、缓蚀等特点, 在循环冷却水处理领域有着较大的潜在应用价值[7-9]。该体系的有效成分是B2O3, 在制备过程中, B2O3易挥发, 会造成原料损失、炉窑遭侵蚀、炉窑寿命缩短等问题, 使生产成本升高[10]。
目前关于B2O3挥发的机理和影响因素虽然已有探讨, 但这些探讨的体系中, B2O3的质量百分比都未超过20%[10-12], 更高含量的材料体系中B2O3挥发机理则尚未见报道。而其缓释特性和机理对缓释材料的设计和使用有着重要意义[13]。目前的研究多采用数学模型来拟合缓释材料的释放曲线, 以研究其缓释机理。虽然相关数学模型已有多种, 但均需根据不同缓释材料选取合适的模型[14-15]。
本研究制备了B2O3质量百分比高达60%的硼酸盐缓释材料(Borate Controlled-release Material, BCRM), 其挥发性、缓释机理以及选取何种数学模型均需深入探讨。因此, 本研究探讨了升温速率、保温时间、熔制温度和起始温度等工艺参数对BCRM中B2O3挥发的影响, 以优化合成工艺参数、节约原材料、控制生产成本。同时, 研究该材料的缓释机理, 为缓释速率的可预测性和可控性提供科学依据。
1 实验方法
1.1 材料合成
采用高温熔融法合成BCRM。根据配方(见表1)称取各原料, 在研钵中研磨混匀, 装入刚玉坩埚, 置于高温电炉(SX-G36123, 天津中环实验电炉有限公司)内熔制, 取出熔融状态的样品, 倒入耐高温模具中冷却成型。
1.2 硼含量的测定
称取5 g BCRM, 研磨至全部通过200目(74 μm)的筛子, 干燥保存。称取试样0.1000 g, 加入100 mL去离子水及1.5 g甘露醇于容量瓶中, 摇匀, 定容至200 mL, 转移至锥形瓶中, 取样, 用电感耦合等离子体原子发射光谱仪(ICP-AES, SPS8000, 北京海光仪器有限公司)测定硼含量。每个样品进行平行测定6次, 并按文献方法[16-17]测定回收率。
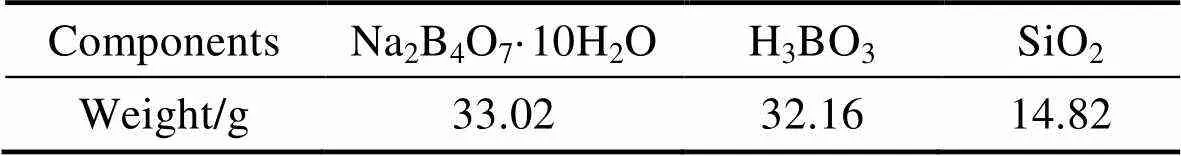
表1 BCRM的合成配方
1.3 工艺参数优化
(1)升温速率:熔制温度为1000 ℃, 保温时间为1 h,升温速率分别设定为4、6、8和10 ℃/min, 测定硼含量, 计算B2O3的挥发量, 优选出最佳的升温速率。
(2)保温时间:熔制温度为1000 ℃, 升温速率为优选的最佳条件, 保温时间分别设定为0.5、1、1.5和2 h, 测定硼含量, 计算B2O3的挥发量和使用光学显微镜(BX41, Olympus)观察BCRM中的气泡生成情况, 优选出最佳的保温时间。
(3)熔制温度:升温速率和保温时间均为优选的最佳条件, 熔制温度分别设定为1025、1050和1075 ℃,测定硼含量, 计算B2O3的挥发量和观察BCRM中的气泡生成情况, 优选出最佳的熔制温度。
(4)起始温度:升温速率、保温时间和熔制温度均为优选的最佳条件, 使用综合热分析仪(HCT, 北京恒久科学仪器厂)测试配合料的热重分析数据, 根据相关数据, 确定起始温度, 测定硼含量, 计算B2O3的挥发量, 优选出最佳的起始温度。
1.4 硼释放度的测定
选取质量和大小相同的BCRM, 放入装有1000 mL去离子水的锥形瓶中, 密封, 置于温度分别为30、35、40和45 ℃的水浴恒温箱中, 每隔1~3 d取样, 测定硼浓度, 计算硼的累积释放率。
1.5 缓释前后BCRM的表征
用多晶X射线衍射仪(XRD, χ’ pert pro MPD, 荷兰帕纳科)测定BCRM缓释前后的晶体结构, 扫描范围0~80°, 扫描速率2 (°)/min, 管电压40 kV, 管电流40 mA。用傅里叶红外光谱仪(FT-IR, NEXUS670, 美国东方科仪)分析BCRM缓释前后的内部基团结构变化, 摄谱范围为400~4000 cm–1, 分辨率为2 cm–1。用X射线光电子能谱仪(XPS, ESCALAB250Xi, 英国)分析BCRM缓释前后的表面元素及价态, X射线源为Al Kα, 功率为200 W。
1.6 缓释动力学方程拟合
通过Korsmeyer–Peppas模型对BCRM的释放曲线进行拟合, 分析其缓释机理[18]。

表2 Korsmeyer–Peppas模型中圆柱形聚合物缓释系统中扩散指数n值[18]
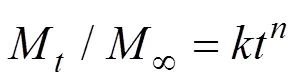
2 结果与讨论
2.1 工艺参数优化
各个工艺参数下各样品的测试及计算数据见表3。主要研究不同升温速率、保温时间、熔制温度和起始温度对BCRM中B2O3挥发的影响, 相对标准偏差(RSD < 2%)以及回收率表明实验数据准确可靠。不同保温时间和熔制温度下BCRM实物照片及其气泡生成状况如图1(a)和(b)所示。配合料的热重分析如图1(c)所示, 研究BCRM在熔制过程中的失重情况。从图1(c)可以看出, 熔制过程中有两个明显失重的阶段, 分别为300和800 ℃。为了减少硼的挥发, 在窑炉上升到一定温度时, 再将配合料放入窑炉中开始熔制, 目的是让配合料快速越过失重阶段, 减少挥发量[19]。因此, 起始温度分别设定为300、800和1050 ℃。
从表3可以看出, 随着升温速率增大, BCRM中的B2O3挥发量逐渐增大。这是因为配合料的主要成分为Na2B4O7·10H2O和H3BO3, 导致配合料含水量很高, 升温过程伴随着脱水, 升温速率增大, 脱水过程加速, 水蒸气压强增大, 导致B2O3的挥发量增加[12,20]。因此, 升温速率确定为4 ℃/min。
随着保温时间增加, BCRM中的B2O3挥发量逐渐增大, 并且1.5和2 h的挥发量相差很小, 这是因为随着保温时间的延长, B2O3在不断地挥发, 但是此时的配合料已经是液态, 并且1.5 h后玻璃液也逐渐变得澄清和均匀, B2O3的挥发速率变得很慢, 因此1.5和2 h的B2O3挥发量相差很小。同时气泡会影响产品质量, 有必要消除气泡[21], 从图1(a)可以看到, 随着保温时间的变长, BCRM中的气泡数量也越少。因此, 保温时间确定为2 h。
随着熔制温度升高, BCRM中的B2O3挥发量逐渐增大。从图1(b)可以看出, 熔制温度为1025 ℃时, BCRM中有个别气泡出现, 当熔制温度分别上升到1050和1075 ℃时, 气泡消失。这是因为随着熔制温度升高, B2O3的挥发增加, 同时温度会影响玻璃液的黏度, 进而影响气泡逸出, 温度越高, 玻璃液黏度越低, 气泡也越容易逸出[22]。由于温度过高, 会带来能耗增加和原料损失的问题, 因此, 熔制温度确定为1050 ℃。
随着起始温度的升高, BCRM中的B2O3挥发量逐渐减小。这是因为随着起始温度的升高, 更快地越过失重阶段, 配合料转变成玻璃液的时间也越短, B2O3的挥发量也越小。因此, 起始温度确定为1050 ℃。

表3 各个工艺条件下各样品的测试及计算数据
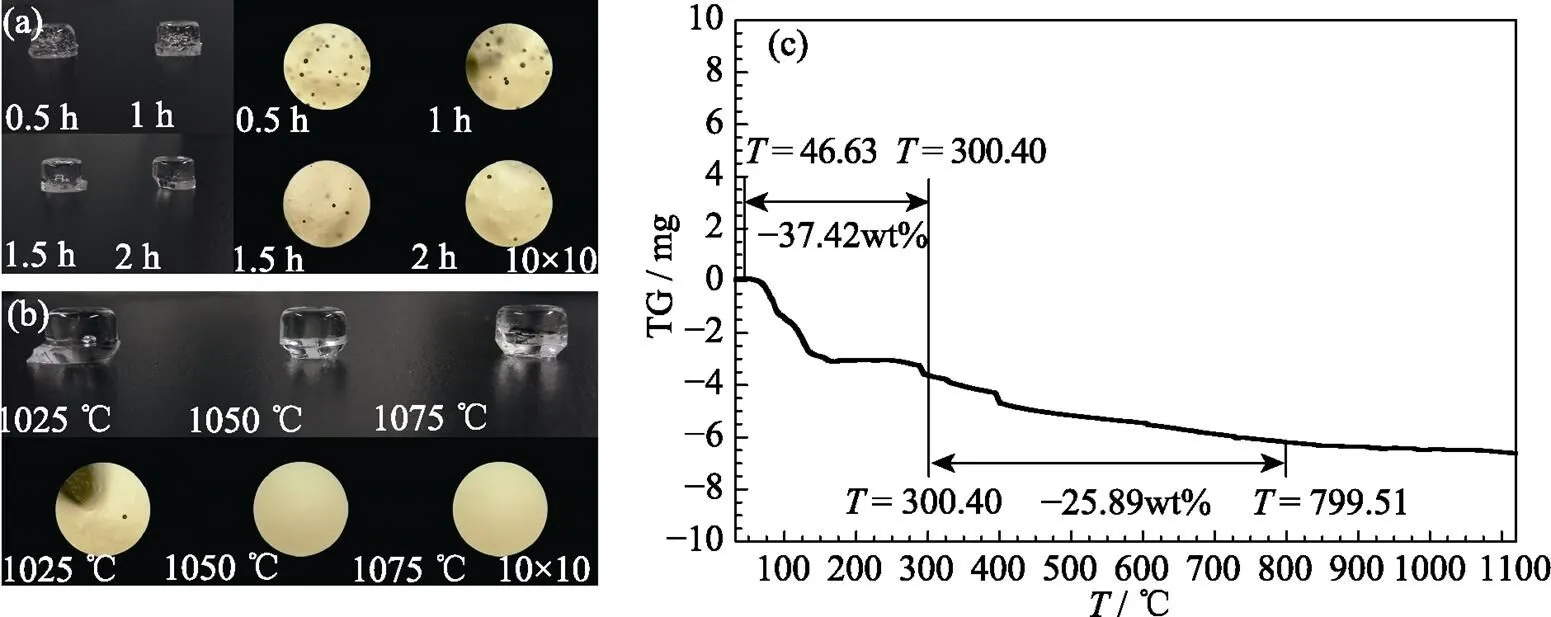
图1 (a)不同保温时间和(b)熔制温度下BCRM实物照片与气泡生成状况及(c)配合料的热重分析
2.2 缓释性能
2.2.1 释放曲线
不同温度下BCRM在去离子水中的硼累积释放浓度和硼累积释放率如图2所示。从图2(a)可以看出, 在30、35、40和45 ℃的条件下, BCRM的缓释天数分别是18、13、10和5 d, 其中缓释天数由硼累积释放浓度达到平衡的时间决定。质量和大小相同的样品在水溶液中的硼最终累积释放浓度几乎相同, 可以得知工艺优化后的BCRM成分均匀, 质量稳定。从图2(b)可以看出, 随着温度的升高, BCRM的缓释速率加快, 硼的累积释放率超过95%, 几乎全部释放到水溶液当中。这是因为合成的BCRM易溶于水, 且温度的升高, 加剧了网络结构的破坏, 加速了硼的溶出[23-24]。
2.2.2 缓释前后BCRM的结构变化
缓释前后BCRM的XRD图谱(图3(a))显示, 缓释前后, 峰形均为弥散峰, 没有明显的衍射峰出现, 说明缓释前的BCRM和缓释后的残渣均为非晶结构, B2O3与SiO2共同构成玻璃态的网络结构。缓释前的BCRM出现两个弥散峰, 而缓释后的残渣只有一个弥散峰, 并且强度增强, 这可能是因为含硼组分从网络结构中溶出, 残渣成分的非晶相组分发生变化的原因[25-26]。
缓释前后BCRM的红外光谱(图3(b))显示, 缓释前, 在400~4000 cm–1的范围内有6处较为明显的特征吸收峰, 而缓释后, 为5处特征吸收峰, 且峰的位置发生明显变化(表4), 表明BCRM缓释前后的组分和结构出现变化。缓释前, BCRM中的B2O3含量很高, 硼酸盐网络结构的特征峰数量多且明显。694.02、1268.39、1392.97 cm–1均为硼氧三角体[BO3]的振动峰[27-30], 表明BCRM的网络结构比较松散, 易溶于水, 具有潜在的缓释性能[23]。缓释后, 硼酸盐网络结构的特征峰消失, 硅酸盐网络结构的特征峰数量增多, 表明BCRM中的硼活性物质均已释放出来, BCRM缓释出硼的性能良好。
缓释前后BCRM的XPS图谱(图3(c)和(d))显示, 缓释前, 在BCRM的图谱中出现Si2p、Si2s、B1s和C1s峰。缓释后, 在残渣的图谱中出现Si2p、Si2s峰增强, B1s峰消失和C1s峰减弱的现象。由于BCRM是在耐高温的石墨模具中快速冷却成型, 导致在BCRM表面有少量的C存在。在BCRM缓释后,表面附着的C随着BCRM的缓释逐渐脱落, 导致C1s峰强度明显降低。Si2p、Si2s峰强度升高以及B1s峰消失是因为在缓释过程中, BCRM的主要释放成分为硼酸盐和少量的硅酸盐, 导致残渣的主要成分为具有不溶性质的硅酸盐, 同时也表明硼酸盐组分从网络结构中几乎全部溶出, 残渣成分为硅酸盐组分。

图2 不同温度下BCRM在去离子水中的(a)硼累积释放浓度和(b)硼累积释放率

图3 缓释前后BCRM的(a) X射线衍射图、(b)红外光谱图和(c~d) XPS图
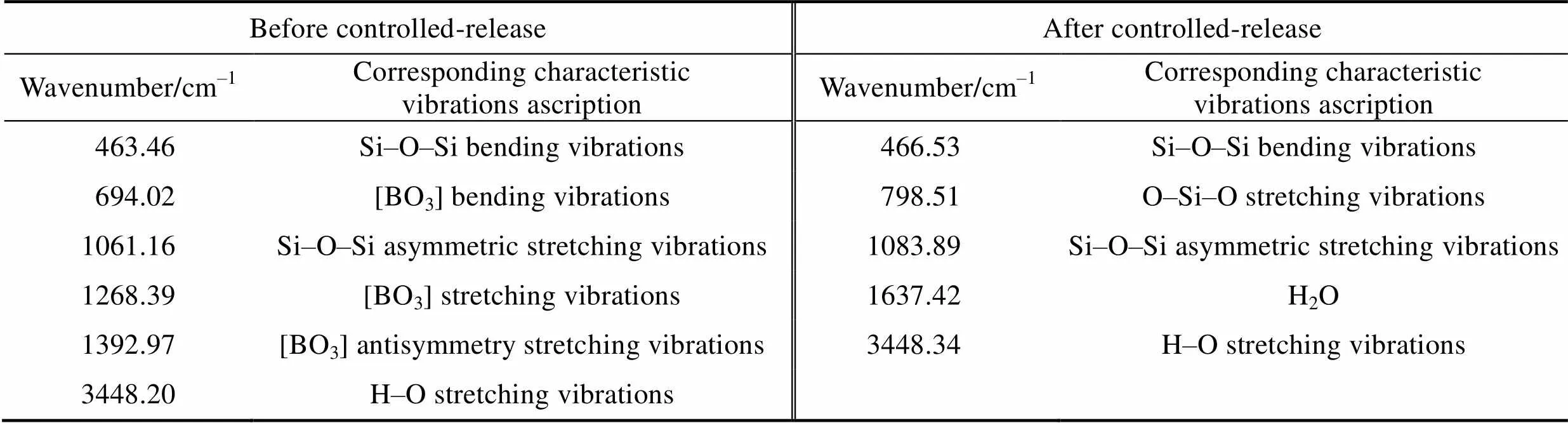
表4 缓释前后BCRM各基团的红外吸收光谱特征振动
2.2.3 缓释机理
不同温度下BCRM的释放动力学拟合结果见表5。通过Korsmeyer-Peppas模型对BCRM的释放动力学进行拟合, 分析其缓释机理。虽然Korsmeyer-Peppas模型是基于聚合物–水溶性药物缓释系统研究获得的, 但是也适用于骨水泥类药物缓释系统[31]。本实验中的BCRM为圆柱形, 根据表2和表5可以得到, 30和35 ℃的条件下,> 0.89(分别为0.97和0.95), 为Super Case II转运, BCRM的缓释可能是玻璃网络结构扩散、弛豫与玻璃溶蚀等协同作用的结果[32-33]。40 ℃的条件下, 0.45 << 0.89(为0.77), 为non-Fickian扩散, BCRM的缓释可能是玻璃网络结构扩散和溶胀的结果[34-35]。由此可知温度会影响BCRM的缓释机理, 因为该材料可能是由[BO4]四面体、[BO3]三角体和[SiO4]四面体三种结构构成, 温度上升后, BCRM的网络结构断裂方式改变, 硼的释放机制也发生变化。

表5 不同温度下BCRM的释放动力学拟合结果
3 结论
在起始温度1050 ℃、保温时间2 h和熔制温度1050 ℃的最优工艺参数下, B2O3的挥发量可降低至1.08%, 实现减少原料损失, 提高经济效益的目的。温度会影响BCRM的缓释机理。30和35 ℃时, 释放机制为Super Case II转运, BCRM的缓释是玻璃网络结构扩散、弛豫与玻璃溶蚀等协同作用的结果。40 ℃时, 释放机制为non-Fickian扩散, BCRM的缓释是玻璃网络结构扩散和溶胀的结果。
[1] BENGISU M. Borate glasses for scientific and industrial applications: a review., 2016, 51(5): 2199– 2242.
[2] YIN HAI-RONG, YANG CHEN, GAO YANG,. Fabrication and characterization of strontium-doped borate-based bioactive glass scaffolds for bone tissue engineering., 2018, 743: 564–569.
[3] BALASUBRAMANIAN P, BÜTTNER T, MIGUEZ PACHECO V,. Boron-containing bioactive glasses in bone and soft tissue engineering., 2018, 38(3): 855–869.
[4] LÓPEZ-NARANJO E J, ALZATE-GAVIRIA L M, HERNÁNDEZ- ZÁRATE G,. Termite resistance of wood-plastic composites treated with zinc borate and borax., 2014, 29(2): 281–293.
[5] RAHIMNEJAD YAZDI A, TOWLER M. The effect of the addition of gallium on the structure of zinc borate glass with controlled gallium ion release., 2016, 92: 1018–1027.
[6] ZHANG XING, JIA WEI-TAO, GU YI-FEI,. Borate bioglass based drug delivery of teicoplanin for treating osteomyelitis., 2010, 25(3): 293–298.
[7] CUI JUN, YUAN WEN-JIAO, YUAN DONG-HAI,. Effect of pH on the passivation of carbon steel by sodium borosilicate controlled-release inhibitor in simulated recirculating cooling water., 2017, 56(25): 7239–7252.
[8] SHI RUI-RUI, LI MENG, PEI YUAN-SHENG. Synthesis and characterizations of B2O3-SiO2-Na2O controlled-release antibacterial agent., 2017, 32(5): 529–534.
[9] CUI JUN, YANG YAN-GE, LI XIU-QING,. Toward a slow-release borate inhibitor to control mild steel corrosion in simulated recirculating water., 2018, 10(4): 4183–4197.
[10] LIU XIAO-QING, HE FENG, FANG YU,. Technical researches on volatilization reduction of B2O3in borosilicate glasses., 2013, 35(5): 13–17.
[11] QIAN DA-XING, ZHOU NAI, SUN DAO-BING,. Factors on volatilization of B2O3in glass melting., 1998(2): 93–96.
[12] SNYDER M J, MESKO M G, SHELBY J E. Volatilization of boron from E-glass melts., 2006, 352(6/7): 669–673.
[13] PEDRO R D O, PEREIRA S, GOYCOOLEA F M,. Self-aggregated nanoparticles of-dodecyl,¢-glycidyl(chitosan) as pH-responsive drug delivery systems for quercetin., 2018, 135(2): 45678.
[14] RUIZ-CARO R, GAGO-GUILLAN M, OTERO-ESPINAR F J,. Mucoadhesive tablets for controlled release of acyclovir., 2012, 60(10): 1249–1257.
[15] SINHA P, UBAIDULLA U, HASNAIN M S,. Alginate-okra gum blend beads of diclofenac sodium from aqueous template using ZnSO4as a cross-linker., 2015, 79: 555–563.
[16] XU XIAO-YUN, JIA DE-HUA, LIU JUN,. Determination of boron in silica refractory raw materials by ICP-OES., 2015(4): 29–31.
[17] KIM YOUNG-JAE, YANABA YUTAKA, MORITA KAZUKI. The effect of borate and silicate structure on thermal conductivity in the molten Na2O-B2O3-SiO2system., 2015, 415: 1–8.
[18] SITTA D L A, GUILHERME M R, DA SILVA E P,. Drug release mechanisms of chemically cross-linked albumin microparticles: effect of the matrix erosion., 2014, 122: 404–413.
[19] VARNER J R, SEWARD III T P, SCHAEFFER H A. Boron chemistry in flue gases from borosilicate glass furnaces., 2012, 387–395.
[20] VARNER J R, SEWARD III T P, SCHAEFFER H A. Effect of water in the melting atmosphere on the transformation temperature of commercial glasses., 2012, 345–354.
[21] BOLORÉ D, PIGEONNEAU F. Spatial distribution of nucleated bubbles in molten glasses undergoing coalescence and growth., 2018, 101(5): 1892– 1905.
[22] KRAXNER J, KLEMENT R, LIŠKA M. High-temperature viscosity and density of alumino-borosilicate glasses as a model system for commercial E-glass., 2008, 52(3): 148–154.
[23] GAO XIANG-LONG, ZHANG QIAN, YU JING-BO,. Effect of replacement of Al2O3by Y2O3on the structure and properties of alkali-free boro-aluminosilicate glass., 2018, 481: 98–102.
[24] FERREIRA E B, ZANOTTO E D, FELLER S,. Critical analysis of glass stability parameters and application to lithium borate glasses., 2011, 94(11): 3833–3841.
[25] MARCHAND B, LANIER S, DAVY C A,. Are calcium silicate hydrates (C-S-H) present in alkali-activated glass cullet cement?, 2018, 219: 104–108.
[26] NING JIA, YAO AI-HUA, WANG DE-PING,. Synthesis andbioactivity of a borate-based bioglass., 2007, 61(30): 5223–5226.
[27] HUANG YUN-YUN, ZHANG YI-JUN, LIN SAI,. Sol-Gel synthesis of NiO nanoparticles doped sodium borosilicate glass with third-order nonlinear optical properties., 2016, 686: 564–570.
[28] HAN JUAN, HE FENG, MEI SHU-XIA,. Effect of Na2O/B2O3on structure and properties of borosilicate glass., 2015, 37(3): 1–4.
[29] OTHMAN H A, ELTABEY M M, IBRAHIM S E,. Synthesis, electrical and magnetic properties of sodium borosilicate glasses containing Co-ferrites nanoparticles., 2017, 506: 115–121.
[30] HASSAAN M Y, OSMAN H M, HASSAN H H,. Optical and electrical studies of borosilicate glass containing vanadium and cobalt ions for smart windows applications., 2017, 43(2): 1795–1801.
[31] ROHNKE M, PFITZENREUTER S, MOGWITZ B,. Strontium release from Sr2+-loaded bone cements and dispersion in healthy and osteoporotic rat bone., 2017, 262: 159–169.
[32] BARBOSA J, CORREIA D M, GONÇALVES R,. Magnetically controlled drug release system through magnetomechanical actuation., 2016, 5(23): 3027–3034.
[33] SONAWANE S J, KALHAPURE R S, RAMBHAROSE S,. Ultra-small lipid-dendrimer hybrid nanoparticles as a promising strategy for antibiotic delivery:and in silico studies., 2016, 504(1/2): 1–10.
[34] FAYYAZBAKHSH F, SOLATI-HASHJIN M, KESHTKAR A,. Release behavior and signaling effect of vitamin D3 in layered double hydroxides-hydroxyapatite/gelatin bone tissue engineering scaffold: anevaluation., 2017, 158: 697–708.
[35] JIN XIAO-QI, WANG QIAN, SUN JI-HONG,. Dual (pH- and temperature-) stimuli responsive nanocarrier with bimodal mesoporous silica nanoparticles core and copolymer shell for controlled ibuprofen-releasing: fractal feature and diffusion mechanism., 2017, 254: 77–85.
B2O3-SiO2-Na2O Controlled-release Material: Synthetic Parameters Optimization and Release Mechanisms Exploration
HUANG Chang-Xing, CUI Jun, PEI Yuan-Sheng
(Key Laboratory of Water and Sediment Sciences, School of Environment, Beijing Normal University, Beijing 100875, China)
Aiming at optimization of synthetic process, reduction of raw materials loss and control of production cost, the single factor method was used to study the effects of different heating rate, holding time, melting temperature, and initial temperature on the B2O3volatilization and bubble formation during the preparation of borate controlled- release material (BCRM). The physicochemical properties of BCRM before and after controlled-release were characterized by X-ray diffraction analysis, infrared spectroscopy and X-ray photoelectron spectroscopy, and the release mechanism of BCRM was analyzed by Korsmeyer-Peppas model. The results show that the amount of B2O3volatilization can be reduced to 1.08%, no bubble forms in the transparent BCRM, and controlled-release performance is acceptable under optimum conditions of initial temperature 1050 ℃, holding time 2 h and melting temperature 1050 ℃. Controlled-release mechanism of BCRM, affected by temperature, is Super Case II transport at 30and 35 ℃ while it is non-Fickian diffusion at 40 ℃. However, the cumulative release rate of boron is greater than 95% at different temperatures.
borate; process parameter optimization; volatilization volume; release mechanism
TB321
A
1000-324X(2019)06-0653-07
10.15541/jim20180359
2018-08-02;
2018-10-10
国家自然科学基金(51579009); 北京市科技计划项目(Z181100005518005) National Natural Science Foundation of China (51579009); Beijing Municipal Science and Technology Plan Projects
(Z181100005518005)
黄长兴(1994–), 男, 硕士研究生. E-mail: 201621180072@mail.bnu.edu.cn
裴元生, 教授. E-mail: yspei@bnu.edu.cn

