ADAM12在原发性肝癌侵袭性中的作用及机制研究
张杨,杨琰,张翌,曹钧
(1.中国人民解放军中部战区总医院普通外科,湖北 武汉430070;2.湖北省妇幼保健院儿童血液科,湖北 武汉430070)
如何抑制肝细胞癌(hepatocellular carcinoma,HCC)的复发一直是国内外研究的热点[1]。目前已证实上皮-间充质转化(epithelial-mesenchymal transition,EMT)是一种重要的肿瘤侵袭转移机制,是指上皮细胞通过特定程序转化为具有间质细胞表型的生物学过程。研究表明,HCC可经EMT获得间质细胞特性,增强侵袭能力,发生远处转移[2]。因此,如何通过调控肝瘤细胞EMT抑制其侵袭近年来逐渐受到大家关注。
ADAM家族即去整合素-金属蛋白酶家族,是Ⅰ型跨膜糖蛋白,其作用是参与调节细胞之间和细胞与基质间的相互作用。有学者在中枢神经肿瘤中的研究表明,ADAM12可以通过调节E-cadherin促进肿瘤细胞侵袭[3]。另外,ADAM12可以参与膜铆钉蛋白活性功能区的释放,如肝素结合表皮生长因子(HB-EGF),从而调控细胞的增殖。Le Pabic等[4]于2003年首次证实ADAM12在肝癌组织中有表达,并且已证实与HCC的侵袭相关。但是,目前ADAM12与HCC侵袭转移的具体作用及其机制尚不明确,尤其是ADAM12是否通过调控HCC的EMT来调节其侵袭尚缺乏相关研究。本研究拟通过临床资料统计分析与细胞实验,探讨ADAM12与HCC肿瘤病理的关系,及其调控肝癌增殖、侵袭的具体机制。
资料与方法
一、病例与随访
2014年1月至2016年1月在本中心因原发性肝细胞癌行手术治疗的病例69例,收集病人的性别、年龄、肿瘤大小、TNM分期等信息,并随访至2017年12月31日。
二、免疫组织化学检测
病理组织标本包埋切片,脱蜡,高温修复抗原,3%H2O210 min,10%山羊血清室温封闭1 h;Ki67、ADAM12多克隆兔抗(proteintech,USA)4 ℃孵育过夜。用抗鼠/兔通用型免疫组化检测试剂盒(proteintech,USA)检测Ki67、ADAM12抗体结合情况并显色。苏木素复染,脱水处理,中性树脂封片。Ki67染色结果由两位病理科医生根据肝癌细胞阳性率进行评分:≤50%评判为Ki67低;>50%评判为Ki67高。ADAM12染色结果由两位病理科医生根据肝癌细胞阳性率进行评分:“+”(1%~24%),“++”(25%~49%),“+++”(50%~74%),“++++”(75%~100%)。
三、细胞培养
用含10%胎牛血清(life science,USA)和1%双抗的DMEM(gibeco,USA),于5% CO2的37 ℃孵箱中培养,培养HepG2、MHCC97H肝癌细胞系(细胞系均由中国人民解放军中部战区总医院肝胆外科实验室提供)。
四、慢病毒感染
构建ADAM12干扰LV10-ADAM12(human)和过表达LV8-ADAM12(human)慢病毒(吉凯基因,中国)。感染内接种适量细胞,感染时细胞融合度为50%~70%。感染时,更换新鲜培养基,每孔加1 ml培养基,并加入10 μl的慢病毒(病毒滴度:1×109TU/ml)。72 h后在荧光显微镜下观察细胞感染率,并用Western Blot检测ADAM12的表达改变。
五、细胞增殖实验
在96孔板中每孔接种1×103个细胞,每组设置3个复孔。将细胞刚好贴壁记为0 h,于24 h利用Cell Counting Kit-8(CCK-8;碧云天,China)检测细胞增殖;每孔加入10 μl CCK-8,在细胞培养箱中孵育1 h,然后用酶标仪测定在450 nm处的吸光度(A值)。
六、侵袭实验
Transwell小室(Millipore,USA)底部铺入50 μl Basement Membrane Matrix(Corning,USA,稀释=1∶2),细胞孵箱中2 h。收获细胞,制成每200 μl DMEM(GIBECO,USA)中含6×104个细胞悬液。Transwell上室加入200 μl DMEM细胞悬液,下室加入800 μl含10%胎牛血清DMEM,细胞培养箱中侵袭48 h后取出,多聚甲醛中固定,结晶紫中染色,PBS洗净,并用棉签轻轻擦拭Transwell小室上室底部。晾干后,将小室倒置于显微镜下观察并拍照,计算细胞数目。
七、Western Blot
于6孔板种植细胞,待细胞贴壁,融合度达到70%~90%时,加入RIPA裂解液(每孔加入150 μl RIPA),提取细胞蛋白;取组织标本10 mg,加入RIPA裂解液(严格按照说明书),提取组织蛋白;BCA法测定蛋白浓度。Western Blot具体步骤如前所述[5],一抗(GAPDH,1∶1 000;ADAM12,1∶1 000;E-cadherin,1∶1 000;N-cadherin,1∶1 000;Vimentin,1∶1 000;均购自Proteintech Group,USA),二抗(羊抗小鼠,1∶2 000;羊抗兔,1∶2 000,Proteintech Group),ECL反应,曝光机采集信号,GeneTools分析A值,目标蛋白A值与内参照GAPDHA值的比值为相对表达量。
八、统计方法
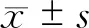
结 果
一、临床资料分析
本研究共收集了69例原发性肝癌病例,病理诊断确诊为HCC,年龄为(57.7±12.4)岁,男性53例(76.81%)。肿瘤大小为(5.7±3.5) cm,范围为0.4~11.3 cm。肝癌TNM分期、WHO肝细胞癌组织分化程度见表1。
二、ADAM12表达与HCC病理之间的关系
对69例原发性肝细胞癌病人的癌组织样本进行ADAM12免疫组织化学染色,根据ADAM12染色密度进行评分。其中,评分为0的14例(20.29%),8例(11.59%)为“+”,17例(24.64%)“++”,20例(28.99%)“+++”,10例(14.49%)“++++”。将评分为0和“+”的免疫组织化学结果定义为低表达,“++”~“++++”定义为高表达(图1)。结果表明,TNM分期越高,肿瘤分化程度越低,Ki67指数越高,ADAM12高表达的比例越大,差异有统计学意义(P<0.05)(表1,图2)。

表1 ADAM12表达与HCC临床病理之间的关系(例)
三、ADAM12表达与预后之间的关系
术后3年ADAM12低表达组病人复发9例(40.91%),而ADAM12高表达组病人复发34例(72.34%),差异有统计学意义(2=6.305;P=0.012),提示ADAM12高表达组肿瘤复发率明显升高。
四、ADAM12对肝癌细胞增殖、侵袭的影响
结果发现在HepG2肝癌细胞系中,抑制ADAM12的表达抑制了细胞增殖,而过表达ADAM12促进了细胞增殖,且差异有统计学意义(对照组:1.03±0.51;ADAM12沉默组:0.74±0.33;ADAM12过表达组:1.75±0.62;F=5.38,P=0.021)。在MHCC97H肝癌细胞系中亦发现了相似的结果(对照组:1.12±0.36;ADAM12沉默组:0.47±0.24;ADAM12过表达组:1.83±0.56;F=13.86,P=0.000)。上述结果表明,ADAM12促进了肝癌细胞增殖;抑制ADAM12,可以抑制肝癌细胞增殖。
同时,结果发现抑制ADAM12表达后,HepG2细胞穿膜细胞数明显少于对照组,而过表达ADAM12组,HepG2细胞穿膜细胞数明显多于对照组[对照组(144.0±22.8)个,ADAM12沉默组(97.0±25.1)个,ADAM12过表达组(193.0±22.4)个,F=20.93,P=0.000]。在MHCC97H细胞系中亦发现了相似的结果[对照组(127.0±21.6)个,ADAM12沉默组(95.0±22.0)个,ADAM12过表达组(175.0±23.7)个,F=16.08,P=0.000](图3)。上述实验结果表明,ADAM12促进了肝癌细胞侵袭;抑制ADAM12,可以减弱肝癌细胞侵袭。
五、ADAM12对肝癌细胞EMT的调控作用
在HepG2细胞系中,ADAM12沉默组,上皮标志物E-cadherin的表达明显高于对照组,而间质标志物N-cadherin和Vimentin的表达则低于对照组;反之,ADAM12过表达组,E-cadherin的表达低于对照组,而N-cadherin和Vimentin的表达则明显高于对照组,差异均具有统计学意义(P<0.05)(图4)。在MHCC97H细胞系中,亦发现了相似的结果(图4)。该结果提示,ADAM12促进肝癌细胞EMT,增强了癌细胞间质化。
讨 论
肝癌细胞的高侵袭能力是原发性肝癌预后差、死亡率高的重要原因之一。近年来,防治肝癌侵袭对改善病人预后的意义逐渐被多数学者认可,因此,探讨肝癌侵袭的机制是近年来研究热点[6]。研究表明,肝癌细胞EMT过程是其获得侵袭能力的关键,同时,EMT还影响到肝癌细胞的增殖与血管构建。目前认为,肝癌细胞经EMT获得间质细胞特性,侵袭能力增强。在恶性肿瘤中,EMT的相关机制与信号通路研究已较深入,其中ERK在EMT中发挥的关键作用亦被多数学者认可[7]。ADAM12作为ADAM家族的重要成员,在多种恶性肿瘤中的作用已得到广泛研究。但是关于ADAM12在HCC中的作用的研究却相对匮乏。我们的研究表明,ADAM12通过影响细胞蛋白骨架,尤其是间质标志物(N-cadherin、Vimentin)表达,促进肝癌细胞间质化,影响肝癌细胞增殖、侵袭能力[5,8]。通过抑制ADAM12,可以降低肝癌细胞增殖与侵袭。
ADAM12是去整合素-金属蛋白酶家族一员,可通过多种机制调控肿瘤侵袭。ADAM12胞外段的金属蛋白酶区可通过降解细胞外基质促进肿瘤细胞侵袭;ADAM12可以作用于IGFBP-3的底物,导致IGFBP-3水平下降,导致p53诱导的细胞凋亡下降;ADAM12还可水解HB-EGF,导致其释放活性外功能区(sHB-EGF)。sHB-EGF具有较强的致瘤能力和生血管效应,能够通过激活基质金属蛋白酶(MMPs)增强细胞侵袭能力,还能够作为表皮生长因子(EGFR)最主要的配体,促肿瘤细胞增殖[9-11]。由此可见,ADAM12可以通过多种机制调控肝癌的增殖与侵袭。

图1 肝癌组织中ADAM12免疫组织化学染色 A.分期Ⅰ期病人标本染色,ADAM12低表达,评分“+”;B.分期Ⅳ期病人标本染色,ADAM12高表达,评分“++++” 图2 肝癌组织中ADAM12检测 不同TNM分期ADAM12表达差异明显,TNM分期Ⅲ~Ⅳ期病人ADAM12表达明显高于Ⅰ~Ⅱ期 图3 沉默或过表达ADAM12后,HepG2、MHCC97H肝癌细胞侵袭能力改变 图4 E-cadherin、N-cadherin、Vimentin在HepG2、MHCC97H肝癌细胞系中表达变化
Le Pabic等于2003年首次证实ADAM12在肝癌组织中有表达,其他研究亦证实,ADAM12在HCC中表达丰度明显高于ADAM8、ADAM9等其他ADAMs家族成员[4,12]。因此,我们推测ADAM12与HCC侵袭相关性可能更大。研究表明,ADAM12表达越高,肝癌分化程度越低,分期晚,肿瘤越大,预后越差。通过探究ADAM12影响肝癌侵袭的机制发现,ADAM12可通过调控肌动蛋白骨架调控EMT。由于EMT的实质是细胞骨架重塑,其中肌动蛋白丝动态装配对维持细胞运动功能具有重要作用。而ADAM12可调控p53信号系统,进一步调节核转录因子NF-κB,调控EMT。通过检测EMT标志物E-cadherin、N-cadherin和Vimentin发现[13-14],ADAM12表达下调可诱发上皮标志物(E-cadherin)表达上调,而间质标志物(N-cadherin、Vimentin)表达下调;ADAM12表达上调时,间质标志物表达明显上调,但上皮标志物表达下调。这提示ADAM12可以促进肝癌细胞间质化,增强细胞运动能力。虽然本研究中初步探讨了ADAM12对肝癌细胞EMT的调控作用,但是ADAM12调控EMT的具体机制未深入探讨。ADAM12是通过增加p53活化影响EMT,还是直接作用于细胞骨架影响EMT仍待进一步探讨,这亦是本课题进一步的研究方向。
ADAM12通过调控肝癌细胞EMT,促进肝癌细胞增殖、侵袭。通过抑制ADAM12,可降低肝癌细胞增殖、侵袭能力,这可能为临床上治疗HCC提供新的思路。

