2013~2018年广西部分规模猪场主要病毒性腹泻疫病流行病学调查研究
何 颖,秦毅斌,段群棚,张艺杰,卢冰霞,胡庭俊,李晓玉,周英宁,周展宏,刘 磊,梁家幸,李 斌,蒋冬福,卢敬专,苏乾莲,刘 棋,赵 武
(1.广西大学动物科学技术学院,南宁 530005;2.广西兽医研究所,广西兽医生物技术重点实验室,南宁530001)
猪腹泻类疫病是造成仔猪大量死亡的重要原因之一,引发腹泻的原因众多,有营养性腹泻、病毒性腹泻、细菌性腹泻和寄生虫腹泻等,其中以病毒性腹泻造成的危害最为严重[1-3]。病毒性腹泻病常为一种或多种病毒单独或混合感染[4-5],传播迅速,临床表现为猪腹泻、呕吐、脱水和死亡等[1],耐过猪生长缓慢,饲料报酬率降低[6-9],给养猪业造成了巨大的经济损失。近年研究表明,引起猪病毒性腹泻的病原主要包括:猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪轮状病毒(Porcine rotavirus,PoRV)、猪传染性胃肠炎病毒(Transmissible gastroenteritis virus of swine,TGEV)和猪丁型冠状病毒(Porcine deltacoronavirus,PDCoV)等[2]。这4种病毒对各个年龄段的猪都易感,其中对哺乳和保育猪危害最大,病死率最高[7-9]。1978年PEDV首发于英国,2006年新型变异毒株在中国暴发流行[10-12],随后在亚洲、欧洲和美洲国家也相继暴发,迅速发展为全球性流行[12-15]。1945年Doyle和Hutching于美国首次报道TGEV发生,1956年中国广东省首次报道。近年来TGEV在欧洲和亚洲等国家广泛流行并呈不断上升趋势。Woode和Bridge1974年在英国首次报道发现PoRV,随后美国、法国和澳大利亚等国家相继报道检出PoRV。中国1982年首次从粪便中分离到PoRV[16-17]。PDCoV是近年来发现的一种与猪腹泻相关的冠状病毒科新成员,临床特征与PEDV和TGEV相似。自2012年在中国香港首次发现后,PDCoV已成为常见的猪腹泻病致病病原[18-21]。广西壮族自治区作为“十三五”规划的全国生猪重点发展产区之一,近年来在养猪业快速发展的同时,猪的传染病越来越复杂和多样化,腹泻类疫病已经成为困扰广西壮族自治区生猪养殖业发展的瓶颈因素之一[22-23]。为了进一步掌握广西壮族自治区规模猪场病毒性腹泻疫病的发生及流行趋势,本研究对2013年1月至2018年10月从广西壮族自治区14个地级市送检的1547份腹泻类疾病样本,运用RT-PCR方法进行PEDV、PoRV、TGEV和PDCoV 4种主要病毒性腹泻疫病病原检测,调查这4种病原的阳性率、混合感染情况,并分析其在不同季节、年份和地区的流行特点,为广西壮族自治区猪主要病毒性腹泻疫病的预防和控制提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 病料 2013年1月至2018年10月,采自广西壮族自治区14个地级市共1547份腹泻病料:南宁市(492份)、柳州市(83份)、桂林市(168份)、梧州市(20份)、北海市(82份)、防城港市(34份)、钦州市(38份)、贵港市(75份)、玉林市(250份)、百色市(100份)、贺州市(22份)、河池市(21份)、来宾市(88份)、崇左市(74份)。
1.1.2 主要试剂 DNA Marker DL2000、2×TaqPCR Master Mix、反转录试剂盒(PrimeScript RT reagent Kit)均为大连宝生物工程有限公司产品;病毒基因组DNA/RNA快速抽提试剂盒为Axygen 生物科技有限公司产品。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中公开发表的各病毒的基因序列,利用MegAlign(DNA Star),Primer Premier 7.0软件设计引物,引物均送至生工生物工程(上海)股份有限公司合成(表2)。
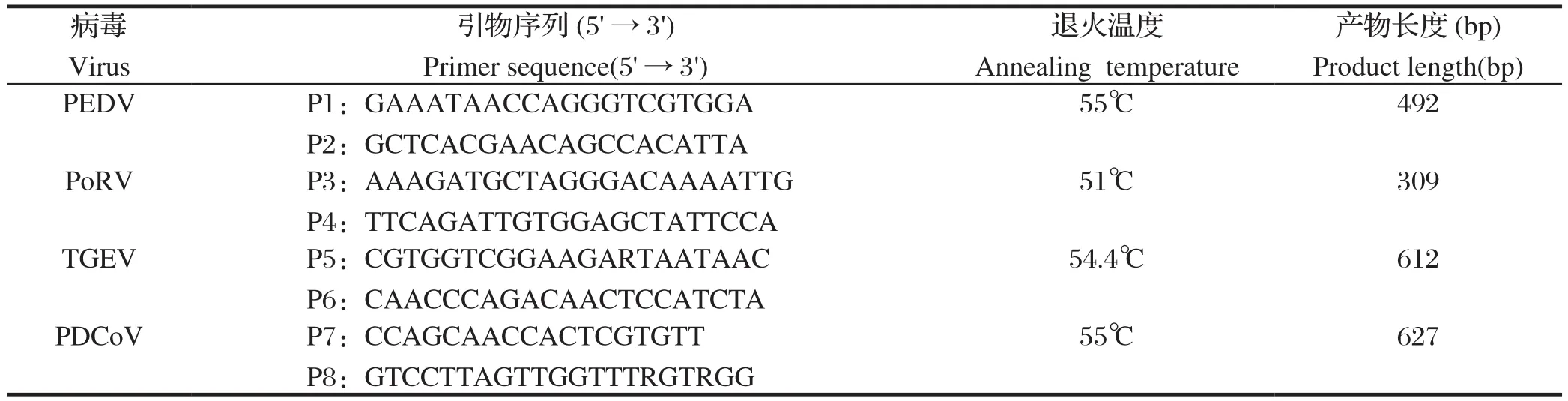
表2 引物序列Table 2 Primer sequence
1.2.2 病料处理及病毒DNA/RNA提取 取送检的腹泻猪的肠道和粪便等组织样品,按1∶5加入生理盐水,在组织研磨器内进行研磨,反复冻融3次,4℃、10 000 r/min离心5 min后取上清,进行DNA/RNA抽提或保存于-70℃冰箱备用。按照 AxyPrep Body Fluid Viral DNA/RNA Miniprep Kit使用说明书对样品上清进行DNA/RNA提取,所获得的DNA/RNA直接进行PCR/RT-PCR或置于-70℃保存。阳性对照由广西兽医生物技术重点实验室保存,阴性对照由ddH2O代替cDNA。
1.2.3 病毒目的基因片段扩增 利用特异性引物对样品RNA进行RT-PCR扩增,反转录体系(20 μL):RNA模板7 μL、5×Prime-ScriptTM缓冲液2 μL、RT enzyme mix0.5 μL、下游引物0.5 μL。反转录反应条件:42℃ 40min,反应产物-20℃保存备用。PCR扩增体系:2×Taq PCR Master Mix 12.5 μL,ddH2O 8.5 μL,上、下游引物各0.5 μL,反转录产物(cDNA)3.0 μL,总反应体系为25 μL。PEDV、PoRV、TGEV和PDCoV的PCR扩增反应条件见表3。PCR反应结束后取10 μL RT-PCR扩增产物进行琼脂糖凝胶电泳,凝胶成像系统上观察结果,并拍照。
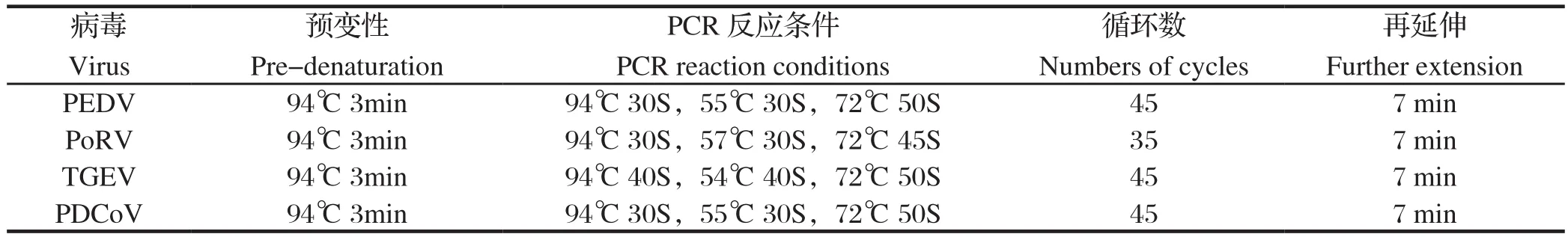
表3 PCR反应程序Table 3 PCR amplification program
1.2.4 数据处理与分析 2013年1月~2018年10月,利用本实验室建立的RT-PCR检测方法对采自广西南宁、柳州、桂林、梧州、北海、防城港、钦州、贵港、玉林、百色、贺州、河池、来宾和崇左等14个地级市的1547份腹泻类样品,分别进行PEDV、PoRV、TGEV和PDCoV病原检测,并分析这4种病毒在不同年份、不同地区和不同季节的感染情况。同一份样品只能检测到1种病原阳性的归为单一感染,同时检测到2种病原阳性的归为二重感染,同时检测到3种病原阳性的归为三重感染,依次类推。
2 结果
2.1 病毒RT-PCR、PCR结果RT-PCR产物电泳后,分别观察到492、309、612和627 bp处出现条带,与预期片段相符(图1)。
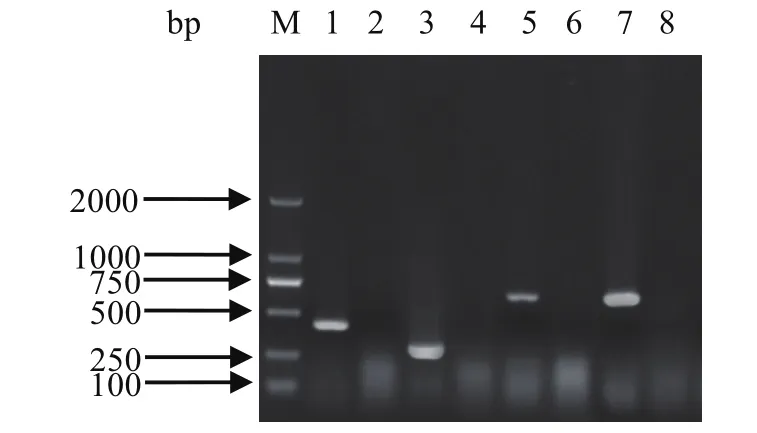
图1 4种病毒的RT-PCR或PCR电泳结果Fig. 1 RT-PCR or PCR result for PEDV, PRoV, PDCoV and TGEV
2.2 不同年份猪场送检腹泻样品中病毒检测结果分析2013~2018年,送检的规模猪场均存在PEDV、PoRV和PDCoV这3种病原不同程度的感染,样品平均阳性率为54.94%、4.40%和4.52%。2013年和2014年,送检腹泻样品中只检出PEDV,阳性率分别为66.67%和47.95%;2015年送检腹泻样品中检出PEDV和PoRV,阳性率分别为51.93%和11.60%;2016年送检腹泻样品中检出PEDV、PoRV和PDCoV,阳性率分别为73.06%、7.25%和6.74%;2017年送检腹泻样品中检出PEDV、PoRV和PDCoV,阳性率分别为50.97%、2.72%和6.42%;2018年送检腹泻样品中检出PEDV、PoRV和PDCoV,阳性率分别为39.29%、1.49%和3.27%。另外,2013~2018年送检腹泻样品中均未检出TGEV病原(表4)。
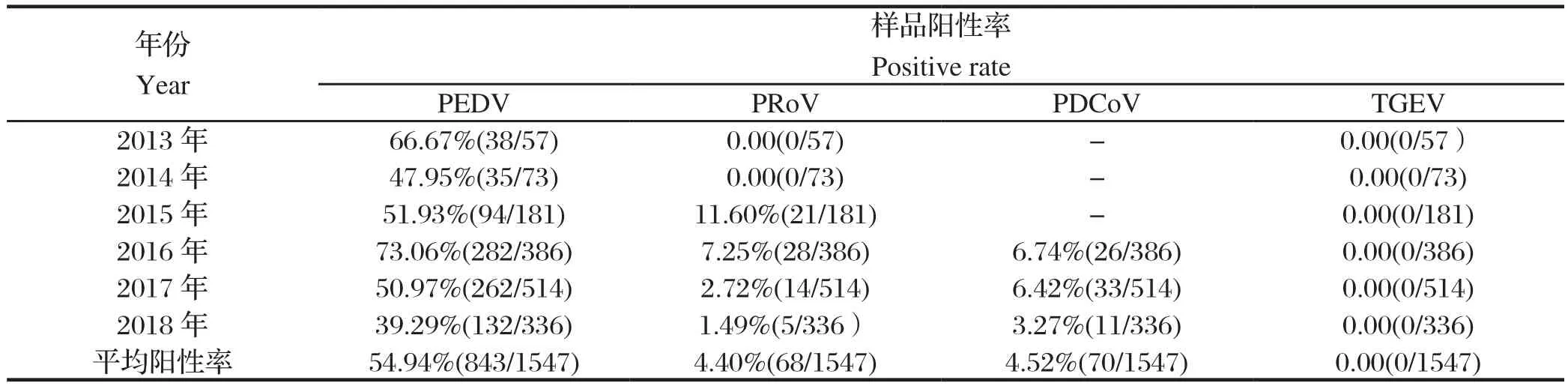
表4 2013~2018年猪场腹泻样品中病毒检测结果Table 4 Detection of PEDV, PRoV, PDCoV and TGEV in samples from pig farms during 2013-2018
2.3 猪场送检腹泻样品中病毒混合感染检测结果分析2013~2018年检测结果显示, PEDV单一感染率最高(55.27%),其次是PoRV(2.97%)、PDCoV(2.78%);同时混合感染中双重感染较为常见,以PEDV+PDCoV(1.10%)和PEDV+PoRV(1.10%)为主;三重感染较少,PEDV+PoRV+PDCoV仅在2016年检出5例,在2017年检出1例,而TGEV均未检出(表5)。
2.4 不同地区猪场送检腹泻样品中病毒检测结果分析2013~2018年,PEDV、PoRV和PDCoV感染在广西壮族自治区14个地级市的规模猪场中均有发生。样本中PEDV阳性率由高到低分别为:贵港、北海、玉林、百色、南宁、崇左、防城港、梧州、贺州、桂林、来宾、柳州和钦州市,河池市送检样本未检出;PoRV阳性率由高到低为:河池、桂林、柳州、南宁、防城港、崇左、贵港、北海、玉林、来宾和百色市,梧州、钦州、贺州市样本未检出;PDCoV阳性率由高到低为:北海、百色、南宁、钦州、桂林、贺州、柳州、玉林、崇左和贵港市,梧州、防城港、河池、来宾市送检样本中未检出;另外,所有样本中均未检出TGEV(表6)。
2.5 不同季度对4种病毒检测结果的影响结果显示,2013~2018年1547份广西规模猪场腹泻样本中,TGEV在各季节中均未检出;而PEDV、PoRV和PDCoV 3种病原在春季的样品阳性率分别为50.43%、5.34%和8.12%,在夏季的样品阳性率分别为45.19%、8.05%和1.56%,在秋季的样品阳性率分别为60.49%、3.41%和0.49%,在冬季的样品阳性率分别为63.19%、1.02%和5.11%(表7)。
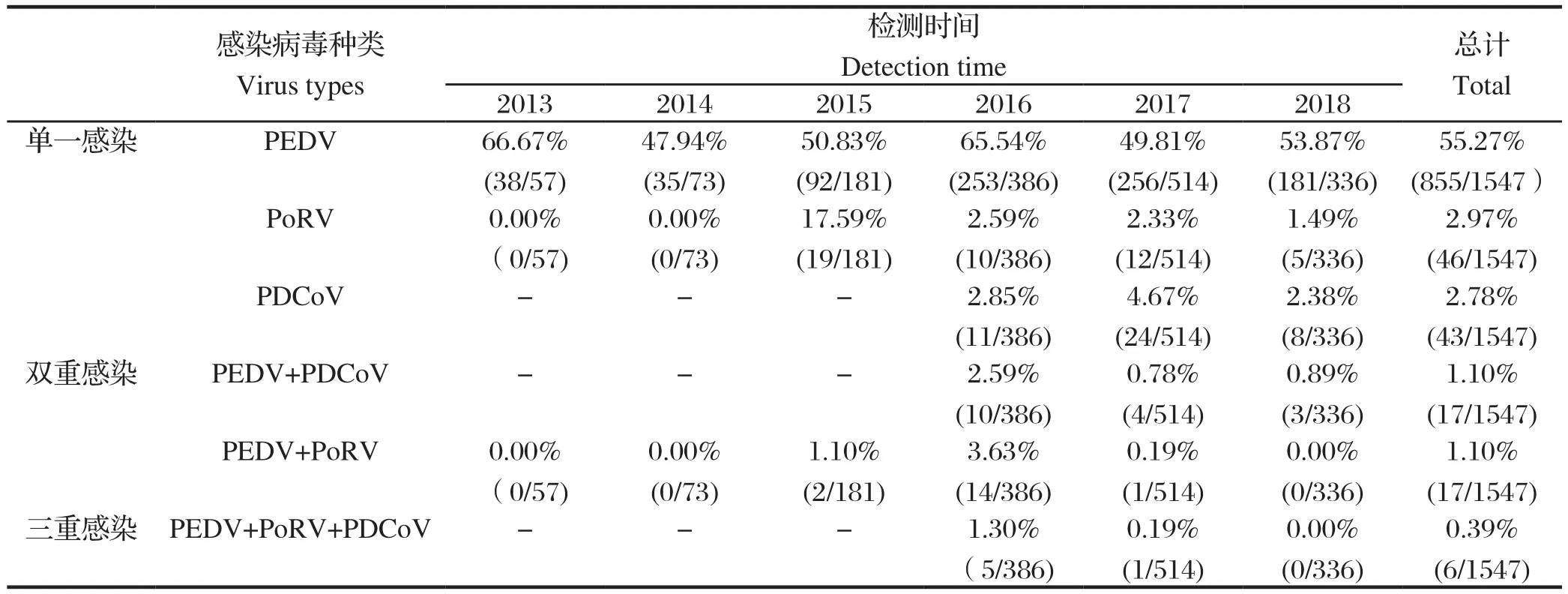
表5 2013~2018年猪场送检腹泻样品4种病毒混合感染情况Table 5 Mixed infection of PEDV, PRoV, PDCoV and TGEV in samples during 2013-2018

表6 2013~2018年广西14个地级市4种猪腹泻病毒检测结果Table 6 Detection of PEDV, PRoV, PDCoV and TGEV in samples from 14 areas of Guangxi during 2013-2018
3 讨论
猪腹泻是猪场常见病和多发病,其中病毒性腹泻主要由PEDV、PDCoV、PoRV和TGEV感染导致,临床症状和病理变化上极其相似,给临床诊断带来困难。本研究对2013~2018年广西14个地级市的规模猪场的腹泻类样本进行检测,发现PEDV、PoRV和PDCoV这3种病毒性腹泻疫病病原在广西不同地区猪场中均存在不同程度的感染,但并未检测到TGEV,其中PEDV的样品阳性率、地区阳性率和季节阳性率在13个地市阳性检出率均为最高,与其他生猪养殖大省如四川、山东和浙江等省所报道的规模猪场以PEDV腹泻为主的情况相同,表明广西猪流行性腹泻已形成持续感染的地方流行态势。2016年,曹恭貌等[20]对四川省部分地区的腹泻样品进行检测,其中PEDV阳性率为100.00%,TGEV为11.54%,PoRV为7.69%。有调查结果显示,山东省不同地区仔猪腹泻样品中PEDV、PoRV和TGEV的阳性率分别是34.9%、28.8%和2.2%[24-25]。徐丽华等[26]对浙江省部分地区的腹泻样本进行检测,其中PEDV阳性率为71.25%,TGEV为3.05%,PoRV为17.6%,PDCoV为8.75%。调查结果表明PEDV仍是国内引起规模猪场腹泻疫病的主要病原。
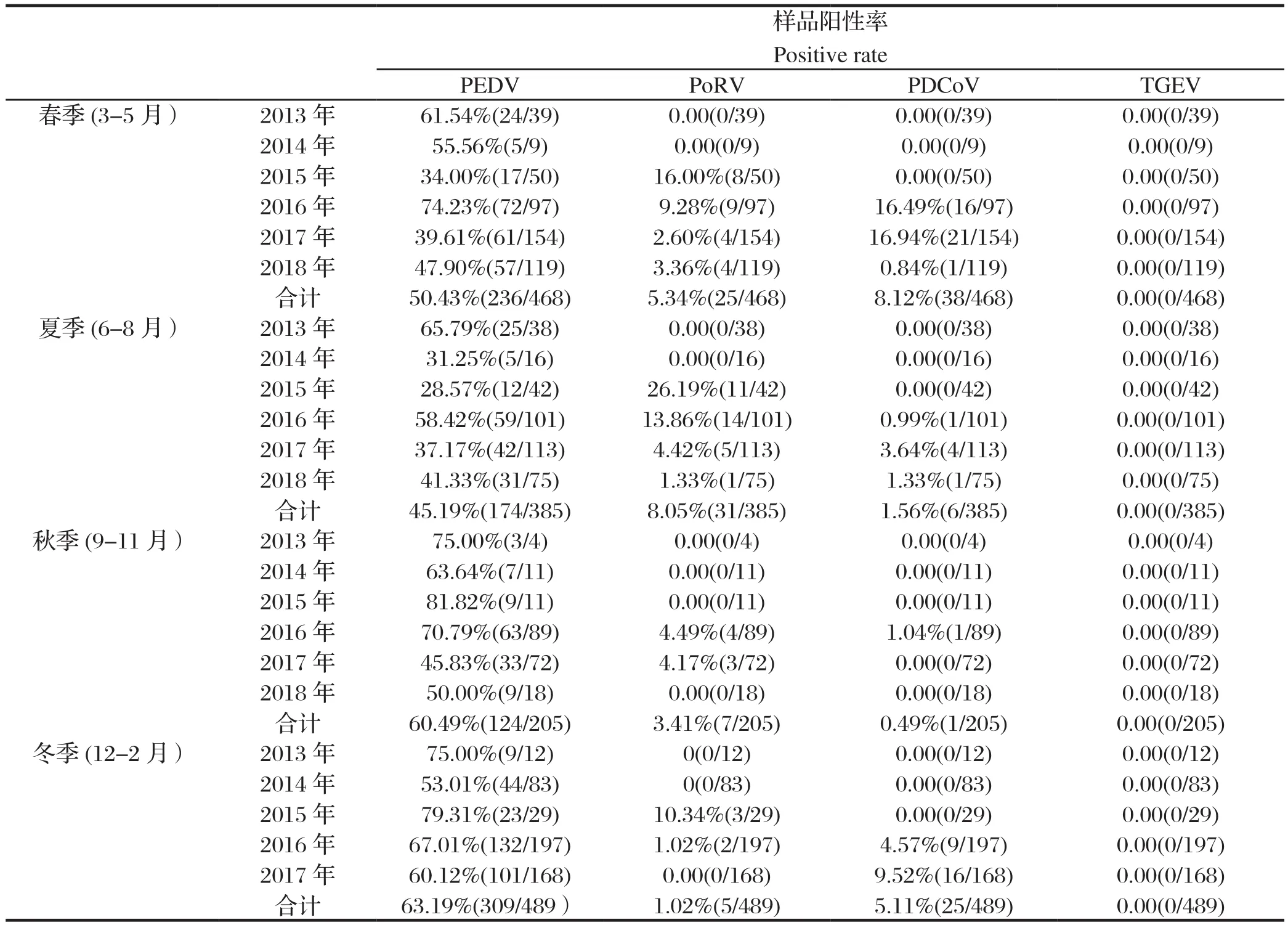
表7 不同季节猪场送捡腹泻样品中病毒检测结果Table 7 Detection of PEDV, PRoV, PDCoV and TGEV in samples in different seasons
通过比对PEDV的M基因序列发现,广西2013~2014年的流行毒株与广东、河北、武汉、安徽等省2010~2013年的流行毒株亲缘关系较近[27]。本研究中PEDV在广西南部和西南部靠近广东省的养殖密集区域的地区,如贵港、北海、玉林、百色、南宁和崇左等市为PEDV感染高发区。除单独感染外,PEDV还与PDCoV和PoRV存在不同程度的混合感染,其中双重感染较常见,以PEDV+PDCoV和PEDV+PoRV为主,三重感染PEDV+PoRV+PDCoV较少。说明广西PEDV、PDCoV和PoRV近年来发病率不断增长,可能与养殖密集区域生猪养殖量不断上升,及其造成的生猪流动如种猪引进、出售和商品猪区内及跨省调运等行为的增多呈正相关趋势。
PEDV表现为全年高发,在腹泻疾病中的平均发病率高于50%,其中秋冬季最高,检出率分别为60.49%、63.19%。同时PoRV和PDCoV春冬季感染率较高,并且PoRV主要感染的区域集中在河池、桂林和柳州市等广西北部地区,与这些病原的流行特点相吻合,说明寒冷季节更有利于PoRV和PDCoV的感染和传播[27]。另外,广西地处中国西南,属亚热带季风气候,夏秋季时间较长且高温多雨,气候潮湿[5]。冬季气候剧变,长时间持续低温阴雨天气,猪场防寒措施不足特别是哺乳仔猪的保暖不足,生物安全管理措施不到位,加上饲喂劣质饲料甚至霉变饲料等更是加剧了腹泻病毒的传播。
合理制定免疫预防策略能够有效预防和控制病毒性腹泻疫病的暴发和流行。目前,广西规模化猪场仍采用疫苗作为主要防控腹泻疫病的手段,广泛使用的商品化疫苗有猪传染性胃肠炎、猪流行性腹泻二联灭活疫苗(WH-1株 + AJ1102株),猪传染性胃肠炎、猪流行性腹泻、猪轮状病毒(G5型)三联活疫苗(弱毒华毒株 + 弱毒CV777株+NX株)、猪传染性胃肠炎、猪流行性腹泻二联活疫苗(HB08株+ ZJ08株)和以CV777为基础的PEDV灭活苗。本次针对这4种病毒性腹泻类疫病的流行病学进行系统深入研究后发现,2017年以来,PEDV、PoRV和PDCoV的流行情况和流行范围均有一定程度的下降,表明近两年广西对于腹泻的防治取得了一定的进步,但阳性样品率和地区阳性率仍处于较高水平,广西PEDV、PoRV和PDCoV仍呈现持续感染的地方流行态势。PEDV已经成为引发广西规模猪场流行性腹泻的最主要病原,并且常与PoRV和PDCoV发生混合感染。对于健康发展养猪业而言,PEDV是当前广西猪病毒性腹泻类疫病的防控重点。
由于近年来PEDV变异株的出现(基因II型为主),传统的疫苗株(基因I型)已经不能够为动物提供针对流行毒株的保护力[28-29],因此,显得至关重要,建议使用与流行基因型相匹配的疫苗,才能获得良好的免疫保护效果。研究结果显示虽然近几年来广西规模猪场的TGEV感染率较低,但由于该病是猪腹泻的常见病,一旦发生则死亡率极高,因此TGEV的预防也不容忽视。针对广西规模猪场易发的PEDV+PDCoV和PEDV+PoRV等混合感染情况,应合理选择有效的联苗进行防治。

