不同土壤深度对宁夏石嘴山盐碱地细菌菌群多样性的影响
水 燕,徐增洪,刘国锋,*
1 中国水产科学研究院淡水渔业研究中心,无锡 214081 2 南京农业大学 无锡渔业学院,无锡 214081
土壤盐渍化(盐碱化)与次生盐渍化是土地退化的主要形式,也是生态环境的一种恶化现象,是一个世界性的难题。我国是土壤盐渍化危害最为严重的国家,盐碱土地资源总额约为108hm2,尤其是西北地区的甘肃、宁夏、新疆等省区都不同程度发生盐渍化危害[1]。土地盐碱化问题与人类活动,尤其是农业灌溉,密切相关。据统计,全世界约有55%的土地分布在干旱及半干旱气候带,这些地区雨量稀少,干旱地区年降雨量一般不足250 mm[2]。发展灌溉是促使这些地区农业发展的一项重要手段。然而因过量施用化肥及不合理的灌溉管理措施而形成的土壤次生盐渍化的问题,也成为当今农业发展的主要障碍之一[3]。国内外学者在探究引起土壤次生盐渍化的原因方面做了大量研究工作,因研究侧重点的不同对次生盐渍化形成的主要原因存有不同的观点。部分学者认为对于干旱地带的大多数灌区来说,土壤次生盐渍化的形成和发展是由于不合理的灌溉,用水不当抬高了地下水位,加之强烈的蒸发而引起土壤盐渍化[4]。
宁夏回族自治区位于西北地区东部、黄河中上游,地处中温带半干旱、干旱区,降水稀少(平均年降水量292 mm),蒸发强烈(水面蒸发量1296 mm),当地水资源总量为1117亿m3,仅占全国水资源总量的0.1%[5]。近年来,引黄灌区的土壤盐渍化问题受到了宁夏自治区的高度关注[6]。银川地区盐碱地已占总耕地面积的49%以上,土壤盐碱化已成为影响宁夏农业生产的重要问题之一。现阶段学者对宁夏银川平原盐碱地研究较多,并取得了一定的成果。例如:倪细炉等[7]对盐碱植物抗盐性进行综合评价,得出4种植物抗盐能力依次为白刺>甘肃柽柳>黄花补血草>芨芨草的结论。张永宏等[8]指出应用控制灌溉是宁夏引黄灌区盐碱地水稻比较适宜的灌溉管理模式。简而言之,目前大部分研究主要集中在甘肃盐碱地土壤性质和地面植物生长特性、灌溉模式等方面,对探索次生盐渍化土壤的形成机制以及人类干预因素对盐渍化土壤的利弊研究报道很少。
另一方面,土壤是土壤微生物的生存寄居场所,由于土壤有机质含量酸碱度水分及土质的不同,与此环境相适应的土壤微生物种类也千差万别。在同一地区不同地层的土壤微生物种类和数量也不一样。盐碱土壤微生物群落研究对于加强盐生植物资源的开发和利用、改良盐碱土壤等方面具有十分重要的意义。然而由于缺乏适宜盐渍化土壤环境条件下微生物的分离和培养方法,对盐渍化生态环境下土壤微生物类群的研究至今仍然很少,盐渍化生态环境下微生物资源的开发与利用研究更是少之又少。
基于16S rRNA的聚合酶链式反应-变性梯度凝胶电泳(Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis,PCR-DGGE)是一种重要的研究微生物群落多样性的方法[9-10]。本研究以宁夏回族自治区石嘴山地区低洼池塘区域盐渍化土壤为研究对象,利用PCR-DGGE技术分析不同深度土壤细菌类群多样性及优势种群,研究结果将为盐碱环境下土壤微生物资源分布和研究提供重要的理论依据。
1 研究区域和样品采集
本研究区域位于宁夏回族自治区石嘴山市大武口地区星海镇石嘴山兰泰养殖合作社,该地分布有低洼池塘,底层土壤性质为典型的硫酸盐型盐碱土,pH值为8.7—9.3。为达到农户增收并改良土壤环境的目的本养殖合作社于2013年引进大宗淡水鱼池塘养殖技术。地理坐标为38°54′20″—38°55′25″N之间,106°21′31″—106°21′43″E之间。石嘴山市属于温带大陆性气候,降水量最大时期为7月份,约为24 mm。

图1 采样点分布图Fig.1 The map of the sampling sites
于2016年7—9月份对盐碱样地进行土壤样品采集。随机选取3个样点(S1、S2和S3,图1)、每个样点进行分层采集,从0—20 cm、20—40 cm、40—60 cm、60—80 cm 4个地层深度按五点采样法采集土壤样品。以表层混合土(control surface soil, CS)、底层混合土(control hybrid soil, CH)和植物根际土(control rhizosphere soil, CR)作为对照组。将土壤样品放在便携式冰盒中带回实验室,放在-20℃冰箱保存,用于DGGE分析。
2 研究方法
2.1 土壤样品的理化性质测定
土壤样品基本理化参数(含水量、烧失量、孔隙度、总氮、总磷、pH值等)采用常规方法测定:土壤pH值的测量选用上海雷磁PHS- 3C型pH计测定;总氮(total nitrogen, TN)、总磷(total phosphorus, TP)采用浓H2SO4消煮-比色法测定;烧失量(loss on ignition, LOI)即将在105—110℃烘干的原料在1000—1100℃灼烧后失去的重量百分比。土壤孔隙度由孔隙度测定仪(贝士德仪器,北京)测定;每个样品有2个重复,取其平均值。
2.2 土壤DNA的提取
采用Fast DNATMSPIN Kit For Soil提取样品基因组DNA,操作方法按说明书进行。提取的DNA经Thermo NanoDrop 2000进行核算质量与浓度检测。
2.3 细菌16S rDNA片段的PCR扩增
以样品基因组DNA为模板,采用细菌通用引物GC- 338F和518R扩增样品16S rRNA高变区序列。GC- 338 F: 5′-CGCCCGGGGCGCGCCCCGGGGCGGGGCGGGGGCGCGGGGGGCCTACGGGAGGCAGCAG-3′,518 R:5′-ATTACCGCGGCTGCTGG-3′; 338 F: 5′-CCTACGGGAGGCAGCAG-3′。PCR扩增体系(50 μL)为:10×PCR buffer 5 μL;dNTP Mixture(2.5 mmol/L)3.2 μL;ExTaq(5 U/μL)0.4 μL;GC- 338 F(20 μmol/L)1 μL;518 R(20 μmol/L)1 μL;模板DNA 50 ng;补ddH2O至50 μL。PCR扩增程序为:94℃预变性5 min;94℃变性1 min,55℃复性45 s,72℃延伸1 min,30个循环;最终72℃延伸10 min。PCR产物采用OMEGA公司DNA Gel Extraction Kit纯化回收。扩增结果用2%的琼脂糖凝胶进行检测。PCR仪为Biometra公司生产的T-gradient,凝胶成像仪为Bio-Rad公司的Gel-Doc2000凝胶成像系统。
2.4 PCR产物的变性梯度凝胶电泳(DGGE)及图谱分析
取10 μL PCR的产物进行变性梯度凝胶电泳(DGGE)分析。采用变性梯度为35%—55%、浓度为7%的聚丙烯酰胺凝胶在1×TAE缓冲液中150 V 60℃下电泳5小时。电泳完毕后采用银染法染色,简要步骤如下:1)固定液(乙醇50 mL和冰醋酸2.5 mL,定容至500 mL)固定15 min;2)Milli-Q纯水清洗、20 s和2 min各一次;3)银染液(硝酸银1g和37% 甲醛0.75 mL,定容至500 mL)染色15 min;4)Milli-Q纯水清洗、20 s和2 min 各一次;5)显色液(氢氧化钠7.5 g和37%甲醛2.5 mL,定容至500 mL)显色5—7 min;最后用终止液(乙醇50 mL和冰醋酸2.5 mL定容至500 mL)终止反应。
图谱分析采用Bio-Rad公司的凝胶定量软件Quantity One 4.6.5对样品条带分析[11]。依据戴斯系数Cs(Dice Coefficient)计算个附着基样品间的相似性,对相似性结果用非加权组平均法(Unweighted Pair Group Method with Arithmetic means,UPGMA)进行聚类分析。
2.5 数据分析
多样性指数是研究群落物种数和个体数以及均匀度的综合指标[12]。DGGE图谱采用Quantity one软件对每个样品的电泳条带数目、条带密度进行数字化分析,Shannon指数(H)[13]、丰度指数(S)和均匀度Pielou指数(E)[14]等指标被用来比较不同样品的多样性情况。S指数是某样品中所有条带数目总和,其他算法为:
式中,pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率;N为DGGE图谱单一泳道上所有条带的丰度;Ni为第i条带的丰度。
测序结果采用DNAstar和Cluster软件进行序列分析,下载最相似的菌株序列作为系统发育树的参考序列。然后采用MEGA软件,Neighbor-joining法构建系统发育树,自展数(bootstrap)为1000。PCA分析采用canoco软件进行。
所有数据均用软件Excel和SPSS 19.0软件用Duncan检验方法进行数据分析处理和差异显著性分析(P<0.05差异显著)。同列数据后具有相同字母者,表示在0.05水平上差异不显著。
2.6 条带的切胶、克隆和测序
根据 DGGE图谱,挑选共有及特有的优势条带。在紫外灯下用无菌手术刀片把选定的条带从凝胶上切割下来,随即浸泡于50 μL超纯水中,并置于4℃过夜。用所得的浸提液作为模板用引物338 F和518 R进行PCR扩增,反应体系和扩增程序与之前的相同。得到的PCR产物经DNA凝胶回收试剂盒(Omega)进行纯化后与克隆载体(pGEM-T)连接,得到的阳性克隆子送往上海英俊有限公司测序。将测序结果在GenBank数据库中进行比对分析。
3 结果与分析
3.1 土壤样品理化性质结果分析
本实验所测定土样的理化性质如表1所示,试验地区土壤的含水量在5.59%—23.64%之间,pH维持在7.98—9.06之间,处于碱性水平。总磷含量在0.27—0.63 mg/g之间,总氮在0.15—0.51 mg/g之间,土样较为贫瘠,孔隙度差异较大。从不同土壤深度来看,各个深度(从地下20 cm到80 cm)土壤样品的基本理化参数之间并不存在显著差异,然而不同采样点之间的差异较大,表明该地区土壤性质非常不均匀。其中表层土对照组的含水量非常低,pH值较高,盐渍化程度较高;而根际土对照组的土壤理化指标与非根际土之间并没有显著差异,表明在该地区植物根际对盐渍化土壤的改良影响程度不大。
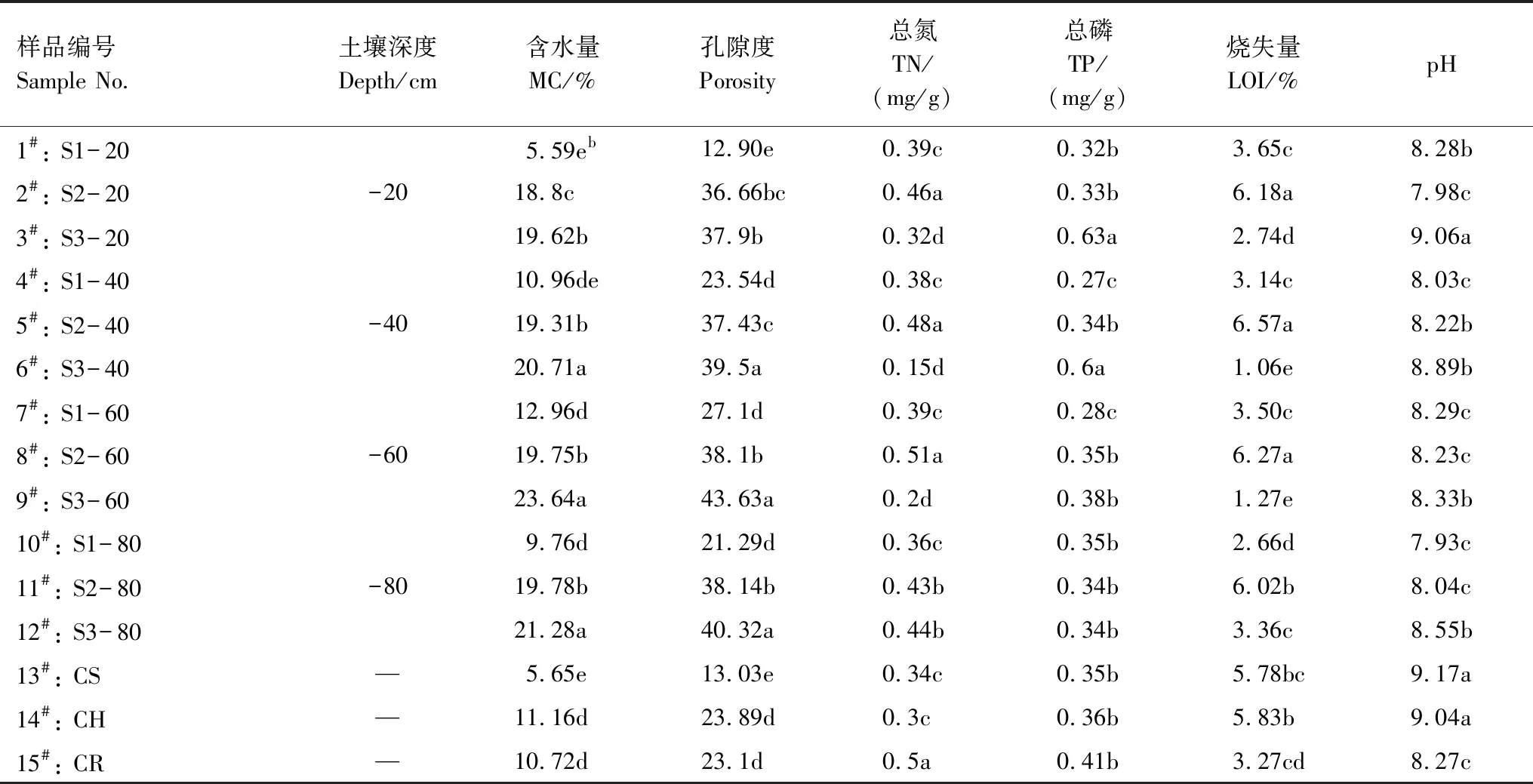
表1 采样点信息和样品理化性质
Sample No., 样品编号 sample number;MC, 含水量 moisture content;TN, 总氮 total nitrogen;TP, 总磷,total phosphorus;LOI, 烧失量 loss on ignition;CS, 表层混合土 control surface soil;CH, 底层混合土control hybrid soil;CR,植物根际土control rhizosphere soil;b同一列中的数值后字母不同表示该指标有显著差异(P<0.05)
3.2 细菌 16S rRNA的PCR扩增

图2 16S rRNA-V3区电泳结果 M:DL 2000Fig.2 The results of 16S rRNA-V3 region of bacteria M: L 2000
经分光光度计检测提取后样品DNA的OD260/OD280值均在1.78—1.95,说明提取的DNA质量良好,可以作为模板进行PCR反应。以GC- 338 F和518 R为引物经巢式PCR后产物的电泳结果如图2所示,条带大小与细菌16S rRNA-V3区理论大小(约234 bp)相同,且无非特异性扩增,可直接用于后续DGGE实验。
3.3 PCR产物的变性梯度凝胶电泳(DGGE)指纹图谱
对土壤样品的DGGE指纹图谱以及模式图进行了分析,结果如图3所示。理论上DGGE图谱中每一个条带代表一种微生物,条带的数目及灰度可以反映出细菌的种类及相对数量[15]。由图可见,15个盐碱地土壤样品的可分辨条带总数在4—24之间,其中3#样品的可识别条带数量最多(24条),4#、7#和13#样品的条带数量最少(4条)。不同土壤样品的DGGE图谱在迁移率及条带灰度值方面均存在较大的差异,表明宁夏石嘴山地区盐碱地土壤中的微生物多样性丰富程度非常高,存在大量的细菌类群,并且土壤样品中细菌优势菌群不尽相同。并且,不同土壤间具有许多共同的条带,然而这些公共条带的强度也不相同,说明这些供试土壤之间可能存在一些共有的细菌类型,但是土壤微生物在DNA水平上有明显差异。
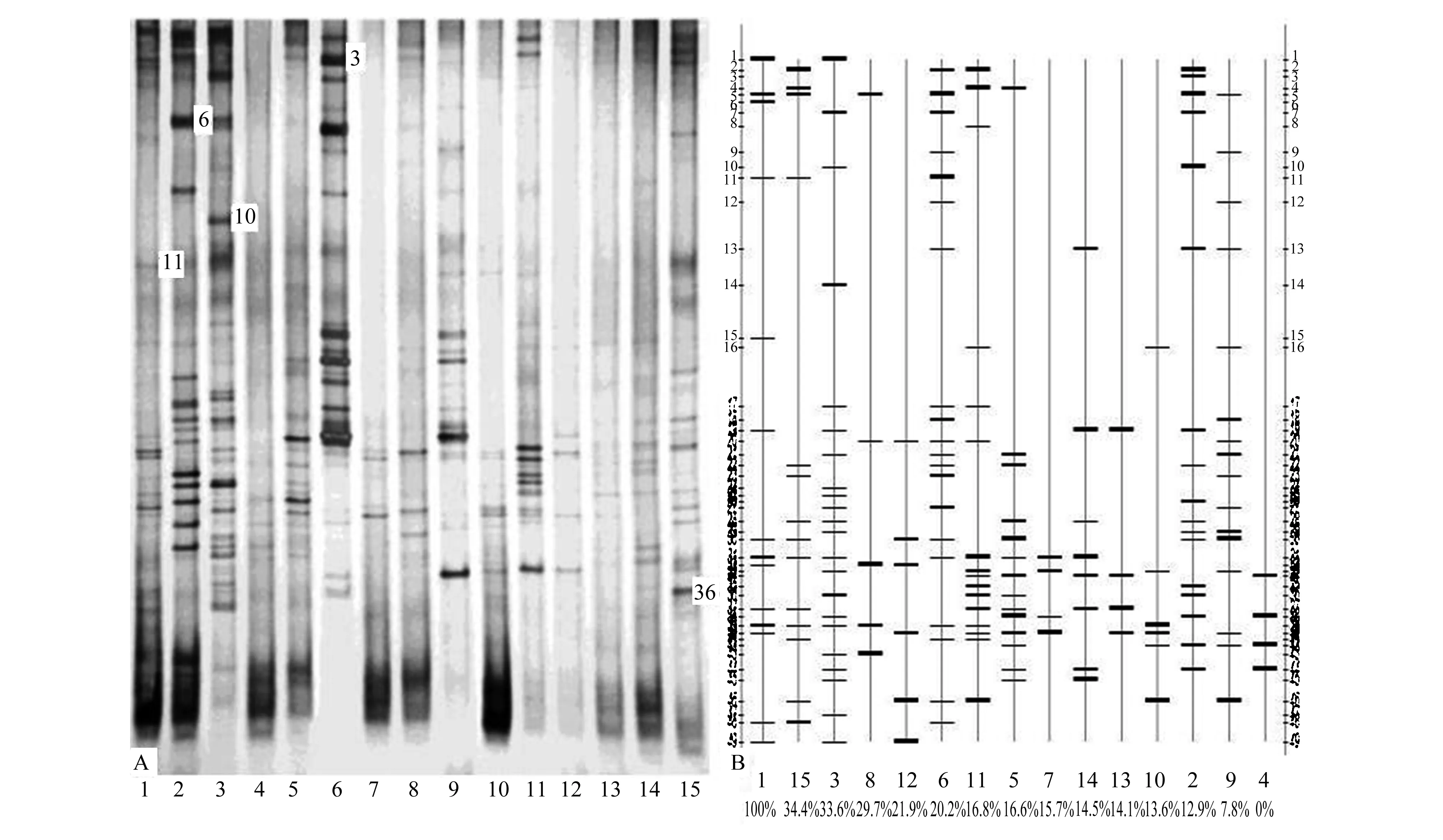
图3 16S rRNA变性梯度凝胶电泳图谱和模式图(由Quantity One 4.6.2软件生成)Fig.3 PCR-DGGE profiles and its digitized patterns (by Quantity one 4.6.2 software) Numbers represent the bands excised
3.4 相似性与聚类分析
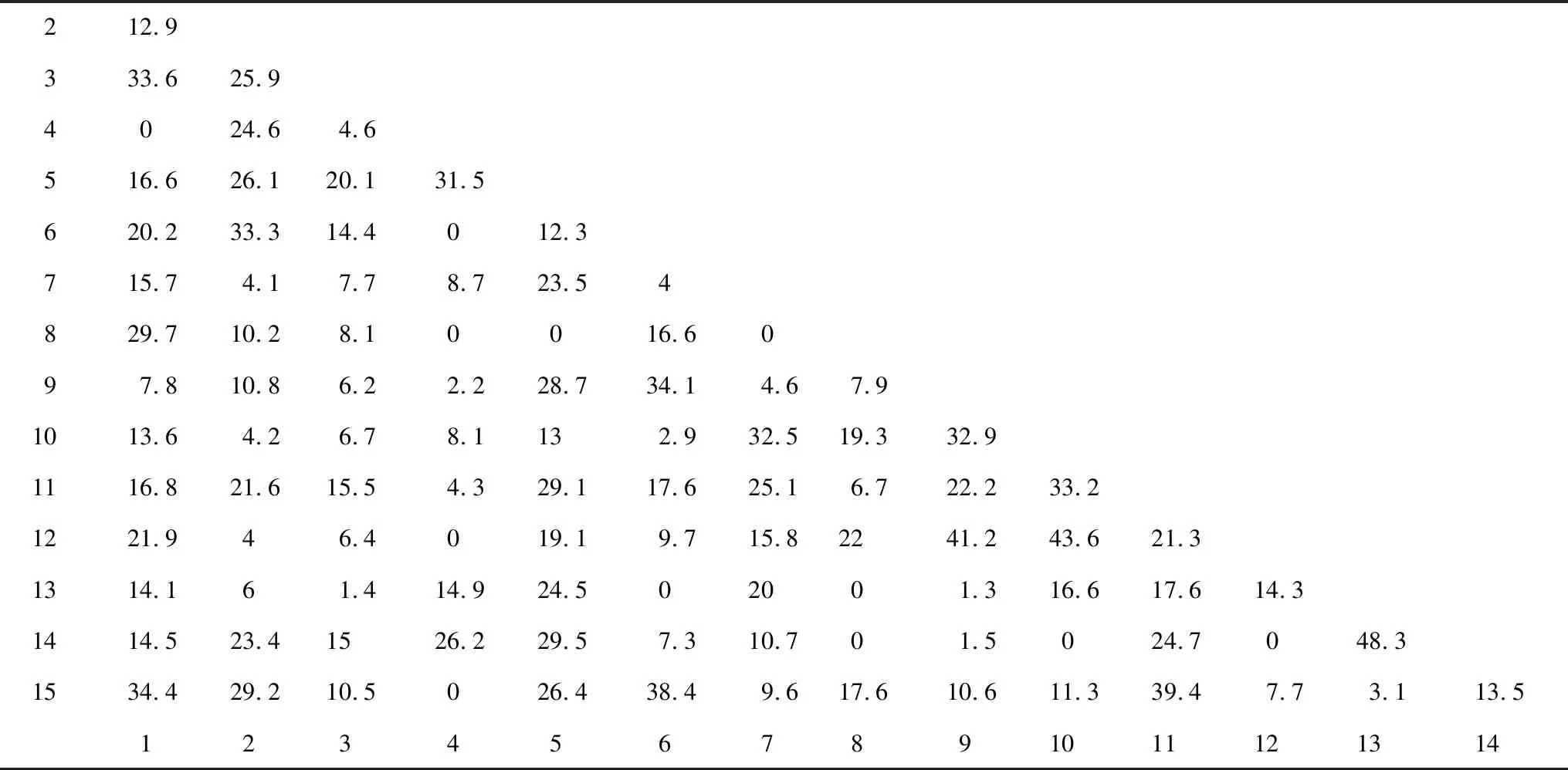
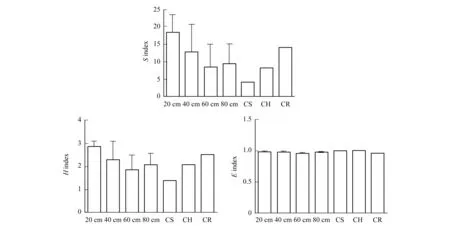
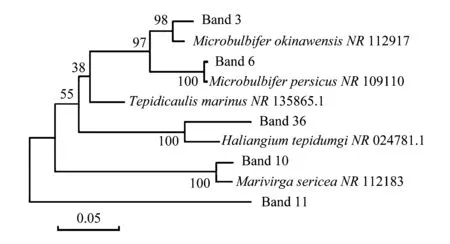
戴斯相似性系数Cs的大小可以体现出群落间细菌种群的差异,基于DGGE图谱的0/1矩阵计算的相似性矩阵如表 2所示。从表中可以看出,样本之间Cs值在0—43.6%之间。13#和14#样本作为对照组之间的Cs值最高,达到48%;10#和12#样本之间的相似性系数次之,为43.6%,而这两个样本均来自于-80 cm的地层深度。以不同地层深度来比较,在-20 cm地层,1#、2#和3#样本之间的相似性系数分别为12.9%、33.6%和25.9%;在-40 cm地层,4#、5#和6#样本之间的相似性系数分别为31.5%、0和12.3%;在-60 cm地层,7#、8#和9#样本之间的相似性系数分别为0、4.6%和7.9%;而在-80 cm地层,10#、11#和12#样本之间的相似性系数分别为33.2%、43.6%和21.3%。这些结果表明,不同地层的样本之间的相似性差异非常大,大体上来说,在表层(D<20 cm)土壤和底层(D>80 cm)土壤样本之间的戴斯相似性系数较高,样本之间细菌种群的差异程度较低,而中间层(20 cm 对PCR-DGGE图谱获得的0/1矩阵进行的UPGMA聚类结果(图4)显示。从图中可以看出15个样本聚为2个分支,4#、5#、13#和14#样本作为第一分支;其余作为第二分支,并且两大分支之间的距离较远。而第二分支内部进一步聚为2个亚支。根据相似性和聚类结果可初步得出结论:相对于混合土壤样品中细菌菌落多样性程度而言,不同地层深度土壤样品之间细菌群落多样性程度相对较高;而根际土壤样品中细菌群落多样性没有显著表现。 图4 0/1相似性矩阵的UPGMA聚类结果Fig.4 The result of UPGMA clustering based on the 0/1 similarity matrix of the microbiota from samplesDice Co-efficient数值表示相似性大小;聚类图由软件NTSYS 2.10e绘制;UPGMA:非加权组平均法 unweighted pair group method with arithmetic means 多样性指数是利用数学统计方法测度群落中物种数、个体数量及各物种均匀程度等方面的常用参数。Pielou指数(E指数)用于测度群落中不同物种多度分布的均匀程度;Shannon指数(H指数)和丰度指数(S指数)常用于评价群落的多样性,但前者能体现群落内种群数和种群间个体分配的均匀性[16]。根据DGGE图谱中条带的数量与灰度计算各多样性指数结果如图5所示。从图中看出,各土壤样品之间丰度指数S指数在8—17之间,变化较大。然而大概来说,随着地层深度的增加,S值逐步下降,虽在-60 cm地层深度丰度值减少较快,但变化幅度较小,显示土壤细菌菌群种类与地层深度之间呈负相关关系。Shannon指数H值在1.8—2.9之间,变化趋势与S类似,表明多样性程度随着地层深度的增加逐渐降低。Pielou指数E值在0.903—0.956,变化幅度很小,表明各地层深度检测样本与对照组之间均匀程度较高。 表2 戴斯系数Cs比较PCR-DGGE图谱的相似性矩阵 图5 15个土壤细菌微生物样品的多样性指数Fig.5 The diversity index of bacteria among the samplesS index,丰度指数 指条带数;H index,Shannon指数 index,Pielou均匀度指数 CS,表层混合土 control surface soil;CH,底层混合土control hybrid soil;CR,植物根际土control rhizosphere soil DGGE凝胶条带回收后,以338 F和518 R为引物进行PCR扩增,PCR产物纯化后连接到pMD18-T载体上,转化至DH5α感受态细胞中,筛选阳性克隆测序。16S rRNA-V3区特征片段经DGGE分离条带切割,共得到37条条带。将条带进行克隆测序,所得到的序列大小在169—195 bp范围内。在GenBank核酸数据库中进行BLASTN序列比对显示其中5条条带分别归属于2个细菌类群:变形细菌门Proteobacteria和拟杆菌门Bacteroidetes(表3),其中4条(Band 6、3、36和11)属于变形细菌门的α,β和γ亚门,其余32条条带为未知菌种。 其中S2号采样点的-20 cm土壤深度样点2#的土壤样品回收条带Band 6的DNA序列与Marinobacterpersicus(NR_109110)的序列相似性达100%,而这一条带也存在于1#、6#和15#土壤样品中,说明此种细菌在各采样点中广泛分布;6#样品的回收条带Band 3与γ-变形细菌门的Microbulbiferokinawensis(NR_112917)的序列相似性达98%,这一条带也存在15#、8#和2#样品中;而3#土壤样品的回收条带Band 10与拟杆菌门Bacteroidetes的Marivirgasericea(NR_112183)序列相似性达97 %,并没有在其他土壤样品中被检测到。 表3 经DGGE分离获得的细菌16S rRNA-V3序列 a条带编号与图3所示对应;b仅列出最高匹配度序列及名称 图6 DGGE图谱条带回收获得的16S rRNA系统进化树 Fig.6 Neighbour-joining phylogenetic tree of the 16S rRNA obtained from retrieved DGGE bands 采用MEGA5软件Neighbor-joining法构建系统发育树,自展数(bootstrap)为1000,系统发育树如图6所示。 盐碱地形成与气候、地理条件、土壤质地、植物类型以及耕作管理等因素有关。近年来宁夏地区土地盐渍化程度加剧,其中仅银川地区中度和重度盐渍土面积达到4600 km2,占总面积的50%以上,属于中度和轻度盐化土类型,盐分呈表聚趋势。该地区土壤盐渍化的原因是多方面的。一方面该地属于干旱地区,降水量小于蒸发量,溶解在水中的盐分随土壤毛细管水蒸发作用而积聚在土壤表层,使得表层土壤大量积盐;另一方面该地地势较低,地表和地下水运动使得水溶性盐随着水从高处流向低处,在低洼地带滞留,导致盐分积聚。土壤灌溉管理不当造成排水不畅等也进一步加剧了土壤盐渍化。 土壤微生物积极参与陆地生态系统中的物质循环及能量转化,与土壤理化性质的环境条件密切相关,是表征土壤肥力的重要指标之一。土壤微生物群落活性及其多样性不仅在很大程度上决定了生物地球化学循环、土壤有机质的周转及土壤肥力和质量,也与耕作措施有关[17]。土壤盐渍化不仅直接影响土壤中微生物活性,而且通过改变土壤的部分理化性质来间接影响土壤微生物的生存环境,导致土壤微生物种群、数量及活性均与健康土壤有较大的差别。土壤理化性质(电导率、硝态氮、总盐)对微生物的生长有很大的影响,对表层土的影响远大于深层土。土壤中即使有机质含量丰富,如果土壤盐渍化严重,微生物仍不能正常生长。受土壤基本性质影响最大的是细菌和放线菌,真菌对土壤盐渍化的适应性相对要强一些[18]。土壤盐分升高,造成土壤微生物渗透胁迫,使土壤活性微生物种群数量降低,导致活体微生物分泌酶的数量减少。一般来说,细菌、放线菌数量与土壤全盐含量呈显著负相关关系,细菌的数量与土壤有机质含量显著相关,即土壤盐害程度越高,微生物数量越小。 当前对于宁夏地区盐渍化土壤菌群微生物的研究还相对较少,已有的研究表明在宁夏地区盐渍化土壤微生物群落中细菌占绝对优势,其次是放线菌和真菌[19]。另有对宁夏典型盐渍化土样放线菌进行分离筛选的研究结果表明,具有特殊抑菌活性功能菌为链霉菌(Streptomyces),形态特殊菌为拟无枝酸菌(Amycolatopsis),耐盐菌株为诺卡氏菌(Nocardia),其他形态特殊菌株和耐盐菌株均为拟诺卡氏菌(Nocardiopsis)[20]。而对宁夏地区不同类型盐渍化土壤的分析显示,土壤盐渍化程度不同与耐盐性放线菌比例直接相关。即重盐化土壤中分布的耐盐放线菌最多;其次为中度盐渍化、轻度盐渍化土壤,并且盐渍土壤中放线菌分为仅能在盐渍环境下才能良好生长的嗜盐性放线菌和对盐渍化的程度具有不同敏感度的耐盐性放线菌[21]。另有学者从宁夏盐渍化土壤中分离出硫氧化细菌,经鉴定疑似为新种[22]。 由于PCR-DGGE图谱能直观地反映出不同性质土壤细菌16S rRNA的多样性,即可在分子水平反映土壤细菌种群结构多样性,在土壤生态研究中被广泛应用。在DGGE指纹图谱中,不同位置的条带代表不同的细菌类群;而条带灰度值则反映出不同细菌类群相对量的多少。在不同泳道同一横向位置的不同条带一般被认为是同一个细菌类群。本研究从宁夏盐碱地土壤样品中提取基因组总DNA,利用PCR-DGGE技术分析不同地层深度盐碱地中微生物的种群构成。从DGGE图谱上可以看出,宁夏石嘴山地区盐碱地土壤样品中可分离到4—24条不等的条带,说明该地区盐碱地土壤中存在丰富的微生物资源,并且多样性程度较高。从对照组来看,表层混合土(CS,13#样本)含水量较低,土壤碱性强(pH>9.0),且相较于实验组在图谱条带数量上存在明显劣势,表明该地区表层土壤中盐分积聚明显,高碱性环境对大部分常规微生物造成胁迫导致其难以存活。与此相比,底层混合土壤(CH,14#样本)和根际土壤(CR,15#样本)的图谱条带丰富很多并且界限清晰可辨,说明底层土壤和根际土壤的生态环境在一定程度上要优于表层土壤。这一结果为宁夏地区盐碱地表层盐分沉积理论提供了部分依据。 一直以来,灌溉管理和低洼地区池塘养殖对于改良盐碱地土壤生态环境的影响都是学者们十分关注的问题。这些改良措施存在的利弊也在不断被评估。在本研究中,实验样本取自低洼池塘养殖多年的人工干预环境条件下,本研究结果在一定程度上能反映池塘养殖的改良措施对改善该地区土壤生态环境的作用和意义。实验结果表明,样本之间的相似性随着土壤深度的不同差异较大,在表层(D<20 cm)土壤和底层(D>80 cm)土壤样本之间的细菌种群的相似性相对较高(差异程度较低),而中间层(20 cm 对此我们推测,上述结果可能跟土壤含水量有关。一般来说,土壤含水量的多少会影响蛋白质的流动性及土壤酶活性以及细胞膜的流动性,而这是土壤微生物能否存活的重要基础。而土壤含水量的变化与土壤环境特性及土壤深度之间存在非常复杂的关系。如对松嫩平原盐碱地土壤分析表明,大多数理化指标如pH、土壤容重、有机碳含量、碱解氮含量、全氮含量,全磷含量、全钾含量出现随深度显著变化[23]。而对青藏高原昆仑山垭口土壤的研究结果表明可培养细菌数量与多样性在一定程度上均与土壤深度呈负相关关系[24]。这与当地的地貌和地质成因有很大的关系。在宁夏盐碱地区,由于地层地下水和表层灌溉等的交相作用,使得各深度土壤环境规律性相对较低,地域差异性也很大。在池塘表层区域(D<20 cm),由于养殖活动导致淤泥含水丰富,水中可溶性蛋白和浮游微生物移动扩散相对容易,使得采样点之间细菌菌群的相似性程度较高;随着地层深度的增加,土壤含水量相对减少使得水中物质和呼吸能量交换逐渐困难,土壤均一性逐渐降低,最终体现在细菌菌群上为各点之间相似性降低;在深度地层中(D>80 cm),土壤孔隙度相对提高,土壤间隙增大(但是含水量并没有显著变化),这或许是细菌菌群由于呼吸作用导致的相似性程度变高的一个考虑因素。然而,从实验方法上看,由于PCR-DGGE在分析土壤细菌多样性方面分辨率不高,基于DGGE带谱的相似性和UPGMA聚类分析结果会有较大偏差,使结果和结论的可信度较低。在后续研究中一方面可以有针对性地加大取样点的位置和数量,增加实验基数,有利于从数据中凝练规律,另一方面可以利用微生物高通量测序分析来进一步深入这项研究。 本研究对图谱中优势条带经切胶回收克隆测序结果显示,该盐碱地土壤中主要的优势种群分布在2个细菌类群:变形细菌门Proteobacteria和拟杆菌门Bacteroidetes,此外还有32条优势条带序列属于未培养菌。变形菌门和拟杆菌门是构成土壤和污泥微生物群落的主要种群,本研究表明这两种微生物种类在盐渍化土壤环境中也有广泛分布[16]。然而,大部分优势菌种尚未被鉴定的结果说明,这些优势菌株可能是目前尚且不能培养或者是难获得纯培养物的新种资源,这些菌株长期适应干旱、有机质缺乏、盐碱度较高的极端环境,最终成为优势菌株。对这些优势菌株展开研究不仅能进一步丰富地球微生物资源,而且对于盐碱地盐渍化土壤的改良和生态发展等方面的应用都具有重要的意义。 总而言之,本研究采用基于16S rRNA的PCR-DGGE技术对宁夏石嘴山地区低洼池塘不同深度土壤的细菌群落多样性和优势种群进行分析,研究结果在一定程度上暗示了该地区盐碱地的形成机制之一可能是表层低洼土壤的盐分堆积;并且人工养殖活动对于改善土壤生态环境具有一定积极作用。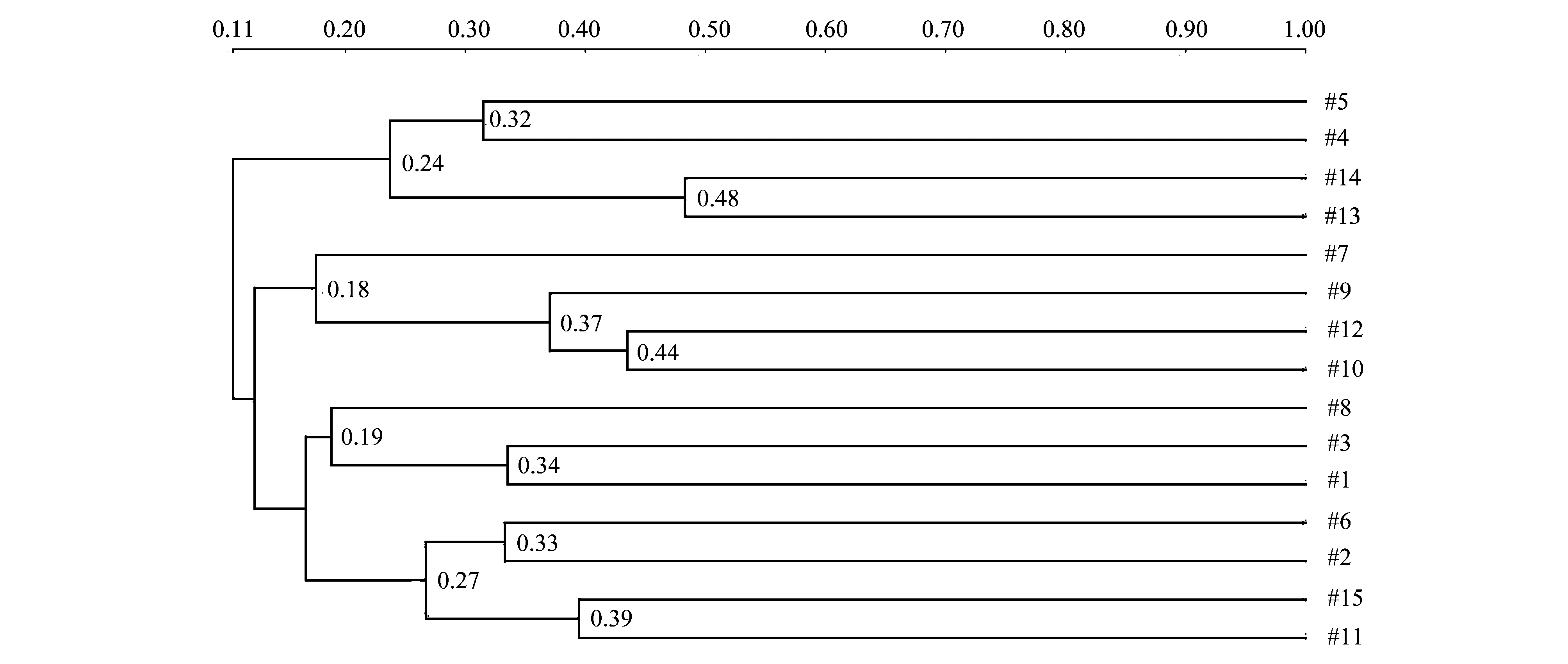
3.5 多样性指数分析
3.6 主要电泳条带的序列测定和系统发生分析

4 讨论

