中药小蓟不同药用部位体外抗炎、促凝血的作用研究*
王鹤辰,包永睿,2,3,王 帅,2,3,李天娇,2,3,刘金瑛,2,3,孟宪生,2,3**
(1.辽宁中医药大学药学院 大连 116600;2.辽宁省组分中药工程技术研究中心 大连 116600;3.辽宁省现代中药研究工程实验室 大连 116600)
小蓟(Cirsium setosum(Willd.)MB.)俗称“刺儿菜”,《中国药典》记载,小蓟“凉血止血,祛瘀消肿。”用于衄血,吐血,尿血,便血,崩漏下血,外伤出血,痈肿疮毒[1]。关于小蓟的药用部位的功效,在不同的典籍中有不同的描述。如《本草图经》中记载:“小蓟生捣根绞汁服,以止吐血,衄血、下血。”《圣济总录》中记载小蓟治疗妊娠堕胎后出血不止:“小蓟根叶(锉碎)、益母草(去根,切碎)各五两。以水三大碗,煮二味烂熟去滓至一大碗,将药于铜器中煎至一盏,分作二服,日内服尽。[2-3]”等。小蓟用药的现代研究表明,小蓟有止血、收缩血管、抗菌、抗炎、抗癌等作用[4,5]。然而在目前的中药开发理论指导下的小蓟药效研究,大都集中在一种或几种活性物质的量的变化与药效的关系上[6-9],对不同的用药部位的研究却鲜见报道。本实验旨在研究小蓟根茎叶花在成分与抗炎,止血药效方面的区别。
本实验采用对照品比对鉴定色谱峰的种类,以不同药用部位的指纹图谱作为物质基础,比较小蓟不同药用部位提取物的抗炎与促凝血药效的区别,使用灰色关联计算软件计算出检定出的每种成分对抗炎与凝血酶原指标的贡献程度,尝试筛选出治疗一种病症的最优药用部位,建立了多种化合物与药效的联系[10]。提出了一个精准的分析方法,为传统中药小蓟的合理使用提供理论依据。
1 材料与方法
1.1 主要仪器
NUAIRETM US AUTOFLOW型CO2培养箱(德国NUAIRE公司);Agilent 1290型快速高效液相色谱仪(安捷伦公司)。
1.2 试剂与药材
KM小鼠(辽宁长生生物有限公司,许可证号:SCXK(辽)2018-0301),乙腈(色谱纯,德国Merck公司);冰乙酸(色谱纯,天津市科密欧化学试剂有限公司);小鼠凝血酶原(PT)酶联免疫试剂盒;小蓟药材(购自山东,经辽宁中医药大学中药鉴定教研室许亮教授鉴定为菊科植物小蓟(Cirsium setosum(Willd.)MB.)的干燥全株)。
1.3 供试品溶液的制备
将小蓟药材按根、茎、叶、花分开,粉碎,过3号筛,各取粉末约5.0 g,置于圆底烧瓶中,精密加入200 mL的95%乙醇溶液,加热回流提取1 h,放冷,滤过,取续滤液摇匀过0.22 μm微孔滤膜,即得供试品溶液。
1.4 小蓟不同药用部位指纹图谱的建立
1.4.1 色谱条件
色谱柱Agilent poroshell SB-C18(4.6 mm×100 mm,2.7 μm),流动相乙腈(B)-0.5%冰乙酸(A),梯度洗脱,0-6min 5.0%-13%B,6-20 min 13%B,20-60 min 13%-22%B,60-90 min 22.0%-100.0%B,柱温30℃,检测波长:260 n,供试品进样量10 μL。
1.4.2 HPLC指纹图谱的建立
取1.3项供试品溶液按2.2.1项色谱条件,进行分析检测,得到小蓟药材不同入药部位的液相图谱。将图谱信息导入中药指纹图谱相似度评价软件(2012版),得到小蓟不同用药部位的指纹图谱。
1.5 对照品比对鉴定色谱峰成分
经前期文献调研,明确了多种在小蓟药材中可能存在的与抗炎、促凝血相关的活性成分[11,12]。经过比对保留时间,最终确定了11种存在于小蓟药材中的成分。
1.6 小蓟不同部位提取物在抗炎,止血方面的药效学评价
1.6.1 小蓟不同部位提取物对小鼠炎症RAW264.7细胞的抑制作用
RAW264.7小鼠单核巨噬细胞,常规培养于含10%胎牛血清的DMEM培养液中,取对数生长期的细胞接种于96孔板中,取4种供试品溶液各2.5 mL,滤过,挥干后分别溶于10 mL培养液中(经计算,浓度为每毫升培养液中含0.062 5 g生药提取物)。待细胞贴壁后,将孔内空白培养液替换为加药培养液作用24 h(每组十个复孔)。使用MTT法染色,使用酶标仪检测活细胞数量,计算方法如下。

1.6.2 小蓟不同部位提取物对小鼠血浆中凝血酶原指标的影响
将60只KM小鼠(雄性,20-22 g)按根,茎,叶,花,西阳,空白平均分成6组,每组10只,西阳药物选用维生素K3。每次按0.025 g生药量/只给药,西阳按每次0.0125 g·只-1给药,空白组给予相同体积生理盐水。连续灌胃7天,以肝素钠为抗凝剂取血浆,按试剂盒说明书操作,每组取5个复孔。使用酶标仪进行检测,将每个复孔的数据进行整理,根据试剂盒的原理,酶标仪的示数越大,产生的指标物质越多,说明药效越好。
1.7 灰色关联度分析
分别将小蓟四个不同部位提取物对RAW细胞的抑制率、四个不同部位提取物对小鼠凝血酶原的指标数值作为母序列,图谱中11种成分的峰面积作为子序列,采用灰色关联度分析软件(GreyModeling V3.0)进行分析。得出小蓟不同药用部位色谱峰与其对RAW细胞的抑制率与小鼠凝血酶原指标的关联系数(贡献程度)。
2 结果
小蓟不同用药部位化合物保留时间与峰面积信息(表1),指纹图谱信息(图1)。
体外实验结果显示,小蓟花的药效最强对RAW264.7细胞的抑制率最大,根次之,茎与叶对RAW264.7细胞的抑制率作用不大(图2)。试剂盒的结果数据显示,小蓟花对小鼠凝血酶原指标影响最大,叶次之,茎与根对指标影响较小(图3)。
使用GreyModeling V3.0软件,计算出小蓟不同药用部位的色谱峰面积与RAW细胞的抑制率以及小鼠凝血酶原指标的关联系数信息(图4)。结果显示,绿原酸、橙皮苷、咖啡酸、蒙花苷对抑制炎症细胞增值(抗炎)与升高凝血酶原指标(止血)的关联系数与其他成分相比较高,说明这四种成分对抗炎与止血的贡献程度较大。

图1 小蓟不同部位指纹图谱与共有峰
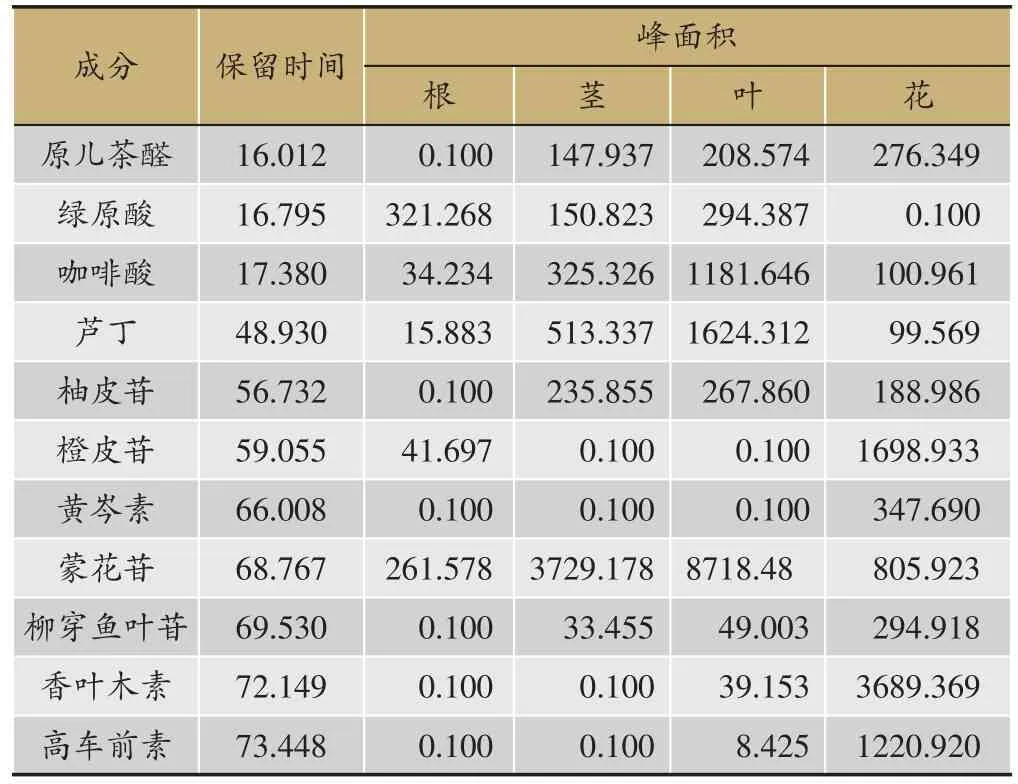
表1 小蓟药材中不同部位的化学成分
3 讨论
中药的药用部位在典籍中有很多记载,其中针对不同的病症,往往施用不同的药用部位。这提示现代的研究者,应该开展针对不同部位的相关研究。中药的现代研究表明,中药的药效与中药的物质基础紧密相关,通过对药效物质基础的研究可以对中药的传统理论赋予现代的科学解释[13]。中药中成分组成复杂多样,只通过测定其中一种或几种成分的含量通常无法全面地说明中药质量与疗效的好坏[14]。所以,研究生药不同采收时间、不同用药部位化学成分差异与不同病症疗效之间的关系,明确生药的精准应用意义重大。
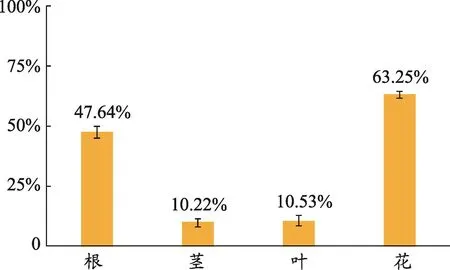
图2 小蓟不同部位对RAW264.7细胞的体外抑制率
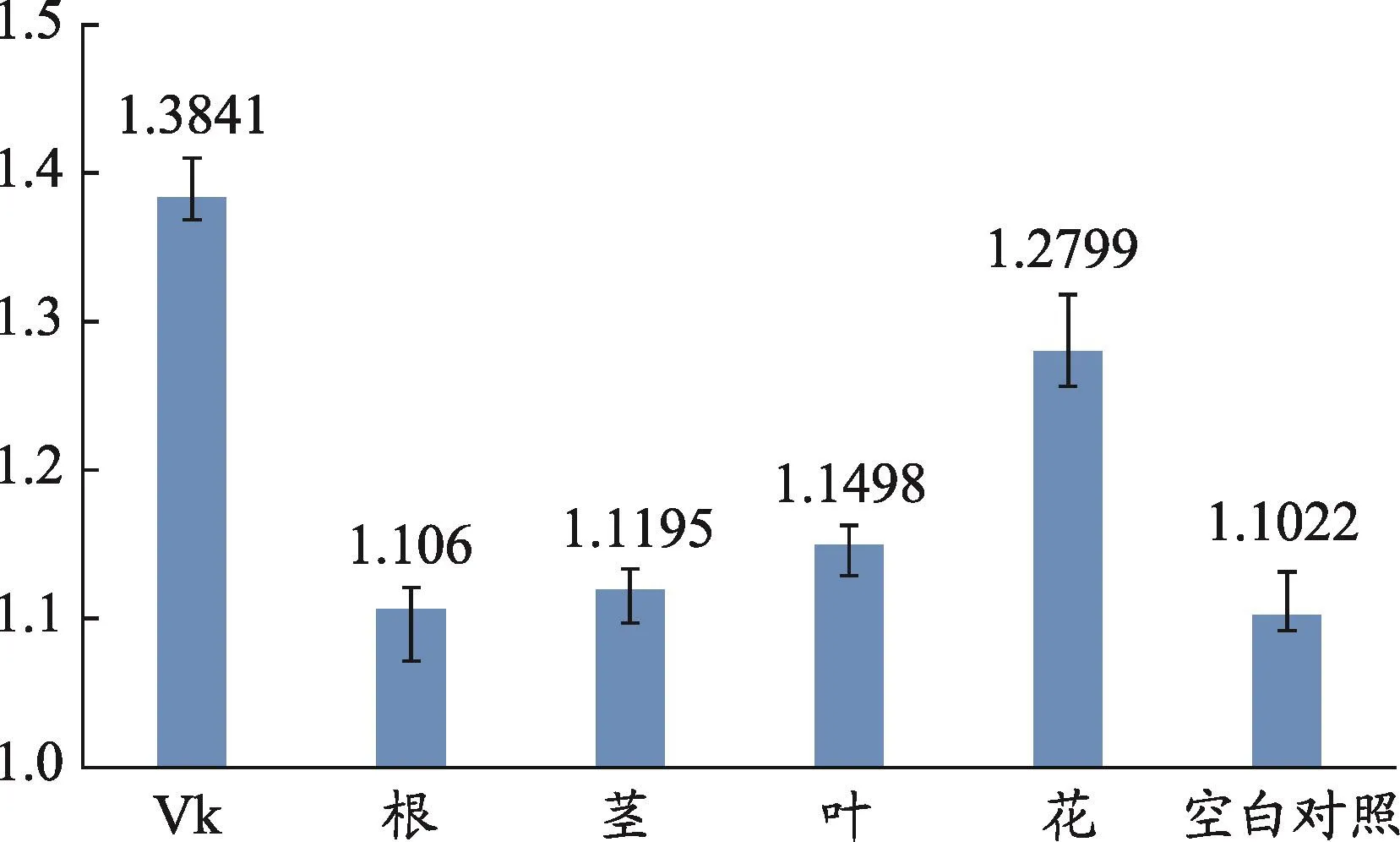
图3 小蓟不同部位的小鼠凝血酶原(PT)试剂盒结果(P<0.05)
本实验以传统中药小蓟为研究对象,建立了不同药用部位的指纹图谱,针对外抗炎药效与凝血酶原(PT)指标,研究了小蓟不同部位的精准使用。结果显示,不同的部位成分种类与含量差异较大,从指纹图谱中峰面积及数量可以看出,小蓟全株中4个部位的化学成分具有一定的差异性。小蓟花中成分种类最多,根中成分种类最少,而茎与叶中成分种类基本一致,含量有所区别。
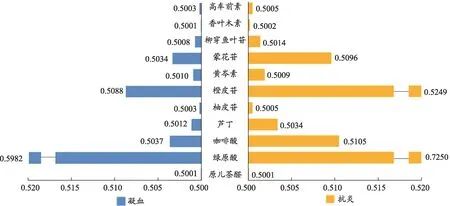
图4 GreyModeling V3.0软件计算出小蓟中11种成分对抗炎,凝血的贡献程度(P<0.05)
小蓟可清热消肿,在前期的相关研究中,我们发现小蓟黄酮中的一些成分可以对癌细胞有较好的抑制作用[15],而炎症与癌症的产生往往存在先后顺序[16]。这也提示我们,研究小蓟提取物的抗炎作用有很大的意义。古籍中记载小蓟能“凉血止血”,在历史上小蓟也多用于治疗血流不止。而止血与现代医学凝血的概念类似,现代医学认为凝血其基本过程是一系列蛋白质的有限水解过程,大体上分为三个阶段,凝血酶原激活物形成、凝血酶形成、纤维蛋白形成,其中凝血酶原的形成是整个凝血过程的重要一步(在体内需要维生素K参与)。
本实验选取凝血酶原作为检测指标,以维生素K3作为西阳对照组,小蓟不同部位提取物对指标的影响也就反映了其对促进凝血的效果,数值越大,产生的促凝血指标物质的量与阳性药维生素K3越接近。体外药效结果显示,小蓟花的抗炎效果最好,小蓟根也有一定的效果。而凝血酶原(PT)试剂盒的结果表明,小蓟花的促凝血效果最好,除西阳组外,产生的指标物质最多,小蓟叶也有一定的效果。试剂盒与体外实验结果说明,小蓟不同部位化学成分种类与含量的差异是导致药效有区别的原因。灰色关联度计算软件的结果显示,绿原酸、橙皮苷、咖啡酸、蒙花苷等成分对小蓟提取物的体外抗炎效果与影响凝血酶原指标的产生贡献程度与其他成分相比较大并存在差异。植物化学研究表明,小蓟主要含有黄酮类、酚酸类以及甾醇类化合物。其中,黄酮类成分是影响其药理学活性的主要因素。现代药理学和临床研究表明小蓟中的一些成分具有止血、抗炎、抗肿瘤、抗微生物等作用。其中绿原酸、咖啡酸可以通过影响NF-κB信号通路,减少炎症介质的释放。蒙花苷能缓解血管内皮细胞炎症损伤,橙皮苷通过降低毛细管脆性,有保护毛细血管的作用[17-20]。本实验的灰色关联数据结果也佐证了小蓟黄酮类物质的现代药理学研究。
中药的现代化已经实践多年,成果显著。随着分析与检测手段的不断进步,对于传统理论的科学解释也越来越丰富[21-23]。研究中药不同部位的使用,为中药的现代化打开了一个新的思路。本实验为小蓟药材不同药用部位的合理使用提供了一个科学的依据及分析方法,也为提高小蓟药材的治疗效果提供了一个理论支持。

