中药茜草抗氧化、抗炎、抗肿瘤不同药用部位精准研究*
李 慧,包永睿,王 帅,李天娇,孟宪生
(1.辽宁中医药大学药学院 大连 116600;2.辽宁省组分中药工程技术研究中心 大连 116600;3.辽宁省现代中药研究工程实验室 大连 116600)
茜草为茜草科植物茜草Rubia cordifolia L.的干燥根及根茎[1]。现代药理研究表明茜草有效成分具有抗炎、抗癌、抗氧化、止血、抗菌等多种药理作用[2-6],临床应用广泛。现代研究多集中于茜草根的化学成分及其药理药效研究,有关茜草茎、叶、花的研究鲜有报道。有研究表明茜草叶富含氨基酸多糖,籽实富含天冬氨酸,含量分别是白洋参的4.2倍、野生人参的1.8倍、西洋参的2.3倍,有很大开发价值[7,8],以茜草藤为主药的中成药“儿泻停”,治疗小儿腹泻极为有效[9],故茜草的地上部分同样具有研究价值。目前对于茜草地上部分的研究,多以地上全草的化学成分及药理药效研究为主[10],对其地上部分即茎、叶、花、果实的系统研究较少,故本实验开展了基于抗氧化、抗炎、抗肿瘤三种药效的茜草根、茎、叶、花及果实的精准研究,旨在对各药用部位精准、系统分析,从而明确其各药用部位所对应的精准药效及其药效物质基础,实现茜草各药用部位的精准应用,扩大茜草的药用部位,为茜草资源的开发及临床合理应用提供参考。
1 材料与方法
1.1 药材与试剂
茜草全株自采于大连市童牛岭风景区,经辽宁中医药大学药用植物教研室许亮教授鉴定为Rubia cordifolia L.;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二 铵 盐(ABTS)试 剂(批 号 :F1813046,Aladdin Industrial Corporation);2,2-联苯基-1-苦基肼基(DPPH)试剂(批号:E1831033,Aladdin Industrial Corporation);脂多糖(LPS)(批号:813Q031),北京索莱宝科技有限公司);一氧化氮(NO)检测试剂盒(批号:J20180923EE,上海朗顿生物科技有限公司);鼠白细胞介素6(IL-6)检测试剂盒(批号:G20180926GH,上海朗顿生物科技有限公司);抗坏血酸(VC)(分析纯,天津市科密欧化学试剂有限公司);4-叔丁基茴香醚(BHA)(批号:507C051,北京索莱宝科技有限公司);绿原酸对照品(批号:110753-201415,中国食品药品检定研究所),异牡荆素、云香柚皮苷、槲皮苷、新橙皮苷、山奈酚、茜草素、羟基茜草素、大叶茜草素对照品品均购自成都普菲德生物技术有限公司,批号分别为140924、 16072904、 151016、 150121、 17011305、17112309、17011011、18030107;异槲皮苷、大黄酸(批号:16040703、131024,四川省维克奇生物科技有限公司),大黄酚对照品(批号:796-9302,中国生物制品检定所);乙腈为色谱纯(Tedia公司),磷酸为分析纯(天津市科密欧化学试剂有限公司),试验用水为纯净水(娃哈哈纯净水有限公司)。
1.2 细胞株
小鼠单核巨噬细胞RAW264.7细胞株,人肝癌HepG2细胞株均购自齐氏生物科技有限公司。
1.3 仪器与设备
Agilent-1100高效液相色谱仪(美国Agilent科技公司);US AUTOFLOW型CO2培养箱(德国NUAIRE公司);Sartorius CP225D型电子分析天平(北京赛多利斯天平有限公司);SUNRI SE酶标仪(瑞士TECAN公司);真空干燥箱(上海一恒科学仪器有限公司)。
1.4 茜草不同部位HPLC指纹图谱的建立
1.4.1 色谱条件
色谱柱:Poroshell 120 SB-C18色谱柱(100 mm×4.6 mm,2.7 μm);流动相:0.1%磷酸水溶液(A)-乙腈(B)为流动相,梯度洗脱(0-15 min,5%-28%B;15-20 min,28%-30%B;20-25 min,30%-70%B;25-30 min,70%-75%B;30-40 min,75%-85%B;体积流量为1.0 mL·min-1;柱温为30℃;进样量为5 μL,检测波长为254 nm。
1.4.2 样品制备
称取茜草根、茎、叶、花及果实粉末约(过二号筛)5.00 g,精密称定,置具塞锥形瓶中,精密加入体积分数为60%乙醇溶液50 mL,密塞,称定重量,水浴加热回流提取1 h,室温条件下取续滤液适量,过0.22 μm滤膜,即得样品溶液,取5 μL注入高效液相色谱仪进行分析,各样品剩余滤液分别量取30 mL,真空干燥制备成干膏备用。茜草根、茎、叶、花及果的干膏得率分别为12.0%、11.2%、15.3%、13.6%及18.2%。
1.4.3 对照品制备
称取茜草素、大黄酸、羟基茜草素、大黄酚、大叶茜草素对照品适量,精密称定,加甲醇制成每1 mL含茜草素72 μg、大黄酸24.56 μg、羟基茜草素86.34 μg、大黄酚61.60 μg、大叶茜草素93.36 μg的混合对照品1溶液。称取绿原酸、异牡荆素、异槲皮苷、芸香柚皮苷、槲皮苷、新橙皮苷、山奈酚对照品适量,精密称定,加甲醇制成每1 mL含绿原酸52.67 μg、异牡荆素100.02、异槲皮苷69.00 μg、芸香柚皮苷42.06 μg、槲皮苷57.14 μg、新橙皮苷65.43 μg、山奈酚56.65的混合对照品2溶液。
1.5 抗氧化实验
1.5.1 DPPH方法
称取DPPH适量,精密称定,加甲醇制成质量浓度为0.400 mg·mL-1的DPPH母液,以甲醇稀释母液制备质量浓度为0.040 mg·mL-1的DPPH工作液备用。称取Vc对照品适量,精密称定,加甲醇制成质量浓度为0.800 mg·mL-1的Vc母液,依次稀释成质量浓度0.040、0.030、0.025、0.020、0.015、0.010 mg·mL-1的系列Vc对照溶液。称取根、茎、叶、花、果实醇提物适量,加甲醇制成质量浓度为2.000 mg·mL-1的样品溶液,分别稀释成质量浓度为0.031、0.063、0.125、0.250,0.125、0.500、1.000 mg·mL-1的系列样品溶液。取各样品溶液与DPPH工作液各75μL于96孔板等体积混合,在酶标仪517 nm处测定光密度(OD)值,每个样品平行做3个复孔,计算各样品清除率及茜草各部位EC50[11,12]。清除率(%)=[(A空白-A样品)/A空白]×100%。
1.5.2 ABTS方法
称取ABTS、K2S2O8适量,精密称定,加纯水制成浓度分别为 7 mmoL·mL-1、2.45 mmoL·mL-1的 ABTS、K2S2O8溶液,将两溶液等体积混合,置于室温避光孵育12h,即得ABTS+基液。以纯水稀释基液,使其734 nm处吸光度在0.7-0.8之间,制成ABTS+工作液。称取BHA对照品适量,精密称定,加甲醇制成质量浓度为0.200 mg·mL-1的BHA对照品母液,依次稀释成质量浓度0.244、0.488、0.977、1.953、3.906、7.812 μg·mL-1的系列对照溶液。称取根、茎、叶、花、果实醇提物适量,加甲醇制成质量浓度为2.000 mg·mL-1的样品溶液,分别稀释成质量浓度为 0.031、0.063、0.125、0.25,0.125、0.500、1.000 mg·mL-1的系列样品溶液。取各样品溶液50 μL 与工作液 150 μL 于 96孔板混合,避光反应6 min,在酶标仪734 nm处测定光密度(OD)值,每个样品平行做3个复孔,计算各样品清除率及茜草各部位醇提物EC50[13-15]。
1.6 抗炎实验
1.6.1 细胞培养
将RAW264.7细胞,在37℃,5%CO2条件下,用含10%胎牛血清、1%青霉素/链霉素的DMEM培养液传代培养,取对数生长的细胞进行后续试验[16]。
1.6.2 MTT法检测RAW264.7细胞活力
调整RAW264.7细胞悬液密度,使其密度为6×104·mL-1,接种于96孔板内,每孔100 μL。分别设置调零孔、空白对照孔(细胞+培养基)、茜草提取物组(药液质量浓度为20、50、100、200、400 μg·mL-1),每组设定4个复孔。加药后,将96孔板放置于37℃、5%CO2培养箱中培养24 h,弃上清,向每孔加入质量浓度为5 mg·mL-1的MTT溶液20 μL,继续孵育4 h后,吸去上清液,每孔加入二甲基亚砜(DMSO)150 μL,低速振荡10 min后,在酶标仪490 nm处测量各孔的OD值,细胞活力(%)=(试验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,筛选出对细胞活力无明显影响的药液浓度进行之后的实验[17]。
1.6.3 ILISA法检测NO和IL-6含量
将RAW246.7细胞接种于96孔板内,调整细胞密度为1 × 105·mL-1,每孔100 μL,分别设置正常组、LPS组、LPS+茜草各部位醇提物组,每组4个复孔。待细胞贴壁后,正常组每孔加入培养液200 μL,LPS组每孔加入培养液180 μL、LPS溶液20 μL,给药组每孔加入药液(质量浓度200 μg·mL-1)180 μL、LPS溶液20 μL,其中LPS组与LPS+茜草各部位醇提物组中LPS终浓度为500 ng·mL-1。在37℃、5%CO2培养箱中培养24 h后,收集各组上清液,按说明书检测TNF-α和IL-6的水平,具体操作按试剂盒说明书进行[18]。
1.7 抗肝肿瘤实验
人肝癌HepG2细胞,常规培养于10%胎牛血清的DMEM培养液中,取对数生长期细胞,以5×103·mL-1接种于96孔培养板。根据前期预实验结果配制质量浓度为1.00 mg·mL-1的待测样品溶液及质量浓度为5 μg·mL-1的顺铂溶液,待细胞贴壁后加入各待测样品溶液200 μL,每个样品平行做4个复孔,分为阳性药组,空白对照组,茜草不同部位醇提物给药组。药物作用24 h后,在酶标仪490 nm处,测定各孔光密度(OD)值,并计算抑制率。抑制率(%)=[(对照组平均OD值-实验组平均OD值)/(对照组平均OD值-空白对照组平均OD值)]×100%。
1.8 统计学方法
采用ELISAcalc软件计算NO、IL-6含量,拟合模型选用logistic曲线(四参数)模型;采用SPSS21.0软件进行统计分析,组间比较采用ANOVA单因素方差分析,其中P<0.05为差异有统计学意义,P>0.05为差异无统计学意义,结果以形式表示。
2 结果与分析
2.1 HPLC指纹图谱的建立
将茜草根、茎、叶、花、果实、混合对照品1和混合对照品2指纹图谱文件导入软件“中药色谱指纹图谱相似度评价系统”(2012A版),得到谱图,如图1所示。共标定31个色谱峰,从图中可以看出根与茎、叶、花、果之间的色谱峰数量和峰面积差异较大,茎、叶、花、果之间差异较小,茜草根的色谱峰数最多,茎的色谱峰数最少。经化学对照品比对出12种化学成分,分别是5-绿原酸、11-异牡荆素、12-异槲皮苷、15-芸香柚皮苷、18-槲皮苷、19-新橙皮苷、22-山奈酚、23-茜草素、24-大黄酸、25-羟基茜草素、29-大黄酚、31-大叶茜草素(图1,图2)。
2.2 抗氧化活性
2.2.1 DPPH法
DPPH法测定茜草根、茎、叶、花、果醇提物清除自由基能力结果(表1)。随着茜草提取物质量浓度的增加,DPPH自由基清除率也随之增加,经SPSS21.0 Probit分析,计算出各部位EC50值,顺序为果>根>茎>叶>花,即茜草不同部位清除DPPH自由基顺序为:花>叶>茎>根>果实;采用SPSS21.0软件进行方差分析,各组间比较差异有统计学意义(P<0.05)。
2.2.2 ABTS法
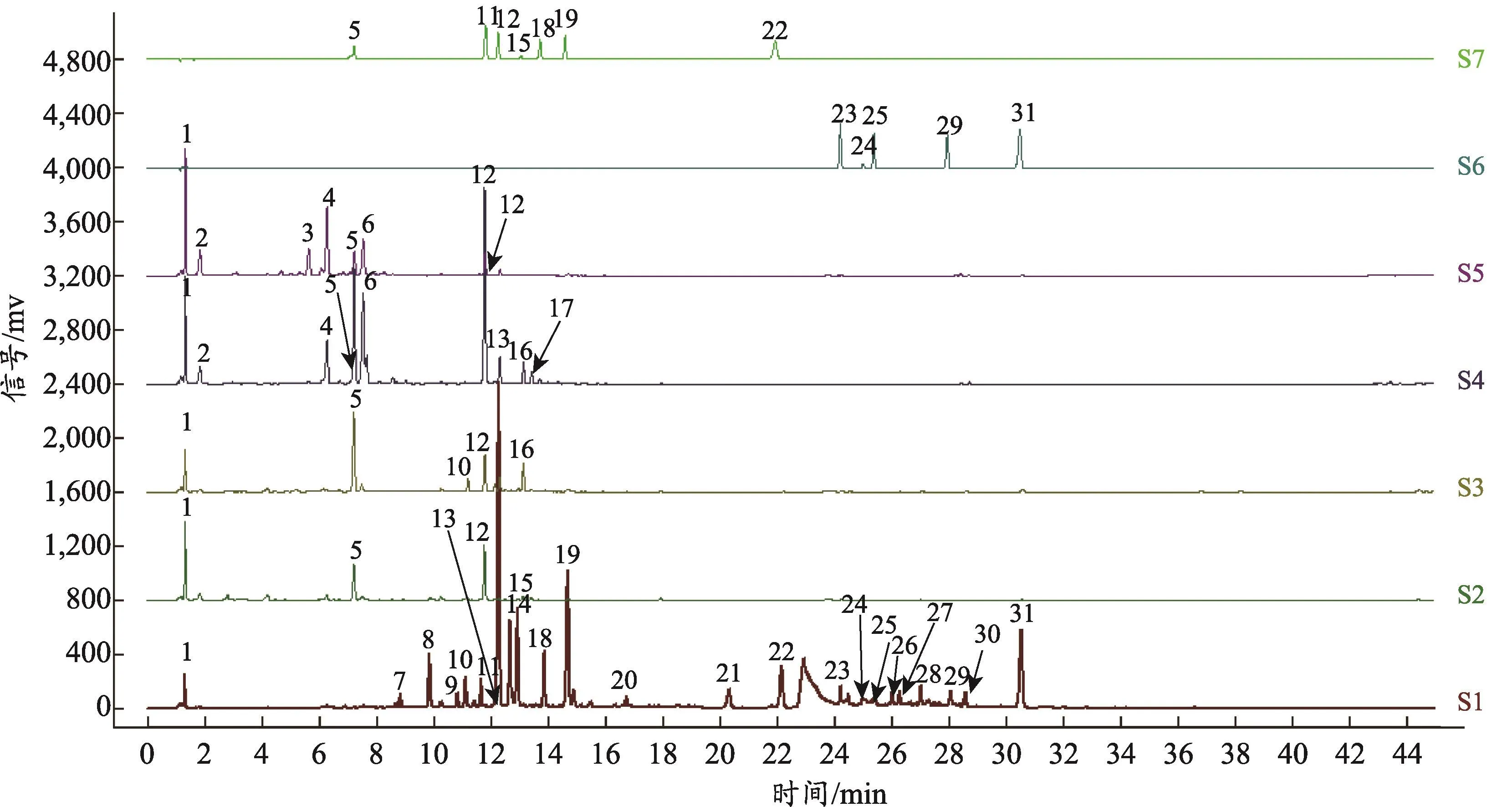
图1 茜草根、茎、叶、花、果HPLC指纹图谱
图2 混合对照品图
ABTS法测定茜草不同部位醇提物清除自由基能力结果(表1)。随着茜草提取物质量浓度的增加,ABTS自由基清除率也随之增加,经SPSS21.0 Probit分析,计算出各部位EC50值,顺序为果>根>茎>叶>花,即茜草不同部位清除DPPH自由基顺序为:花>叶>茎>根>果实;采用SPSS21.0软件进行方差分析,各组间比较差异有统计学意义(P<0.05)。
2.3 抗炎活性
2.3.1 细胞活力测定结果
茜草根、茎、叶、花、果醇提物对RAW246.7细胞的活力的影响(图3)。作用时间24 h,药液质量浓度0.013-0.200 mg·mL-1的范围内,各组细胞存活率超过80%,细胞活力无明显影响,故选择药液浓度0.200 mg·mL-1进行后续实验研究。
2.3.2 NO和IL-6含量
经ELISAcalc软件进行计算,logistic曲线(四参数)模型拟合。NO标准曲线拟合方程为:方程:y=(1.697909-0.954709)/[1+(x/11.557466)^1.239991]+0.954709,其中r2=0.999161,IL-6标准曲线拟合方程为:方程:y=(2.693269-0.284933)/[1+(x/33.841778)^1.201142]+0.284933,其中r2=0.991902。最终计算结果如表2所示,正常组细胞上清液中NO、IL-6分泌较少,给予500 ng·mL-1LPS刺激24 h后,NO、IL-6、TNF-α分泌均显著增加(P <0.01),茜草根、茎、叶给药组中NO、IL-6的分泌则受到明显抑制(P<0.05)。茜草根对炎症因子分泌抑制作用最显著,抗炎效果最好,果的抗炎效果最差。其中对于NO分泌的抑制作用,茎、花差异无统计学意义(P=0.294),对于IL-6分泌的抑制作用,各部位相互比较,差异有统计学意义(P < 0.05)。
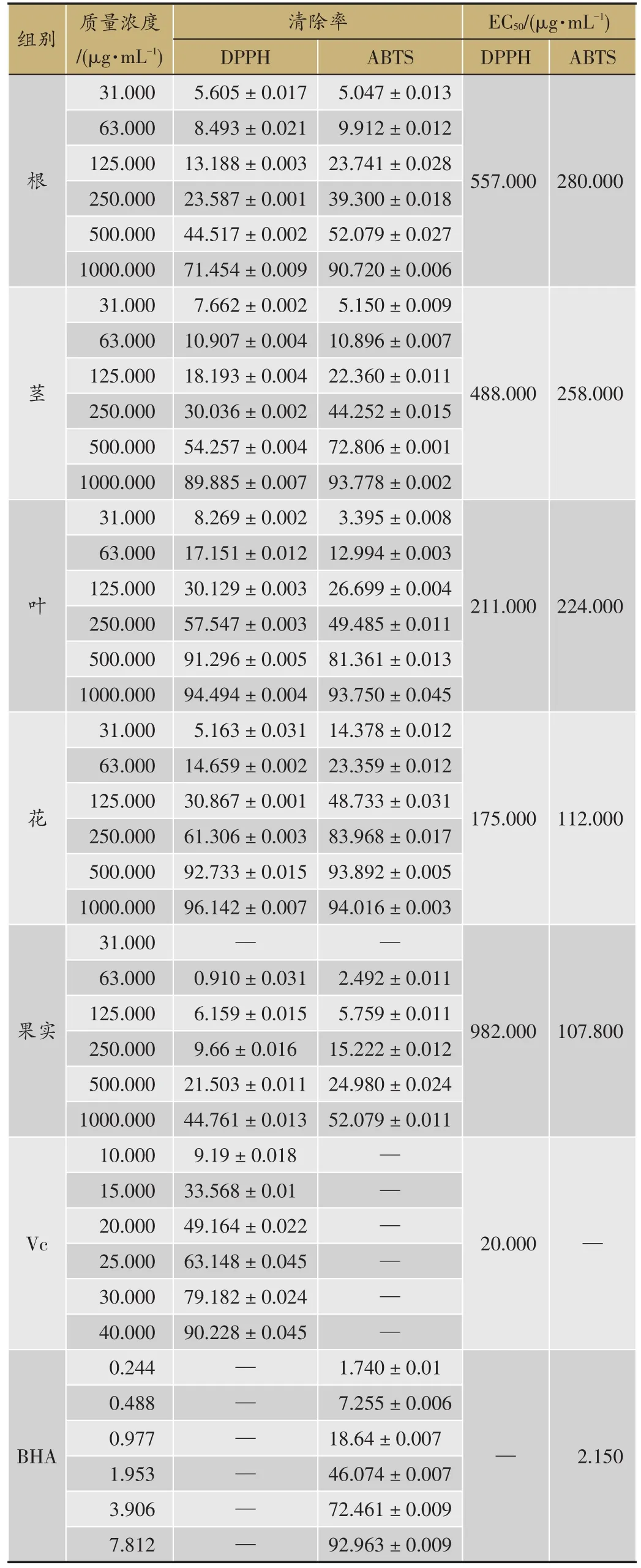
表1 DPPH、ABTS法测定茜草不同部位醇提物清除自由基能力(清除率/%,xˉ±S,n=3)
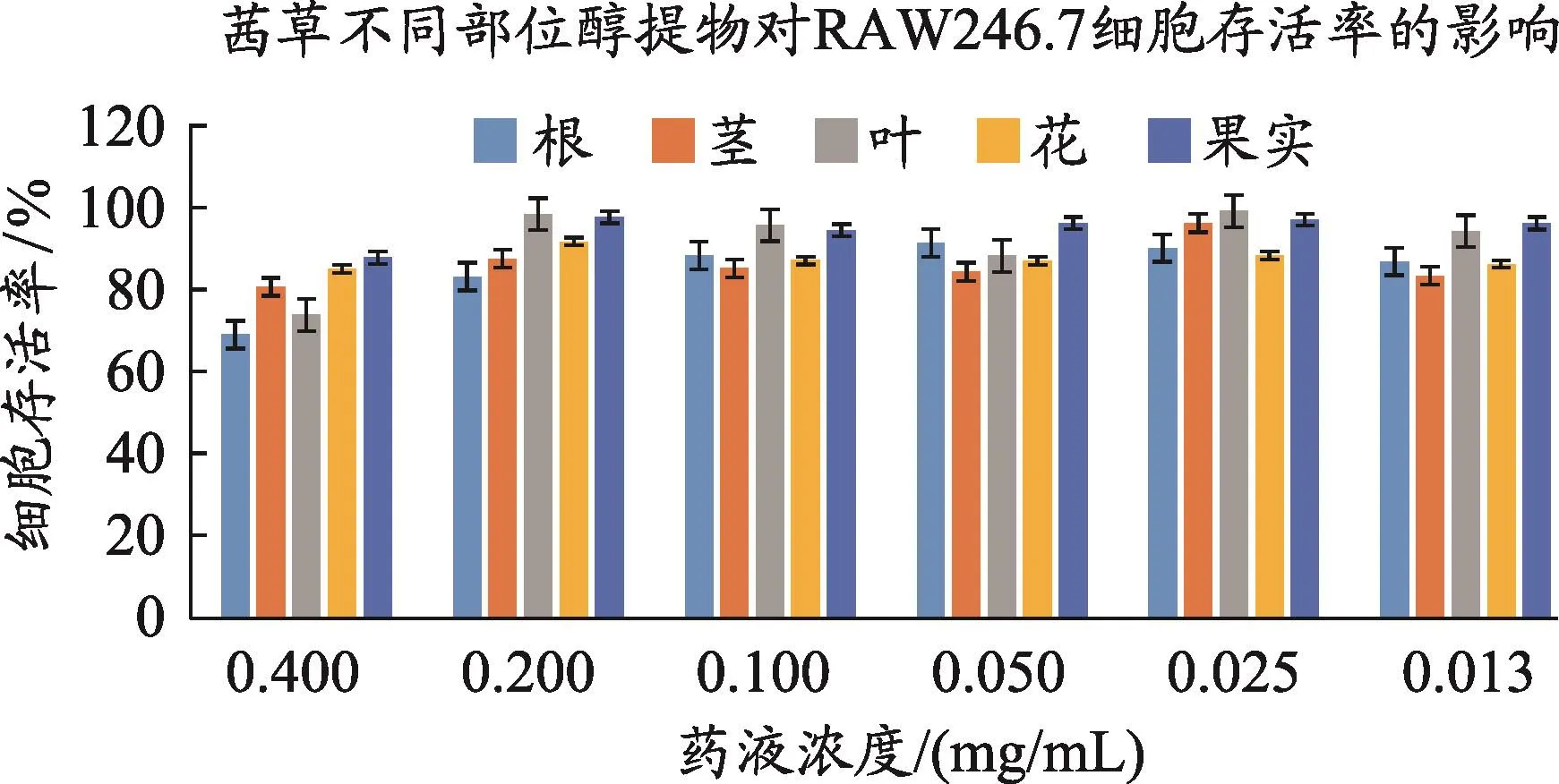
图3 茜草不同部位醇提物对RAW246.7细胞活力的影响
表2 茜草不同部位醇提物对NO、IL-6表达的影响(S ,n=3)
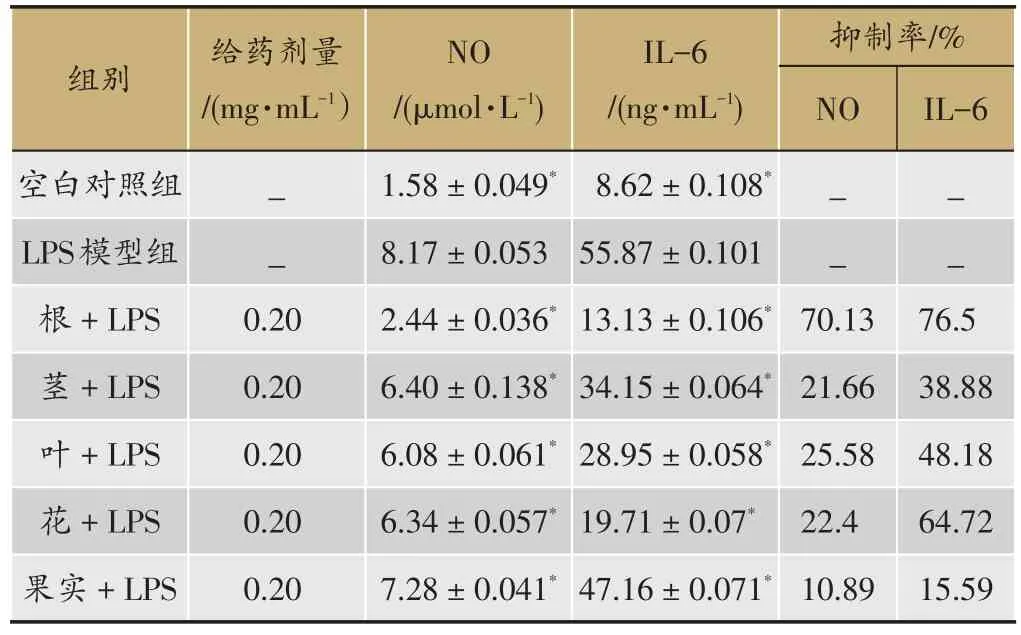
表2 茜草不同部位醇提物对NO、IL-6表达的影响(S ,n=3)
注:与LPS模型组比较:*P<0.05
组别给药剂量/(mg·mL-1)抑制率/%NO_ __ __ _76.5 38.88 48.18 64.72 15.59空白对照组LPS模型组根+LPS茎+LPS叶+LPS花+LPS果实+LPS 0.20 0.20 0.20 0.20 0.20 NO/(μmol·L-1)1.58±0.049*8.17±0.053 2.44±0.036*6.40±0.138*6.08±0.061*6.34±0.057*7.28±0.041*IL-6/(ng·mL-1)8.62±0.108*55.87±0.101 13.13±0.106*34.15±0.064*28.95±0.058*19.71±0.07*47.16±0.071*70.13 21.66 25.58 22.4 10.89 IL-6
表3 茜草不同部位醇提物对HepG2细胞的增殖抑制作用(S,n=4)
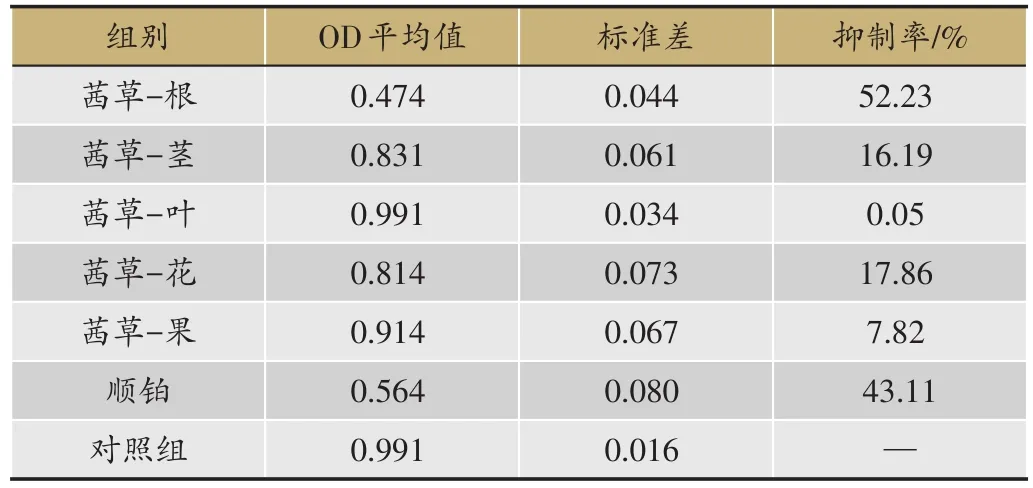
表3 茜草不同部位醇提物对HepG2细胞的增殖抑制作用(S,n=4)
注:与空白对照组比较:*P<0.05
抑制率/%52.23 16.19 0.05 17.86 7.82 43.11—组别茜草-根茜草-茎茜草-叶茜草-花茜草-果顺铂对照组OD平均值0.474 0.831 0.991 0.814 0.914 0.564 0.991标准差0.044 0.061 0.034 0.073 0.067 0.080 0.016
2.4 抗肝肿瘤活性
采用MTT法,检测茜草根、茎、叶、花、果醇提物对肝肿瘤细胞的增殖抑制作用(表3)。从表中可以看出,茜草根提取物对肿瘤细胞的抑制作用最强,其次是花、茎、果实,叶对HepG2细胞无抑制作用(P>0.05)。
3 讨论
茜草作为一味传统中药,始载于《神农本草经》,并将其列为上品,各本草典籍对于其入药部位的描述以根居多[19]。除古书记载,现代研究也集中于根的化学成分及药理药效研究,对于茜草地上部分的研究较少。虽有相关文献报道地上部分的化学成分[20],但均是针对全草分析,未对地上部分即茎、叶、花、果进行区分研究。然而,不同的部位所含的化学成分群必然存在差异会导致药效的差异[21],所以,针对不同的药效评价,应精准地选择中药用药部位,这样既可以减少用药量,还能增强治疗效果。故本课题组提出精准生药学概念,精准生药学是研究生药采收时间、用药部位化学成分差异和不同病症疗效关系的一门交叉学科,是生药学前瞻性的分支。
本实验首先建立了茜草根、茎、叶、花、果醇提取物的高效液相纹图谱,结果发现各部位指纹图谱色谱图峰数量和峰面积存在较大差异,即化学成分的种类及含量有差异,通过化学对照品比对共鉴定出12种成分,包括黄酮及酚酸类7种,醌类5种,其中黄酮类成分与蒽醌类成分在图谱中区分明显,其中茜草根中所含醌类成分较多,茎、叶、花、果中几乎不含有醌类成分,多为黄酮及酚酸类成分。之后进行药效学评价,有文献报道自由基能够降低细胞内抗氧化酶活性,造成活性氧的浓度增加,促进肿瘤的发生,而慢性炎症在癌症的发展中同样起促进作用[22-23],因此自由基、炎症及肿瘤三者之间存在一定关联性。故本实验进行茜草根、茎、叶、花、果醇提物抗氧化、抗炎及抗肿瘤实验,抗氧化实验结果表明DPPH法与ABTS法结果一致,抗氧化活性顺序均是花、叶、茎、根、果实,经统计学分析,各组间差异有统计学意义;抗炎实验表明茜草根对于炎症因子NO及IL-6分泌抑制作用最明显,差异有统计学意义;抗肝肿瘤实验表明茜草根的效果最好,差异有统计学意义,故笔者推测其抗炎及抗肿瘤药效与其醌类成分密切相关,醌类成分对于炎症及肿瘤的作用靶点可能相似。
综上,茜草根、茎、叶、花、果实化学成分群存在差异,差异的化学成分群是茜草不同部位抗氧化、抗炎、抗肿瘤药效显著差异的重要因素。本实验明确了茜草花、叶的抗氧化作用较好,根的抗炎、抗肿瘤效果最好,故建议抗氧化选择茜草花和茜草叶,抗炎、抗肿瘤选择茜草根。本实验基于抗氧化、抗炎、抗肿瘤药效对茜草不同部位进行了精准研究,为茜草资源的开发及合理应用提供科学依据。

