甲基苯丙胺对体外培养SH-SY5Y细胞线粒体膜电位、超微结构及Mfn1、Fis1蛋白表达的影响
牟登峰,郑 丹,王 琪,黄仕美,官志忠,于燕妮,楼迪栋
(1. 贵州医科大学法医学院法医病理学教研室;2. 贵阳妇幼保健院围产期保健科;3. 贵州医科大学地方病与少数民族疾病教育部重点实验室,贵州 贵阳 550004)
甲基苯丙胺(methamphetamine,METH)属于苯丙胺类神经兴奋剂(amphetamine-typed stimulant,ATS),俗称“冰毒”,它具有药物依赖、中枢神经兴奋性、致幻、食欲抑制和拟交感效应等药理、毒理学特性[1]。目前,METH的神经毒性作用的损伤学说主要有以下几种:神经元凋亡、炎症反应、氧化应激、线粒体功能紊乱等[2-4]。其中,线粒体功能及凋亡通路与METH的致病机制越来越受到学者关注。有研究认为,线粒体分裂过度或融合不足都会导致线粒体碎裂,降低呼吸作用和能量生产,增加神经元损伤和细胞凋亡的可能性[5]。线粒体分裂蛋白1(Fission 1,Fis1)的过度表达可以导致线粒体分裂,造成线粒体功能障碍,导致细胞凋亡,药物抑制分裂可以减轻细胞凋亡[6]。在METH研究中,蒋雷等[7]发现,METH处理后,短时间内神经细胞线粒体膜电位(mitochondrial membrane potential, MMP)下降,膜通透性转运孔道异常开放,Bax水平上调,继而激活caspase-3凋亡蛋白,导致神经元损伤。目前,有越来越多的研究者关注METH致神经细胞毒性与线粒体功能紊乱之间的关系,但相关机制还未阐明。本实验拟通过METH作用于体外培养的人神经母细胞瘤细胞株(human neuroblastoma cells,SH-SY5Y cells),观察MMP水平、线粒体超微结构及线粒体融合蛋白1(mitofusion 1,Mfn1)和Fis1蛋白表达水平,探索线粒体在METH致体外培养SH-SY5Y细胞损伤中的作用。
1 材料与方法
1.1 细胞株人神经母细胞瘤细胞株SH-SY5Y,购自美国Sigma公司。
1.2 试剂与仪器METH(美国Cerilliant公司,标准品编号:M-009,纯度:99.9%);胎牛血清(FBS,美国BI公司);CCK-8细胞增殖-毒性检测试剂盒(东仁化学科技有限公司);JC-1线粒体膜电位检测试剂盒(上海碧云天公司);兔抗人Mfn1单克隆抗体、兔抗人Fis1单克隆抗体(美国Abmart公司);兔抗人β-actin抗体(美国Gene Tex公司)。恒温细胞培养箱(美国Thermo公司);ELX800UV酶标仪、化学发光成像系统(美国Bio-Rad公司);DMi8型倒置显微镜(德国Leica公司);H-7650型透射电镜(日本Hitachi公司)。
1.3 CCK-8法检测细胞增殖将体外培养的SH-SY5Y细胞制成细胞悬液,按1×104/孔的密度接种于96孔板中,置37 ℃、5% CO2培养箱中培养,待细胞贴壁长至60%~70%时,换含有METH(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mmol·L-1)的培养液培养,时间为3、6、12、24 h,每组3个复孔。向每孔加入10 μL CCK-8溶液,将培养板在培养箱中孵育3 h后,用酶标仪测定450 nm处的吸光度(OD)值,并计算细胞存活率。细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%,取细胞存活率较高的METH处理组进行实验。采用成组设计,在含SH-SY5Y细胞的培养液中加入不同浓度的METH(0.0、1.0、1.5、2.0 mmol·L-1),浓度的选择参照文献[8]以及CCK-8实验结果,培养时间分别为3、6、12、24 h。
1.4 JC-1法检测MMP按照试剂盒说明书操作。使用倒置荧光显微镜观察METH处理SH-SY5Y细胞3、6、12、24 h后的各组细胞的红、绿荧光,计算机采集荧光图像,使用Image J软件重叠红绿荧光,将合成荧光的光密度比值作为膜电位表达水平值。
1.5 透射电镜观察SH-SY5Y细胞线粒体超微结构收集细胞;将细胞固定于2.5%戊二醛溶液中4 h(4 ℃),0.1 mol·L-1PBS漂洗;1%锇酸溶液后固定2 h(4 ℃),0.1 mol·L-1PBS漂洗;丙酮脱水;Epon812树脂包埋;切片;醋酸铀、硝酸铅染色;上机观察。
1.6 Western blot法检测Mfn1和Fis1蛋白表达水平收集METH处理SH-SY5Y细胞3、6、12、24 h后的各组样本,使用RIPA裂解细胞提取总蛋白,超微量紫外分光光度计检测各样本蛋白浓度。经12%聚丙烯酰胺凝胶电泳分离蛋白、转膜、室温封闭2 h后,使用Mfn1(1 ∶1 500)、Fis1(1 ∶2 000)、β-actin(1 ∶5 000)一抗4 ℃孵育过夜,二抗(1 ∶10 000)室温孵育1 h。将PVDF膜与超敏发光液(ECL)试剂反应1 min后,使用化学发光成像系统扫描PVDF膜,Image J软件分析Mfn1和Fis1蛋白条带,使用β-actin蛋白条带校正。
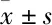
2 结果
2.1 CCK-8法检测结果如Fig 1所示,使用不同浓度的METH处理SH-SY5Y细胞3、6、12、24 h后,METH抑制SH-SY5Y细胞增殖,SH-SY5Y细胞存活率随METH浓度和作用时间的增加而减小。由于METH浓度>2.0 mmol·L-1时,对应的SH-SY5Y细胞存活率较小,故选取1.0、1.5、2.0 mmol·L-1METH处理组作为实验对象。

Fig 1 Effect of METH on survival rate of SH-SY5Y
2.2 SH-SY5Y细胞MMP水平Tab 1结果显示,与对照组比较,各METH处理组MMP红、绿荧光比值呈明显降低趋势。在荧光显微镜下,红色荧光除个别细胞较强外,随METH浓度升高主要呈下降趋势;绿色荧光强度随METH浓度升高主要呈上升趋势(Fig 2)。
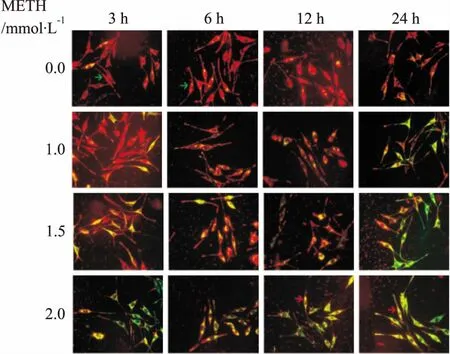
Fig 2 MMP in SH-SY5Y cells cultured in vitro detected by the red-green overlapping fluorescence(×400)
Green arrows indicate the normal MMP, while red arrows indicate the decreased MMP.
2.3 METH对SH-SY5Y细胞线粒体超微结构的影响如Fig 3所示,透射电镜下观察对照组SH-SY5Y细胞线粒体呈椭圆形棒状双层膜结构,线粒体嵴正常、清晰;低METH组(1.0 mmol·L-1)SH-SY5Y细胞线粒体膜结构尚完整,部分嵴出现肿胀及断裂;高METH组(2.0 mmol·L-1)SH-SY5Y细胞线粒体内外膜可见破损,线粒体嵴扭曲变形且大量减少或消失,部分空泡化;低、高METH组SH-SY5Y细胞线粒体椭圆形棒状结构减少,小球状结构随之增加。此外,高METH组发现典型的线粒体自噬过程(Fig 4)。

Tab 1 MMP red-green overlapping fluorescence ratio of SH-SY5Y cells cultured in vitro between control group and METH treatment
*P<0.05vscontrol
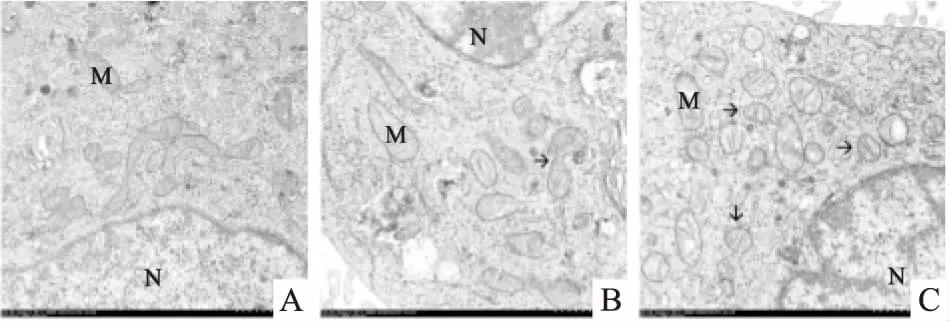
Fig 3 Observation of mitochondrial ultrastructure of SH-SY5Y cells by TEM(×4 000)
A: Control group, mitochondria elliptical rod-like structure, normal and clear; B: Low METH group, the mitochondrial elliptical structure splitting into a small spherical structure(arrows); C: High METH group, the mitochondrial globular structure significantly increased(arrows). M: mitochondria; N: nuclei.

Fig 4 Observation of mitochondrial autophagy in SH-SY5Y cells treated with 2.0 mmol·L-1 METH by TEM(A,B: ×8 000; C: ×7 000)
A: Phagocytic vacuoles(arrows) of a nearly spherical double-layered lipid structure, lysosomes of single-layer structure(shown by double arrows); B: Phagocytic vesicles envelop the mitochondria to form mitochondrial autophagy bodies(arrows);C: The lysosome and the autophagosome fuse to form a single-layer structure of autophagosomes(arrows), and the autolysosomal lysosome encapsulates the substance to be dissolved. The substance to be decomposed is deep in degradation, and the substance morphology is difficult to distinguish. M: mitochondria; ER: endoplasmic reticulum.
2.4 METH对Mfn1蛋白表达的影响如Fig 5所示,与对照组比较,METH作用SH-SY5Y细胞3、12、24 h时,Mfn1蛋白表达均降低(P<0.05);与对照组比较,METH作用SH-SY5Y细胞6 h时,METH(1.5、2.0 mmol·L-1)处理组Mfn1蛋白表达水平均降低(P<0.05)。相同时间内,随着METH浓度的升高,Mfn1蛋白表达水平呈降低趋势;与相同浓度的METH处理3 h比较,处理12 h时Mfn1蛋白表达呈下降趋势。
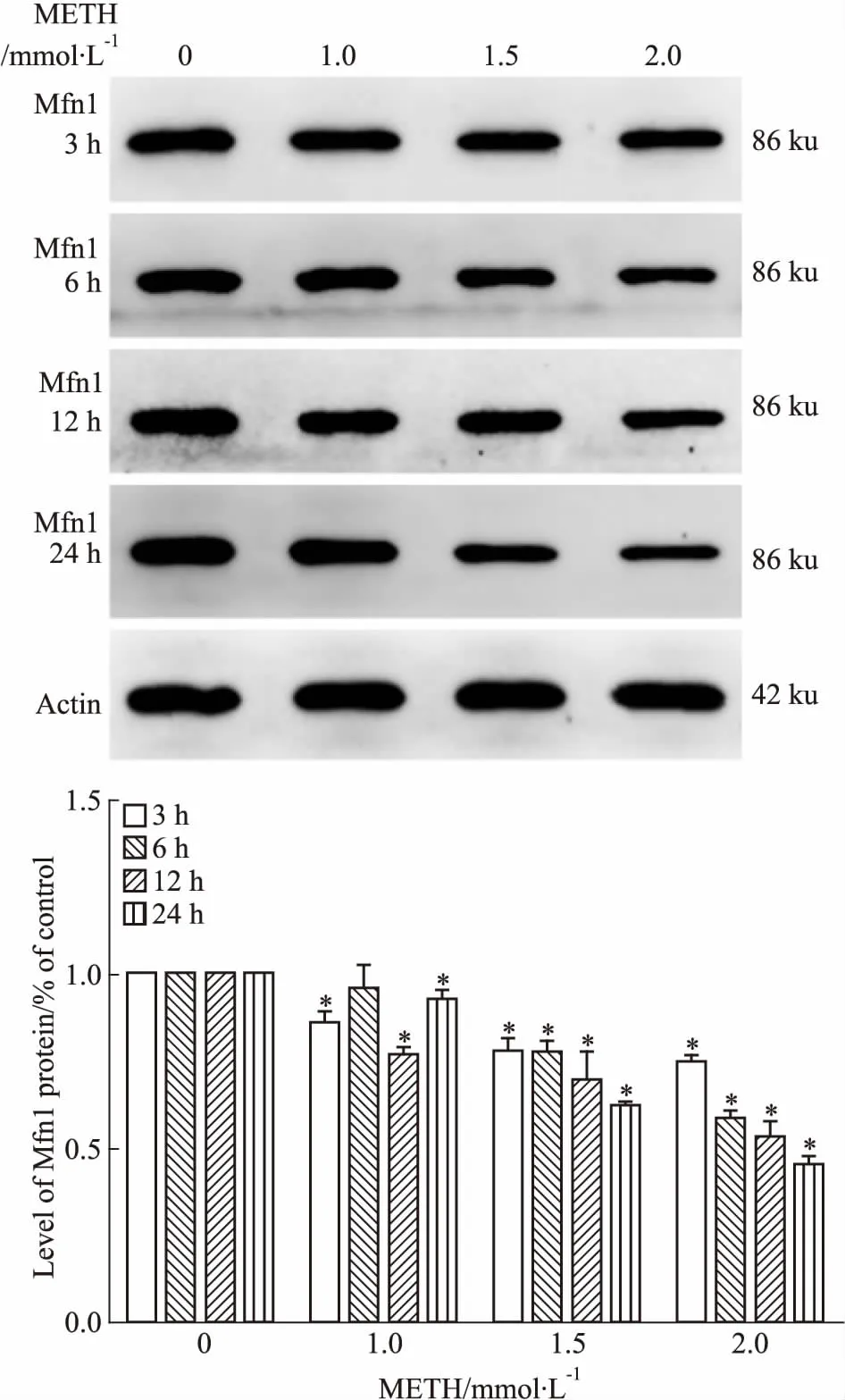
Fig 5 Expression of Mfn1 protein in SH-SY5Y
*P<0.05vscontrol
2.5 METH对Fis1蛋白表达的影响如Fig 6所示,与对照组比较,METH作用SH-SY5Y细胞3、24 h时,Fis1蛋白表达均升高(P<0.05);与对照组比较,METH作用SH-SY5Y细胞6、12 h时,METH(1.5、2.0 mmol·L-1)处理组Fis1蛋白表达水平升高(P<0.05)。相同时间内,随着METH浓度的升高,Fis1蛋白表达水平呈升高趋势;与相同浓度的METH处理3 h比较,处理24 h时Fis1蛋白表达呈上升趋势。

Fig 6 Expression of Fis1 protein in SH-SY5Y
*P<0.05vscontrol
3 讨论
METH具有极强的精神兴奋和致幻作用,长期滥用者甚至会出现精神障碍,METH的致病机制急待探明。研究认为,METH的离子化学特性可改变电子传递链(electron transport chain,ETC)电化学梯度,可影响ATP酶的活性和线粒体膜的完整性[9]。但线粒体形态及功能在METH致神经细胞损伤中的作用仍未阐明。本研究拟通过METH处理SH-SY5Y细胞,观察线粒体融合与分裂功能及其相应的形态学改变,观察线粒体在其发病机制中的作用。
实验发现,体外培养的SH-SY5Y细胞经METH处理后,MMP降低,且与METH的浓度和作用时间有依赖性。而MMP下降是细胞凋亡的一个早期标志[10],可能是我们实验中METH致SH-SY5Y细胞凋亡的早期信号。我们推测,当线粒体受到METH作用时,线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)持续开放,允许小分子通过,使膜两侧的离子梯度改变,导致线粒体膜电位下降[11-12],并且允许线粒体内的细胞色素C释放至细胞质,启动细胞凋亡[13]。
同时研究认为,MMP改变会引起细胞线粒体形态改变。其形态调节受线粒体动态调节蛋白控制,分别为线粒体融合蛋白和分裂蛋白,其中Mfn1和Fis1是主要蛋白,此过程称为线粒体动态平衡调节[14-15],是保证膜结构完整的重要条件,也是维持正常膜电位,防止细胞凋亡的重要机制。我们观察发现,对照组线粒体超微结构正常;而METH处理组细胞线粒体呈小球状结构,线粒体内外膜破损、嵴破坏,出现吞噬清除损伤的线粒体现象。Twig等[16]认为,线粒体分裂产生两个不均匀的小体,健康膜部分有较高的膜电位,可再融合;受损膜部分膜电位较低,易被自噬体吞噬。本实验METH处理细胞表现与Twig等的研究结果基本一致。我们认为METH处理后,细胞内的MMP下降,启动线粒体分裂,将膜电位较低部分分裂清除,启动自噬。为进一步证明我们的推测,我们同时检测了Mfn1和Fis1蛋白表达水平,发现在SH-SY5Y细胞中,Mfn1蛋白表达量下降,Fis1蛋白表达量上升,且与METH处理时间和浓度相关,表明Mfn1和Fis1蛋白表达调节趋势与METH致细胞MMP下降及分裂现象相一致。这再次证实前面的推测。
综上所述,过量METH可能通过影响线粒体膜转运蛋白或线粒体膜,致体外培养的SH-SY5Y细胞MMP下降,线粒体趋向分裂,启动自噬和细胞凋亡;线粒体功能紊乱是METH致神经毒性的重要机制之一。