高乌甲素通过抑制小胶质细胞活化抑制炎症性疼痛
雷 宝,王生海,王正梅,宋延峰,杜彩霞,王 璐*
(1.延安大学医学院;2.延安市中医院麻醉科,陕西 延安 716000)
高乌甲素又名拉巴乌头碱(lappaconitine),是从毛茛科植物高乌头的根中提取的一种生物碱。氢溴酸高乌甲素具有较强的镇痛作用,另外还有抗炎消肿、降温解热与局部麻醉作用,镇痛强度是氨基比林的7倍,与哌替啶的镇痛效果相当[1]。研究表明高乌甲素在甲醛溶液、鹿角菜胶致炎及佐剂性关节炎3种炎症性疼痛模型中均有明显的镇痛作用[2]。然而,高乌甲素是对炎症性疼痛的阵痛作用的机制尚不清楚。近年来神经科学领域的研宄确切地证实了胶质细胞,尤其是星形胶质细胞和小胶质细胞在神经炎症和慢性痛中发挥重要的作用[3]。因此,本研究利用炎症性疼痛模型,研究脊髓中胶质细胞激活情况,进一步阐明对高乌甲素对炎症性疼痛的作用机制,为临床用药提供可靠的药理学依据。
1 材料与方法
1.1 实验动物
SD大鼠购于西安交通大学医学院动物实验中心。于温度(25.0±0.5℃)、相对湿度(50±5%)、明暗期(12/12h)的笼子里饲养,自由进食和饮水。大鼠给药前禁食不禁水12 h。
1.2 试剂
高乌甲素购于西安惠博生物科技有限公司。CFA(弗氏佐剂)购于Sigma 公司,GFAP单克隆抗体(abcam公司),OX-42单克隆抗体(abcam公司)。
1.3 模型制备、分组、取材
预处理组:单侧(左侧)足底注射完全弗氏佐剂(CFA)前一天开始分别尾静脉注射溶剂(生理盐水)或高乌甲素溶液(低剂量组2 mg/kg,高剂量组10 mg/kg),每天1次,连续5 d。分组:正常组,vehicle组,高乌甲素低剂量,高乌甲素高剂量组。取材部位:脊髓腰膨大L4-5段,取材前对大鼠经水合氯醛麻醉后,用生理盐水经心脏灌流冲净血液。后处理组:单侧(左侧)足底注射完全弗氏佐剂(CFA)后2 d,注射溶剂(生理盐水)或高乌甲素溶液(低剂量组2 mg/kg,高剂量组10 mg/kg),每天1次,连续5 d。分组同上。
1.4 行为学检测
行为检测前,各大鼠单独放在测试架上的有机玻璃笼中室温控制在25.0±0.5℃,适应环境至安静。
机械性刺激缩爪域值测定:按照Dixon等报道的方法[4],测试环境为10×20×20 cm有机玻璃笼,釆用0.6~20 g的Von-Frey尼龙纤维,垂直刺激动物后肢足掌中心部位。用一定强度的纤毛刺激,纤毛适度弯曲时计时,持续刺激时间为3 d,连续刺激5次,每次间隔5 s。纤毛刺激时,伴随着动物产生缩爪反应,则为有效反应(Positive respond);而5次刺激反应中,其中3次以上出现有效反应,则认为该纤毛的剌激强度为有效强度(Positive Intensity)反之,则为无效强度(Negative Intensity)。
热痛觉过敏测定:安静环境中,将大鼠放入福射热测痛仪的玻璃格子中,全身可以自由活动。待大鼠静置20 min后,用强光照射大鼠脚掌,测定大鼠的缩爪潜伏期(paw withdrawal latency ,PWL),每间隔10 min测定一次,取三次测定结果的平均值作为测定结果。
1.5 免疫荧光染色
脊髓腰膨大L4-5段组织经固定、脱水、包埋后,冰冻切片机连续切片(8 μm)。经GFAP和OX-42单克隆抗体4 ℃孵育过夜,二抗孵育1 h后,于正置荧光显微镜照片。
1.6 实时荧光定量PCR
取大鼠脊髓腰膨大L4-5段组织,按照Trizol试剂说明书提取总RNA,鉴定RNA的纯度及完整性( A260/ A280范围1.6~2.0,且凝胶电泳显示18S和28S条清晰)。参照逆转录试剂盒操作规程合成25 μL cDNA,PCR扩增GFAP和OX-42基因片段。GFAP引物序列上游5’-TGGAGCTCAATGACCGCTTT-3’,下游5’-TCATCCGCCTCCTGTCTGTA-3’ (313 bp);OX-42引物序列上游5’-ACCACTCATTGTGGGCAGCTC-3’,下游5’-CACCGGCTTCATTCATCATGTC- 3’ (629 bp);内参基因GAPDH上游5’-CCATGGAGAAGGCTGGGG-3’,下游5’-CAAAGTTGTCATGGATGACC-3’ (195 bp)。结果分析采用2δδCT法计算各基因的相对表达量。
1.7 Western blot检测大鼠脊髓组织GFAP和OX-42的蛋白表达
提取脊髓腰膨大L4-5段组织总蛋白,SDS-PAGE法电泳后,将凝胶中的蛋白转移至PVDF膜,经封闭液封闭加入稀释的一抗(1∶1000稀释),4℃下孵育过夜,加入HRP标记的二抗(1∶1000稀释),室温下孵育2 h后。利用ECL显色剂经凝胶成像分析系统检测,分析目标条带的灰度值异。
1.8 统计学方法

2 结果
2.1 高乌甲素对CFA诱导的大鼠疼痛的影响
各处理组每天药物注射后3 h,6 h,24 h检测机械痛敏(见图1D,E,F)和热痛敏行为(见图1A,B,C),末次药物注射24 h后检测对应的机械痛敏和热痛敏行为。结果显示,高乌甲素低剂量(2 mg/kg)和高剂量(10 mg/kg)均不会影响SD大鼠的机械痛敏和热痛敏行为(见图1A,D)。和vehicle组比较,高乌甲素低剂量(2 mg/kg)和高剂量(10 mg/kg)组均能缓解SD大鼠的机械痛敏和热痛敏行为(见图1,B,C,E,F)。
2.2 免疫荧光染色检测脊髓中GFAP和OX-42表达
脊髓腰膨大L4-5段免疫荧光结果显示(见图2)。与正常组比较,溶剂组中GFAP和OX-42的表达量明显提高;高乌甲素给药组中OX-42的表达量比低于溶剂组,然而溶剂组和高乌甲素给药组中GFAP表达量没有明显差异。
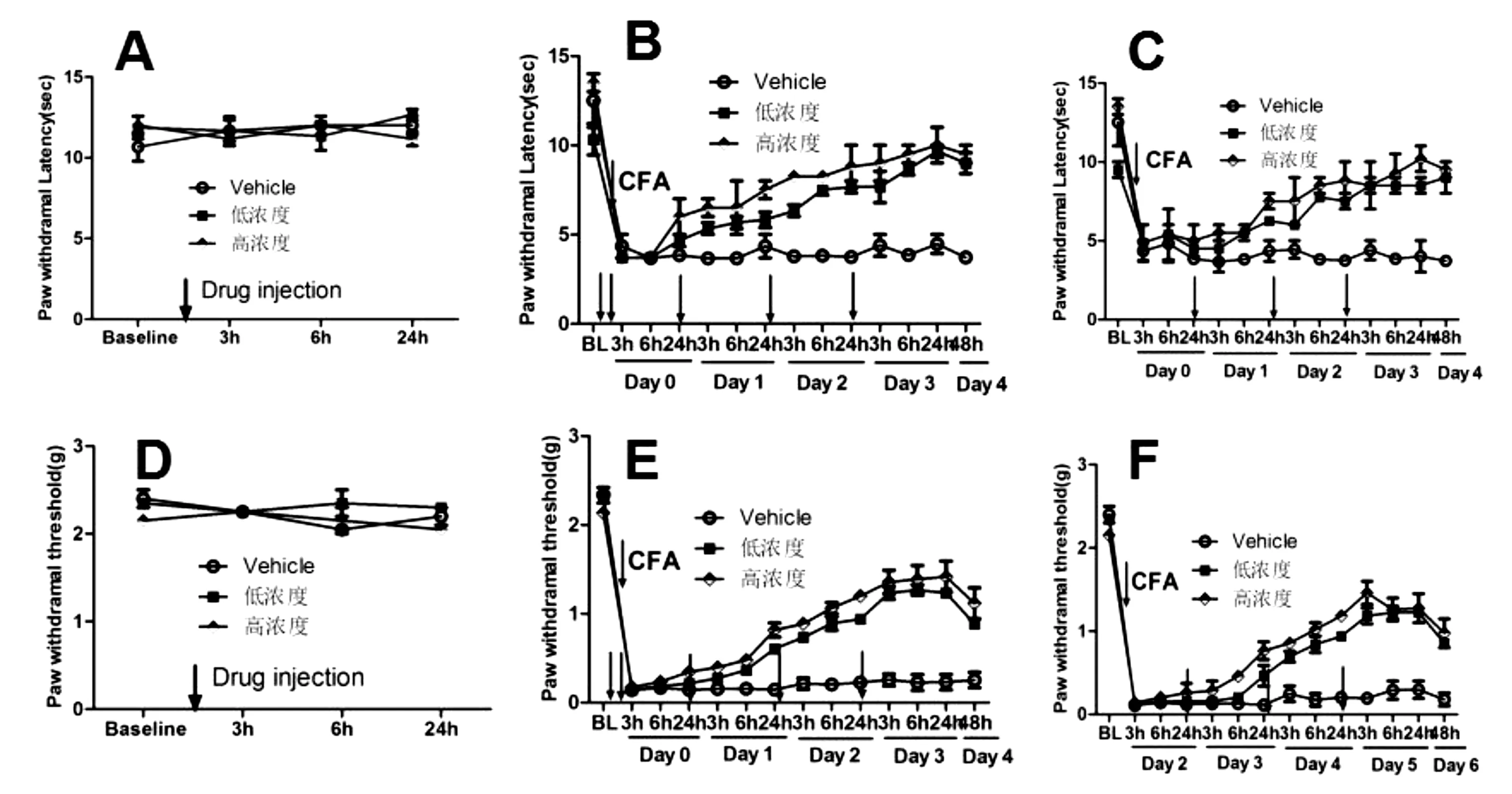
图1 高乌甲素对CFA诱导的大鼠疼痛的影响A,B,C为热痛敏值,D,E,F为机械痛敏值。A,D不注射CFA;B,E为预处理组;C,F为后处理组

图2 免疫荧光染色检测脊髓中GFAP和OX-42表达A.正常组GFAP荧光图。B.溶剂组GFAP荧光图。C.高乌甲素高剂量组GFAP荧光图。D.正常组OX-42荧光图。E.溶剂组OX-42荧光图。F.高乌甲素高剂量组OX-42荧光图
2.3 高乌甲素对CFA诱导大鼠脊髓组织中GFAP和OX-42转录水平的影响
实时荧光定量PCR检测各组大鼠脊髓腰膨大L4-5段组织中GFAP和OX-42基因在转录水平的变化(见图3A,B)。结果显示,和正常组比较,vehicle组(生理盐水)中GFAP和OX-42基因在转录水平均显著升高(P<0.05)。溶剂组比较,高乌甲素组中GFAP基因在转录水平无明显差异(P>0.05);然而,高乌甲素高剂量组中OX-42基因在转录水平显著降低(P<0.05)。
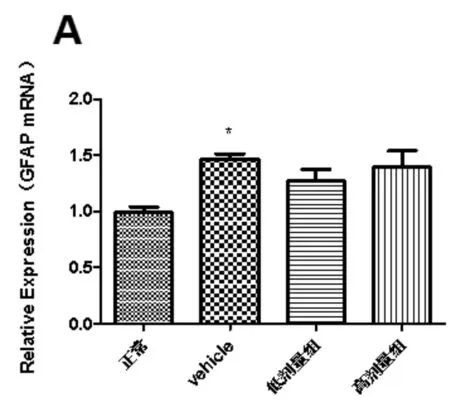

图3 高乌甲素对CFA诱导的大鼠脊髓组织中GFAP和OX-42转录水平的影响
注:A.GFAP mRNA的相对表达量;B.OX-42 mRNA的相对表达量。和正常组比较,*P<0.05,***P<0.001 ;和vehicle组比较,++P<0.01
2.4 高乌甲素多CFA诱导大鼠脊髓组织中GFAP和OX-42蛋白的影响
Western blot法检测GFAP和OX-42蛋白的变化(见图4,A,B)。结果显示,和正常组比较,vehicle组(生理盐水)中GFAP和OX-42蛋白均显著升高(P<0.05)。溶剂组比较,高乌甲素组中GFAP蛋白无明显差异(P>0.05);然而,高乌甲素高剂量组中OX-42蛋白显著降低(P<0.05)。


图4 高乌甲素对CFA诱导的大鼠脊髓组织中GFAP和OX-42翻译水平的影响
注:A.GFAP蛋白的相对表达量;B.OX-42蛋白的相对表达量。和正常组比较,*P<0.05,**P<0.01;和vehicle组比较,+P<0.05
3 讨论
疼痛是一种不愉快的主观感觉和体验,是临床最常见的症状之一。慢性痛也称病理性疼痛,在临床上表现为对伤害性剌激敏感性增强和反应阈值降低的痛觉过敏。炎症性疼痛是慢性痛的一种,是由创伤、细菌或病毒感染、化学物质以及外科手术等引起的外周组织损伤导致的炎症引起的疼痛。本研究表明,针对CFA诱导的炎症性疼痛模型大鼠中,高乌甲素前处理组和后处理组均有明显的疼痛效果(见图1,B,C,E,F),与刘铭佩[2]的研究结果基本一致。本研究首次采用高乌甲素预处理给药方法,并且结果显示在预处理组中,注射CFA后24 h显示出明显阵痛效果(见图1,B);然而,在后处理组中,48 h后才能观察到阵痛效果(见图1,C),提示高乌甲素预处理给药方法有更好的阵痛效果。
本研究结果表明,实时荧光定量PCR和Western blot方法均显示vehicle组脊髓腰膨大L4-5段组织中OX-42和GFAP基因转录水平和蛋白水平均较正常组显著升高(P<0.05),且免疫荧光染色结果表明OX-42和GFAP表达数量显著增加。胶质细胞被激活后,释放多种因子,如促炎的细胞因子、趋化因子、反应性氧簇等,参与神经炎症反应发生,直接诱导神经病理性疼痛的产生[5-7]。提示CFA刺激后的炎症疼痛模型能激活星形胶质细胞和小胶质细胞,导致疼痛的发生。在高乌甲素给药组脊髓组织中,与vehicle组比较,GFAP基因转录水平和蛋白水平均无显著变化(P>0.05);然而,OX-42基因转录水平和蛋白水平均显著降低(P<0.05),同时脊髓腰膨大L4-5段OX-42表达数量明显减少(P<0.05)。表明高乌甲素能抑制脊髓小胶质细胞的激活,但不影响星形胶质细胞的活化,暗示高乌甲素对炎症性疼痛的阵痛作用可能通过抑制小胶质细胞活化,减少参与炎症反应的促炎因子,趋化因子等成分的释放,最终抑制疼痛的发生。

