尤瑞克林对大鼠缺血-再灌注后缓激肽受体B1和B2表达的影响
孙洲 向栩莹 晏桂林 陆观凤 杨燕泽 钟玉馨 张磊
脑梗死后促进脑血管再通,尽快开放有效循环,及时恢复缺血半暗带血流量仍是直接有效的治疗措施[1]。在生理情况下,缓激肽受体B2(bradykinin 2 receptor,B2R)广泛表达于全身各处组织,而缓激肽受体B1(bradykinin 1 receptor,B1R)在损伤、感染等应激情况下表达上调[2]。尤瑞克林的有效成分是组织激肽酶原1,后者为体内重要的炎性调节系统即激肽酶原-激肽释放系统的组成部分,尤瑞克林能将低分子量的激肽原裂解,裂解产物可靶向作用于2种G蛋白偶联受体,分别为B1R和B2R,从而产生血管扩张、平滑肌收缩等生物学效应[3]。近年来,关于尤瑞克林应用于急性脑梗死获益的研究结果在不断报道[4],已知的是尤瑞克林的神经保护作用与影响血液流变学[5]和改善内皮功能[6]有关,而关于尤瑞克林影响B1R和B2R表达的研究较少[7]。本实验通过建立大鼠缺血-再灌注模型,观察急性脑梗死后B1R和B2R的变化,以及不同剂量的尤瑞克林对其表达的影响,并通过观察不同组脑梗死边缘区域微血管密度相较B1R、B2R表达的趋势,寻找其促进血管新生作用的证据,进一步明确尤瑞克林改善神经功能的作用及机制。
1 材料与方法
1.1 实验动物与分组
SPF级8周龄雄性SD大鼠(体质量为230~270 g),全部采购于华中科技大学同济医学院实验动物供应中心[合格证号:SYXK (鄂) 2015-0053]。实验大鼠全程由专员饲养,保持大鼠正常干燥环境,室温(25.0±2.0) ℃,自由饮食、饮水,自然昼夜节律。所有大鼠手术操作选择于10%水合氯醛腹腔麻醉下进行。实验具体实施方案获得华中科技大学同济医学院动物保护与使用委员会的审核批准并通过。
1.2 试剂及仪器
注射用尤瑞克林干粉针剂(凯力康,广东天普生化医药股份有限公司) ;磷酸盐缓冲液[谷歌生物,中国)、琼脂糖(Invitrogen公司,美国]、总RNA抽提试剂(Invitrogen公司,美国)、反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)反转录试剂盒(TAKARA公司,日本)、DNA Marker(TAKARA公司,日本)、无水乙醇(国药集团化学试剂有限公司,中国)、EDTA抗原修复液(谷歌生物,中国)、二甲苯(国药集团化学试剂有限公司,中国)、抗荧光淬灭剂(碧云天,中国)、氯仿(谷歌生物,中国)、牛血清白蛋白(Sigma公司,德国)、兔抗大鼠血管性血友病因子(von Willebrand factor,vWF,三鹰生物技术公司,中国)、荧光二抗[谷歌生物(488-Alex山羊抗兔),中国]。脱水机(武汉俊杰电子有限公司)、病理切片机(上海徕卡仪器有限公司)、微波炉(格兰仕微波炉电器有限公司,中国)、脱色摇床(北京市六一仪器厂)、免疫组织化学笔(Gene Tech公司,中国)、荧光显微镜(日本尼康)、电子天平称重计(北京赛多利斯仪器系统有限公司)、紫外分光光度计(NUAIRE公司,美国)、高速离心机(Sigma公司,德国)、温度梯度PCR仪(德国Eppendorff)、光学显微镜(日本Olympus公司)。
1.3 大鼠大脑中动脉栓塞(middle cerebral artery occulation,MCAO)缺血-再灌注模型制作
大鼠右侧MCAO缺血-再灌注模型采用改良后Zea Longa线栓方法[8],大鼠经腹腔注射10%水合氯醛麻醉后,备皮、消毒,分离右侧颈总、颈内、颈外动脉,游离颈外动脉至分叉处,在颈外动脉下方穿入3根手术丝线,在距离颈动脉分叉约5 mm处近心端和远心端分别结扎颈外动脉,用眼科剪在颈外动脉近心端剪一个“V”形口,将标记并制备好的栓线插入颈外动脉,用止血钳轻轻牵拉手术丝线使颈外与颈内动脉成180°角,沿着颈外动脉近心端推送线栓入颅内至大脑中动脉,于缺血2 h行神经功能缺损评分,采用Longa评分法剔除评分为0、4分等不满足实验条件的动物模型,对于有严重呼吸困难,提前死亡或到达研究终点处死时脑出血或畸形的实验大鼠均严格按照实验标准剔除[9]。检测模型成功后拔出线栓,形成缺血-再灌注。假手术组仅分离颈总动脉,不插入线栓,保证其他条件与模型组相同。造模成功的25只SD大鼠按随机抽样法分为5组,每组5只,分别为假手术组、I/R模型组(I/R+等渗盐水组)、尤瑞克林低剂量治疗组(I/R+LDP组,3.50×10-3PNAU/kg)、尤瑞克林中等剂量治疗组(I/R+MDP组,8.75×10-3PNAU/kg)、尤瑞克林高剂量治疗组(I/R+HDP组,17.50×10-3PNAU/kg),术后30 min首次给予尤瑞克林,每天定时注射1次,均为尾静脉注射,连续注射7 d后取材。
1.4 实时定量RT-PCR
摘取缺血侧梗死交界区皮质脑组织,去除软脑膜,称取脑组织重量,加入1 ml总RNA抽提试剂,进行充分匀浆,提取RNA,后进行PCR扩增,引物序列及引物长度如下。(鼠)B1R引物序列:B1R F为 5′-CCACATTCCTTCTACGCTCTG-3′;B1R R为:5′-CGTTCAACTCCACCATCCTT-3′。(鼠)B2R引物序列:B2R F:5′-CTGTCGTGGAAGTGGCTATGT-3′;B2R R为:5′-AAAGGTCCCGTTATGAGCAG-3′。以β-actin为内参物,引物序列:β-actin F为:5′- CACGATGGAGGGGCCGGACTCATC-3′;β-actin R:5′-TAAAGACCTCTATGCCAACACAGT-3′。
提取总RNA进行反转录反应后,取反转录产物进行PCR扩增反应,上下游引物各0.5 μl,dNTP 2 μl,Taq酶0.25 μl,酶缓冲液2.5 μl,ddH2O加水至25 μl,分别依次在94 ℃条件下预变性4 min,94 ℃条件下30 s,56 ℃条件下退火30 s,72 ℃条件下延伸25 s;共经过30个循环,然后在72 ℃条件下总延伸4 min,最后于4 ℃反应条件下反应4 min,扩增产物进行凝胶电泳,通过Image J软件分析电泳条带相对灰度值得出实验数据,使用GraphPad分析软件进行绘图。
1.5 vWF免疫荧光法检测微血管密度(microvessel density,MVD)
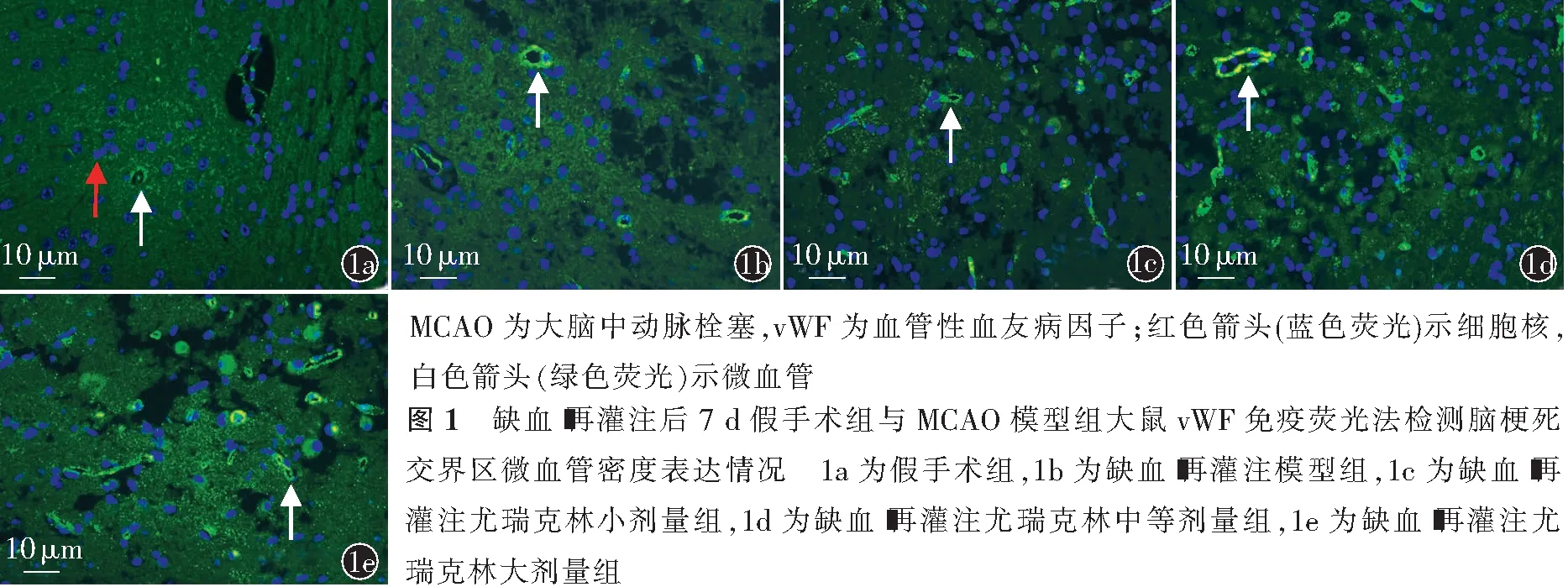
通过vWF免疫荧光测定缺血-再灌注大鼠7 d时脑梗死交界区MVD。各组切片脱蜡、脱水后进行抗原修复,用一抗vWF覆盖脑组织切片,切片甩干以后在画好的圈内均匀滴入与vWF一抗对应种属的荧光二抗(488-Alex山羊抗兔)覆盖,用4′,6-二脒基-2-苯基吲哚二盐酸盐(4′,6-diamidino-2-phenylindole,DAPI)液进行细胞核复染,抗荧光淬灭剂封片,荧光显微镜下即时采集免疫荧光组织切片镜检影像。微血管计数借鉴Weidner法[10]。计数微血管时,无论血管管腔完整与否,血管直径≤8个红细胞直径(50~60 μm)的荧光绿染血管,或单个与周围血管不相邻的荧光标记的内皮细胞或细胞群都认为是一个可计数的微血管,有较厚平滑肌壁的血管除外。
1.6 统计学分析
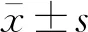
2 结果
2.1 RT-PCR检测缺血-再灌注7 d脑梗死交界区B1R和B2R的mRNA表达
缺血-再灌注后7 d,各组B1R、B2R的mRNA相对表达水平差异均有统计学意义(均P<0.01)。I/R+等渗盐水组与I/R+LDP组与比较,以及I/R+HDP组与I/R+LDP组、I/R+MDP组比较,B1R的mRNA表达差异均有统计学意义(均P<0.05)。假手术组与I/R+等渗盐水组比较,I/R+LDP组与I/R+等渗盐水组比较,I/R+LDP组、I/R+MDP组与I/R+HDP组比较,B2R的mRNA表达差异均有统计学意义(均P<0.05)。见表1。
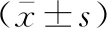
表1 缺血-再灌注后7 d假手术组与MCAO模型大鼠脑组织B1R及B2R的mRNA表达
注:MCAO为大脑中动脉栓塞,I/R为缺血-再灌注,LDP、 MDP、HDP分别为低剂量,中等剂量、高剂量尤瑞克林;假手术组仅给予分离颈总动脉,不插入线栓;I/R+等渗盐水组为缺血-再灌注模型组,另3组分别于造模成功后连续7 d尾静脉注射低剂量、中等剂量、高剂量尤瑞克林;与I/R+等渗盐水组比较,aP<0.05; 与I/R+LDP组比较,bP<0.05;与I/R+MDP组比较,cP<0.05;与假手术组比较,dP<0.05
2.2 缺血-再灌注后梗死交界区MVD
缺血-再灌注7 d,I/R+等渗盐水组与假手术组比较,缺血-再灌注后梗死交界区MVD升高,差异有
统计学意义(P<0.01)。I/R+LDP组与I/R+等渗盐水组比较,缺血-再灌注后梗死交界区MVD升高,差异有统计学意义(P<0.01)。I/R+MDP组与I/R+LDP组比较,缺血-再灌注后梗死交界区MVD差异无统计意义(P>0.05)。I/R+HDP组与I/R+LDP组、I/R+MDP组比较,缺血-再灌注后梗死交界区MVD均升高,差异均有统计学意义(均P<0.01,图1,表2)。
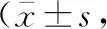
表2 缺血-再灌注后7 d假手术组与MCAO模型大鼠脑梗死交界区微血管计数比较个/mm2)
注:MCAO为大脑中动脉栓塞,I/R为缺血-再灌注,LDP、 MDP、HDP分别为低剂量,中等剂量、高剂量尤瑞克林;假手术组仅给予分离颈总动脉,不插入线栓;I/R+等渗盐水组为缺血-再灌注模型组,另3组分别于造模成功后连续7 d尾静脉注射低剂量、中等剂量、高剂量尤瑞克林;与假手术组比较,aP<0.01;与I/R+等渗盐水组比较,bP<0.01;与I/R+LDP组比较,cP<0.01;与I/R+MDP组比较,dP<0.01
3 讨论
尤瑞克林的有效成分是人尿激肽原酶,其改善神经功能的机制为减轻炎性反应[10]、促进神经干细胞增殖分化[11]、抑制神经细胞凋亡[12]。近来研究表明,开放循环、促进血管新生可能是尤瑞克林改善其他病理变化的中心环节[13]。本实验结果表明,大鼠脑缺血-再灌注7 d时B1R及B2R均有明显表达,与已有文献报道结果一致[14]。根据生理情况下B1R少有表达,而病理情况下B1R可诱导产生。本研究缺血-再灌注7 d时假手术组B1R少量表达,考虑主要与假手术操作所致应激反应相关;尤瑞克林各剂量组较I/R+等渗盐水组对B1R、B2R均有明显的上调作用,且高剂量的尤瑞克林作用效果更为明显。以往鲜有对不同剂量尤瑞克林与缓激肽受体表达关系的文献报道,但有研究结果支持不同剂量的尤瑞克林对大鼠脑缺血后神经保护作用不同[15-16]。
正常情况下B2R在各组织均有表达,B1R则在缺血性疾病、炎性反应等情况下诱导产生。在心脏和血管研究中发现,在B2R缺失的情况下,未发现B1R代偿性增多,因此认为B2R在血管发生中具有重要的作用[17-18]。本研究应用尤瑞克林对缺血-再灌注大鼠进行体内实验观察其影响,结果表明,不同剂量组尤瑞克林均能上调B1R、B2R mRNA的相对表达水平,但高剂量的尤瑞克林效果更为明显,B1R、B2R mRNA随药物剂量上升幅度相似,推测尤瑞克林对2种受体的上调具有一致性。缺血-再灌注7 d,梗死交界区MVD较假手术组自发增高,考虑为脑梗死代偿性血管新生,随尤瑞克林剂量增高梗死交界部位MVD亦升高。比较不同剂量尤瑞克林上调B1R和B2R表达、增加区域MVD的作用效果,均为高剂量尤瑞克林组更为显著,推测尤瑞克林用药可能在早期从一定程度上在脑缺血后增补了机体自身B2R的表达,从而达到促血管新生的效果。这为进一步的机制研究提供了有价值的方向。但本实验仍有不足之处,B1R、B2R可能在不同时期对开放侧支循环和促进血管新生起到不同的作用,随着研究的不断深入,尤瑞克林影响缓激肽受体表达的确切机制会更加清晰。
综上所述,各剂量尤瑞克林均上调缺血-再灌注后大鼠B1R、B2R表达,发挥促进血管新生的作用,且高剂量的尤瑞克林对血管新生作用效果更为明显。

