低盐腊肉贮藏期间菌相和理化性质的变化
柴子惠,李洪军,2,李少博,张 东,李冉冉,贺稚非,2,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市特色食品工程技术研究中心,重庆 400715)
腊肉作为我国传统肉制品的典型代表,以其悠久的文化沉淀和独特的腊香味,深受广大消费者的喜爱,是世界珍贵饮食文化遗产的重要组成部分[1]。腊肉制作简单、耐贮藏、肉色腊红、肥肉金黄、腊味浓香、腊中带咸、风味独特,因此受到消费者的普遍青睐[2]。腊肉的风味是烟熏味、鲜味、肉味、咸味共同作用的结果,因而风味异常独特[3]。同时腊肉含有多种营养物质,例如脂肪、蛋白质、维生素和矿物质等[4]。目前我国腊肉制品年产销量超过200万 t,尤其在南方地区,消费市场潜力巨大[3]。
食盐是肉制品加工过程中的一种必需配料,其在加工成熟过程中有着不可或缺的作用[5]。传统腊肉制作过程中通常加入大量盐分,以此来降低产品的含水量,从而达到长期保存的目的[6]。传统腊肉制品的食盐质量分数通常为8%左右[7]。腊肉中的高盐含量既延长了产品的发酵周期,又提高了厂家的生产成本[6]。同时有学者指出,人体摄入过多钠离子会引发高血压、心血管甚至慢性肾脏损伤等疾病[8-9]。
目前对低盐腊肉的研究主要集中于配方和工艺:例如张东等[10]利用D-最优混料试验,采用质量分数22% KCl和11% VC-Ca替代质量分数33%的盐分以降低腊肉中的食盐含量;李林等[11]通过顶空固相微萃取结合气相色谱-质谱联用技术测定腊肉加工过程中的风味物质变化,推荐最佳低温烟熏时间为10 d。有些研究重在研究腊肉加工和贮藏期间的蛋白质和脂肪变化,尚永彪等[12]通过测定传统腊肉加工期间的水分含量、酸价、过氧化值等指标,分析得出长时间低温熏烤的腊肉食用安全性更高。腊肉贮藏期间的研究大多集中于对品质的研究,对微生物变化的研究较少。
因此,本研究以低盐腊肉为研究对象,并以同等工艺条件下的高盐腊肉作对照,通过测定两种腊肉的水分质量分数、水分活度、pH值、盐分、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值和菌落总数、乳酸菌、微球菌和葡萄球菌、大肠杆菌数量的变化,研究贮藏期间低盐腊肉的品质变化规律,不仅能为改善腊肉品质提供理论指导,也能对我国传统肉制品的现代化生产进程起到促进作用。
1 材料与方法
1.1 材料与试剂
新鲜猪后腿肉、辅料(食盐、十三香、花椒、白糖、料酒等)购自重庆市北碚永辉超市天生丽分店,猪后腿肉存于4 ℃冰箱中备用。II-普通山楂核烟熏香味料(食品级)购于山东济南华鲁食品有限公司,符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》。
氯化钾、乙醇、冰乙酸、氢氧化钠、三氯甲烷、硝酸银、硫代巴比妥酸(thiobarbituric acid,TBA)、蛋白胨、葡萄糖、琼脂、牛肉膏、酵母膏 重庆钛新化工有限公司。
1.2 仪器与设备
722型可见分光光度计 上海元析仪器有限公司;DGG-9240A型电热恒温鼓风干燥箱 上海森信试验仪器有限公司;HH-4型数显恒温水浴锅 金坛市富华仪器有限公司;PB-10酸度计、BSA323S型电子天平 赛多利斯科学仪器(北京)有限公司;XHF-D高速分散器宁波新芝生物科技股份有限公司;TOMYSS-325型高压灭菌锅 日本Tomy Kogyo公司;SW-CJEF型洁净工作台 苏净集团安泰公司;DHP-9272型电热恒温培养箱 上海齐欣科学仪器有限公司;AW-1智能水分活度仪 无锡市碧波电子设备厂。
1.3 方法
1.3.1 原料处理与分组
仔细去除新鲜猪后腿肉其表面的淤血和筋膜等,并切成长15 cm、宽3 cm、质量约250 g的肉块,通过修整,尽可能使肉块大小均一。参照张东等[10]的配方配制腊肉腌制液,分别配制低盐腊肉腌制液(盐的质量分数为4%,包括2.68%食盐、0.88% KCl、0.44% VC-Ca)和高盐腊肉腌制液(食盐质量分数为6%),两种腌制液除盐的质量分数不同外,其他条件完全相同。将肉浸泡在该腌制液中,在10 ℃恒温条件下,腌制5 d,每天将肉翻面一次;腌制结束后,用30 ℃左右的水将腊肉表面的调料仔细冲去、沥干,将肉浸泡在质量分数为15%的液熏液中液熏3 h;后放入50 ℃的烘箱中烘烤50 h,每20 h翻动一次;烘烤结束后,待腊肉内部温度降低到室温,即为成品。将制作好的腊肉在20 ℃环境下散装存放90 d,然后每贮藏15 d取腊肉的肌肉和皮下脂肪,先测定菌相指标,后测定理化指标。
1.3.2 pH值的测定
pH值按GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[13]测定,同一样品平行测定3 次。
1.3.3 水分活度的测定
将腊肉搅碎成芝麻粒大小并放入智能水分活度仪中,在常温下静置90 min后读取读数,同一样品平行测定3 次。
1.3.4 水分质量分数的测定
水分质量分数按GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[14]中的直接干燥法测定,同一样品平行测定3 次。
1.3.5 食盐质量分数的测定
取腊肉粉末10 g,用90 ℃左右的蒸馏水准确移入250 mL容量瓶中,冷却后过滤,取10 mL滤液,加入50 mL蒸馏水和0.5 mL 10 g/100 mL铬酸钾指示剂,然后用0.1 mol/L AgNO3滴定,刚好变红时为滴定终点。空白组不添加腊肉粉末,其余操作一致,刚好变红时为滴定终点。腊肉中食盐质量分数按式(1)进行计算。

式中:V为样品消耗硝酸银的体积/mL;V0为空白组消耗硝酸银的体积/mL;m为样品质量/g。
1.3.6 TBARS值的测定
TBARS值的测定参照Witte等[15]的方法,将处理后的腊肉分别在532 nm和600 nm波长处比色,记录吸光度(A)并按式(2)计算TBARS值。
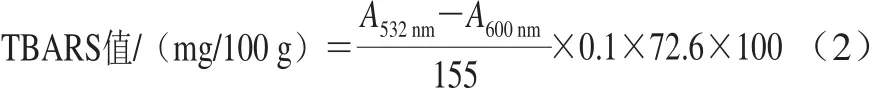
1.3.7 菌落总数、乳酸菌等菌落数的测定
菌落总数按GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]中的方法计数;乳酸菌菌落按GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[17]中的方法计数;微球菌和葡萄球菌菌落计数参照刘洋[18]的方法,将平板在(30±1)℃下放置(48±2)h并计数;以上结果均以lg(CFU/g)表示。
大肠菌群采用GB 4789.3—2016《食品安全国家标准食品微生物学检验 大肠菌群计数》[19]中的方法计数,评价标准参考GB 2762—2017《食品安全国家标准 食品中污染物限量》[20](腊肉制品的大肠菌群数量≤3 MPN/g)。
1.4 数据处理与分析
用Excel 2010软件计算平均数和标准差;运用SPSS 20软件中的方差分析方法对数据进行显著性分析,P<0.05表示差异显著,同时利用该软件中的Person方法对实验数据进行相关性分析;利用Origin 8.0软件作图。
2 结果与分析
2.1 腊肉贮藏期间pH值变化

图1 腊肉贮藏期间pH值的变化Fig. 1 Changes in pH during storage of Chinese cured meat
pH值对腊肉的风味、香味、色泽、口感等都有重要影响。较低的pH值会抑制肉中蛋白质与脂肪水解酶类的活性,并最终改变产品的风味[21]。由图1可知,两种腊肉贮藏期间pH值的变化趋势相似,均为贮藏初期下降、后期逐渐增长,最终缓慢下降。贮藏初期,低盐腊肉pH值显著低于高盐腊肉(P<0.05),与牛培阳[22]、詹昌玲[23]等的研究结果一致。贮藏的第30天,两种腊肉的pH值达到最低值。整个贮藏过程中,低盐腊肉pH值显著低于高盐腊肉(P<0.05),贮藏结束时,低盐腊肉、高盐腊肉的pH值分别为5.75、6.00。
2.2 腊肉贮藏期间水分质量分数、水分活度变化
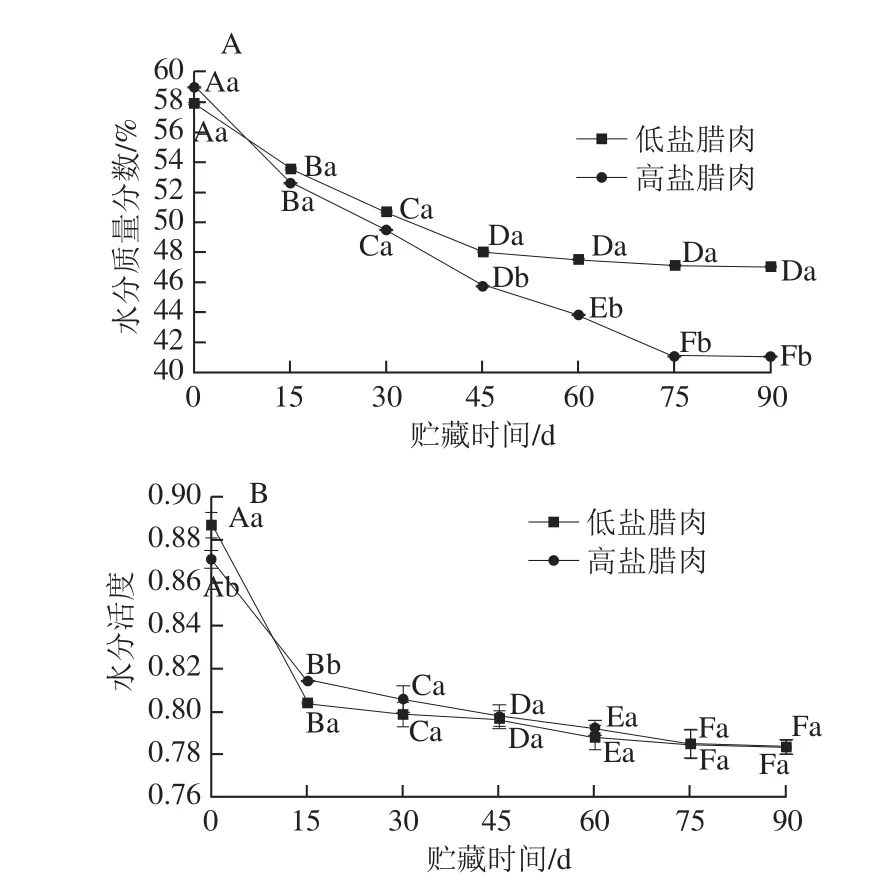
图2 腊肉贮藏期间水分质量分数(A)和水分活度(B)的变化Fig. 2 Changes in moisture content (A) and water activity (B) during storage of Chinese cured meat
一般来说,水分质量分数越高,肉质越嫩,微生物数量越多。水分活度可以表示微生物利用食品中水分的难易程度[24]。水分活度越大,微生物越容易利用腊肉中的水分,利于微生物生长。从图2A可以看出,随着贮藏时间的延长,两种腊肉的水分质量分数下降明显,与贺稚非等[25]的研究结果相似。在贮藏0~45 d期间,两种腊肉水分质量分数下降显著(P<0.05),这是由于贮藏初期,腊肉因为刚开始通风水分散失严重;贮藏45 d后,水分质量分数变化缓慢,逐步趋于稳定。两种腊肉在贮藏结束时,腊肉已经明显干硬、水分缺失,且高盐腊肉的水分质量分数显著低于低盐腊肉,这是因为高盐腊肉食盐质量分数更高、渗透压差更大而使腊肉脱水[26]。
水分质量分数的下降有利于降低水分活度,并且可以赋予产品特有的质地结构,对肉制品的色泽、风味、稳定性以及内源酶的活性有重要的影响[27]。水分活度影响微生物的存活,由图2B可知,两种腊肉在贮藏期间水分活度呈下降趋势,且贮藏初期,水分活度下降迅速,后期下降速度相对减缓,但仍显著下降(P<0.05)。贮藏30 d后,两种腊肉水分活度无显著性差异(P<0.05)。最终低盐腊肉和高盐腊肉的水分活度分别为0.782和0.785。
2.3 腊肉贮藏期间食盐质量分数变化
由图3可知,两种腊肉贮藏期间食盐质量分数均在前期上升迅速,后期有所减缓,这和水分散失逐渐减缓有关,证明了水分质量分数和水分活度的变化。食盐质量分数随着贮藏时间的延长和水分散失而逐步增加[28]。低盐腊肉由贮藏开始到结束,食盐质量分数由4.58%上升到5.89%,高盐腊肉的食盐质量分数贮藏结束时为7.74%,比低盐腊肉高31.41%(P<0.05);且整个贮藏期间,低盐腊肉的食盐质量分数均比高盐腊肉低。
2.4 腊肉贮藏期间TBARS值的变化

图4 腊肉贮藏期间TBARS值的变化Fig. 4 Changes in TBARS value during storage of Chinese cured meat
食品中的油脂氧化形成最终产物丙二醛,所以常用丙二醛含量来表示脂质最终氧化的程度[29],TBARS值越大,表明丙二醛含量越高。一般来说,脂肪氧化和食品的脂肪含量有密切关系,脂肪含量越高,氧化便越容易加速,生成更多的丙二醛。由图4可知,两种腊肉贮藏期间TBARS值呈上升趋势,这是由于脂肪过氧化物的分解生成醛、酮等物质,油脂的氧化降解使得TBARS值不断上升[30]。贮藏过程中,高盐腊肉的TBARS值低于低盐腊肉,这可能是高含量食盐对脂肪水解酶和抗氧化酶活性产生了抑制作用,从而能抑制腊肉中的脂质氧化分解[31]。贮藏结束时,低盐腊肉和高盐腊肉的TBARS值分别为0.56、0.40 mg/kg。
2.5 腊肉贮藏期间菌相变化

图5 腊肉贮藏期间菌相的变化Fig. 5 Changes in microbial counts during storage of Chinese cured meat
由图5A可知,两种腊肉在贮藏期菌落总数的变化趋势相同,均为先显著上升后显著下降,这是因为腊肉贮藏初期水分含量高,且没有大量积累的游离氨基酸来抑制微生物生长;贮藏后期,腊肉营养和水分减少,肉质干硬,微生物生存需要的水分更加难以获取,使得微生物数量下降[28]。整个过程中,低盐腊肉的菌落总数总体上高于高盐腊肉,这是因为高盐腊肉食盐含量高,水分含量少,不利于微生物生长。低盐腊肉在整个贮藏期间,菌落总数均没有超过6(lg(CFU/g)),表明低盐腊肉品质相对稳定。
乳酸菌是腊肉等腌制肉品的优势菌[19,32-33]。由图5B可知,两种腊肉贮藏期间乳酸菌数量均呈现波动性变化,贮藏中期略有上升,但后期显著性下降(P<0.05),这与刘洋[18]的研究结果相似,贮藏前期升高因为乳酸菌自身产酸,抑制了其他微生物尤其是金黄色葡萄球菌等致病菌的生长,同时促进了乳酸菌的增长[34]。贮藏30 d之后,蛋白质和脂质氧化形成的碱性产物大量积累,对乳酸菌生存有害,引起乳酸菌数量下降。乳酸菌作为重要的风味发酵菌,可以赋予产品特殊的发酵风味,改善组织质构,促进色泽与风味的形成[35-36],整个贮藏期间低盐腊肉的乳酸菌数量低于高盐腊肉,因此可能导致两种腊肉风味、组织结构、色泽等的区别。贮藏结束时,低盐腊肉和高盐腊肉的乳酸菌数量分别为3.7、4.0(lg(CFU/g))。
微球菌和葡萄球菌是腊肉、香肠等发酵肉制品常见的优势菌,主要通过分解脂类来影响腊肉的风味[37],同时该菌可以促进腊肉的发色[38]。微球菌和葡萄球菌主要影响产品最后的风味、香气和颜色的稳定性[38]。由图5C可知,两种腊肉的微球菌和葡萄球菌数量呈波动性上升。贮藏0 d时,低盐腊肉微球菌和葡萄球菌数量高于高盐腊肉,这可能是因为低盐腊肉水分含量高,利于微生物生长[19]。贮藏30 d以后,两组微球菌和葡萄球菌数量均显著增加(P<0.05),同时期乳酸菌数量处于下降趋势,实现了优势菌的转化,可能是乳酸菌的生长抑制了微球菌和葡萄球菌的生长[19]。贮藏结束时,低盐腊肉和高盐腊肉微球菌和葡萄球菌数量分别为4.9、5.0(lg(CFU/g)),没有显著性差异(P>0.05)。贮藏期间,两种腊肉的大肠菌群数量均没有超过GB 2762—2017标准(≤3 MPN/g)。
2.6 两种腊肉指标间相关性分析结果
2.6.1 低盐腊肉各指标间的相关性分析结果
通过Pearson相关性分析(表1)发现,低盐腊肉贮藏时间与水分质量分数、食盐质量分数、TBARS值、乳酸菌数量、微球菌和葡萄球菌数量极显著相关(P<0.01),与水分活度显著相关(P<0.05);其中贮藏时间与食盐质量分数、TBARS值、微球菌、葡萄球菌之间具有极显著正相关性(P<0.01),与水分活度、水分质量分数、乳酸菌数量、水分活度之间具有显著或极显著负相关性。水分质量分数与水分活度呈极显著正相关(P<0.01),与食盐质量分数呈极显著负相关(P<0.01);水分质量分数与TBARS值、乳酸菌数量分别呈显著负相关和显著正相关,即随着水分质量分数的增加,TBARS值降低,乳酸菌数量增加。食盐质量分数和水分活度有极显著负相关性(P<0.01);食盐质量分数与TBARS值、乳酸菌数量、微球菌和葡萄球菌数量呈显著相关(P<0.05),其中与TBARS值具有显著正相关性,与乳酸菌数量、微球菌和葡萄球菌数量显著负相关(P<0.05)。TBARS值与乳酸菌数量、微球菌和葡萄球菌数量呈极显著相关(P<0.01),其中与乳酸菌数量呈极显著负相关,与微球菌和葡萄球菌的数量和TBARS值呈极显著正相关。乳酸菌数量与微球菌和葡萄球菌数量呈极显著负相关(P<0.01)。
综上所述,在低盐腊肉的贮藏过程中,随着贮藏时间的延长,腊肉的品质和菌相发生了很大变化,并且各指标间也有一定的相关性。

表1 低盐腊肉贮藏期间各指标间的相关性分析Table 1 Correlation analysis of various quality parameters of low-salt Chinese cured meat
2.6.2 高盐腊肉各指标间的相关性分析结果
通过Pearson相关性分析(表2)发现,高盐腊肉贮藏过程中贮藏时间与水分质量分数、食盐质量分数、TBARS值、乳酸菌数量、微球菌和葡萄球菌数量呈极显著相关(P<0.01),与水分活度呈显著相关(P<0.05);其中与食盐质量分数、TBARS值、微球菌和葡萄球菌数量呈极显著正相关(P<0.01),与水分活度、水分质量分数、乳酸菌数量呈显著或极显著负相关。水分质量分数与水分活度、食盐质量分数、TBARS值、乳酸菌数量、微球菌和葡萄球菌数量呈极显著相关(P<0.01);其中,与水分活度、乳酸菌数量呈极显著正相关(P<0.01),与食盐质量分数、TBARS值、微球菌和葡萄球菌数量呈极显著负相关性(P<0.01)。水分活度与食盐质量分数、微球菌和葡萄球菌数量呈极显著负相关(P<0.01),与TBARS值呈显著负相关(P<0.05)。食盐质量分数与TBARS值、微球菌和葡萄球菌数量分别呈极显著正相关和极显著负相关(P<0.01),与乳酸菌数量呈显著负相关(P<0.05)。TBARS值与乳酸菌数量、微球菌和葡萄球菌数量分别呈极显著负相关和极显著正相关(P<0.01)。乳酸菌数量与微球菌和葡萄球菌数量呈极显著负相关(P<0.01)。

表2 高盐腊肉贮藏期间各指标间的相关性分析Table 2 Correlation analysis of various quality parameters of high-salt Chinese cured meat
综上所述,在高盐腊肉的贮藏过程中,随着贮藏时间的延长,腊肉的品质和菌相发生了很大变化,且各指标间也有一定的相关性。
3 结 论
两种腊肉在贮藏期间,理化指标和微生物指标均保持一致的变化趋势,低盐腊肉水分质量分数更高,食盐质量分数更低,微生物数量相对较多,因此货架期更短。低盐腊肉在整个贮藏期食盐质量分数均低于高盐腊肉,达到了降低腊肉食盐含量的目标,同时低盐腊肉的菌落总数没有超过6(lg(CFU/g)),保持了较好的微生物稳定性,因此低盐腊肉是一种性质相对稳定的食品,可以通过包装措施来弥补低盐腊肉货架期较短的不足。两种腊肉贮藏期间乳酸菌、微球菌和葡萄球菌数量呈波动变化,而乳酸菌和微球菌对腊肉色泽、风味的影响较大,后期可以继续研究菌相对两种腊肉贮藏期风味、色泽形成的影响,同时分离鉴定两种腊肉贮藏期间的优势菌,以更好地解释风味的形成。

