江西亚洲柑橘木虱的种群遗传结构研究
罗育发 吴凯 付丹


摘要 亚洲柑橘木虱Diaphorina citri Kuwayama是芸香科Rutaceae植物新梢期的重要害虫,也是黄龙病Huanglongbing的主要传播媒介,严重威胁江西柑橘产业的发展。本文利用线粒体基因标记,研究江西10个地点亚洲柑橘木虱的种群遗传结构和多态性。扩增了2个线粒体COⅠ基因片段,长度为1 431 bp。其中多态性位点2个(均为非同义突变,A/G转换),单倍型3个(Hap1,Hap2和Hap3)。最常见的单倍型是Hap1(占总样本数的91.7%),发生在所有采样点;其次为Hap3(6.3%),分布在大余和崇义;Hap2(2.0%)仅在兴国出现。单一直线型的单倍型网络结构模式、小而不显著的HR(Harpendings raggedness)指数值,以及单峰型错配分布曲线均表明:江西地区的亚洲柑橘木虱是近期入侵并经历了快速的种群动态扩张。
关键词 亚洲柑橘木虱; 柑橘黄龙病; 种群遗传结构; COⅠ基因; 江西
中图分类号: S 433.3
文献标识码: ADOI: 10.16688/j.zwbh.2018234
Abstract The Asian citrus psyllid Diaphorina citri Kuwayama (Hemiptera: Liviidae), an important pest of the young developing leaves of Rutaceae, is the main vector of the bacterium that causes citrus greening disease (huanglongbing). The population genetic structure and polymorphism of D.citri from 10 sites in Jiangxi were studied by using mitochondrial markers. Two fragments of mitochondrial COⅠ sequences were amplified with a total length of 1 431 bp. We found 2 polymorphic sites (nonsynonymous, A/G transition) and 3 haplotypes (Hap1,Hap2 and Hap3). Among these, the most common haplotype was Hap1 (91.7% of the total) occurring at all sampling sites. Hap3 (6.3%) was distributed in Dayu and Chongyi. Hap2 (2%) was observed only in Xingguo. The singleline haplotype network model, the small and insignificant Harpendings raggedness (HR) index and the unimodal mismatch distribution curve indicated that D.citri populations in Jiangxi had the recent invasion and rapid dynamic expansion.
Key words Diaphorina citri; huanglongbing; population genetic structure; COⅠ gene; Jiangxi
亞洲柑橘木虱Diaphorina citri Kuwayama(半翅目Hemiptera,扁木虱科Liviidae)是热带和亚热带地区柑橘的主要害虫,其成虫主要以嫩叶及未成熟茎的韧皮部为食,有时也会吸食寄主植物的老叶[12]。它能够传播韧皮部杆菌属的病原体Candidatus Liberibacter spp.,导致柑橘黄龙病huanglongbing,后者被认为是柑橘上最严重的病害之一[3]。亚洲柑橘木虱最早于1907年在我国台湾发现[4],现已广泛分布于整个亚洲、中东地区、美国南部、加勒比群岛以及南美洲各地[57]。该虫自20世纪初入侵我国后,已在广西、广东、福建、江西等地区严重发生[8],并逐步入侵到我国长江以南各省(区),目前随全球气候变暖,正继续向北方扩散。亚洲柑橘木虱的入侵促进了柑橘黄龙病在江西省的扩散蔓延,给该地区的柑橘产业造成巨大损失。
遗传结构是指等位基因或基因型在时间或空间上的非随机分布。研究种群的遗传结构可以估计种群的遗传多样性和种群间的基因交流,推断祖先种群和种群的遗传分化水平。这些信息对于害虫的综合管理至关重要。目前国内对亚洲柑橘木虱的研究主要侧重于它的宏观生物学及生态学特性,如生活史、耐热性、耐寒性、传菌性,以及光、温湿度等对其发育繁殖与存活的影响;对其田间种群的发生和防控等方面也有详细报道[1]。然而,迄今为止对该害虫种群遗传学等微观方面缺乏研究。
不同地区的温度、湿度、寄主植物和人类活动等环境因子对亚洲柑橘木虱的存活和繁殖有显著影响[912]。亚洲柑橘木虱的高繁殖量和短繁殖周期(2~7周),使其在入侵后对新环境有迅速的反应。入侵种群将获得不同的生态学特性,例如在寄主偏好、求偶行为、发育时间、致病性、对天敌和农药的敏感性,以及耐热性等方面发生改变[1316],并分化形成不同的地理种群。目前国外学者在探讨局部地区亚洲柑橘木虱的种群遗传结构及其分化等方面已取得许多重要的研究成果[1720]。
线粒体COⅠ基因包含丰富的遗传信息,进化速率适中,可作为种属系统进化研究的良好标记[2122]。为了了解江西亚洲柑橘木虱的种群遗传结构,笔者测定了该地区不同地理种群的COⅠ基因片段序列,分析其种群遗传多样性及地理分化,为江西亚洲柑橘木虱及黄龙病的防控提供重要参考资料。
1 材料与方法
1.1 样本收集、测序和序列分析
从江西瑞金(25.796°N,115.969°E)、龙南(24.901°N,114.769°E)、石城(26.427°N,116.278°E)、兴国(26.275°N,115.343°E)、崇义A(25.552°N,114.281°E)、崇义B(25.612°N,114.289°E)、寻乌(24.961°N,115.661°E)、大余A(25.447°N,114.452°E)、大余B(25.442°N,114.446°E)和章贡(25.799°N,114.889°E)等10个取样点,采集到48头亚洲柑橘木虱成虫,放入95%乙醇并保存在-20℃冰箱中,用于测序和种群遗传学分析。采用试剂盒TIANamp Micro DNA Kit(TIANGEN Biotech Co., Ltd)提取单个样本的总基因组DNA,具体操作步骤见说明书。采用2对引物扩增COⅠ基因片段序列(表1)。反应体系选用宝生物工程 (大连) 有限公司的试剂盒: 1 μL的10 mmol/L dNTPs,1.5 μL的15 μmol/L引物,4 μL的25 mmol/L MgCl2,5 μL的10×Buffer,0.6 μL的5U TaqDNA聚合酶,1 μL的20 ng/μL的基因组DNA模板,ddH2O补齐反应总体积到50 μL。PCR反应在Eppendorf Mastercycler pro S梯度PCR仪上进行。反应条件:94℃预变性5 min;之后进入循环,94℃变性30 s,45~56℃退火45 s;72℃延伸1 min,共运行40个循环;最后72℃延伸3 min。所有PCR产物直接送到上海生工生物工程有限公司进行纯化和测序,测序引物见表1。
用SEQUENCHER ver. 4.1.2(Gene Codes Corporation, Ann Arbor, MI)和BioEdit[23]软件核查和编辑DNA序列。所有序列都用CLUSTALW和 MAFFT ver.5[24]软件进行比对。应用DnaSP ver.5.10软件[25]获取序列单倍型和多态性位点。所有序列上传至GenBank(登录号:MK804797~MK804890)。
1.2 单倍型网络重构及种群历史动态分析
为了比较江西不同地理种群之间的遗传学关系,本文利用PopART (http:∥popart.otago.ac.nz)软件构建亚洲柑橘木虱COⅠ序列的单倍型网络结构模式。为了推算其种群动态历史,我们利用Arlequin ver. 3.5软件中的错配分布分析检验该害虫种群在江西地区是否经历近期的扩张事件。错配分布是以可视化方式体现群体历史动态的方法。一般来说,动态平衡的种群错配分布分析呈现多个峰形,而经历近期扩张的种群错配分布分析呈现单个峰形[26]。
2 结果与分析
2.1 单倍型和遗传变异
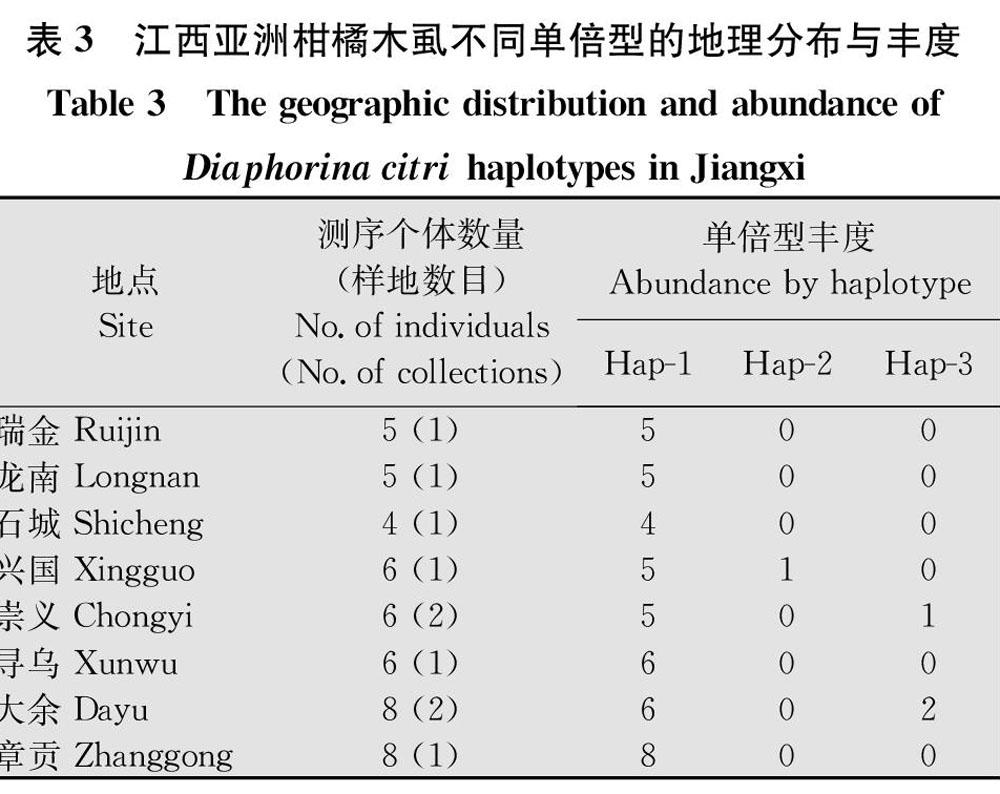
从10个采集点的48头亚洲柑橘木虱中扩增到2个线粒体COⅠ基因片段(COⅠ1和COⅠ2,长度分别为760 bp和671 bp),总长度为1 431 bp。分析所有序列时发现2个多态性位点(均为非同义突变,A/G转换)和3个单倍型(Hap1,Hap2和Hap3,表2)。其中Hap1最常见(占总样本数的91.7%),入侵所有采集点;其次为Hap3(占6.3%),分布在大余A和B以及崇义A;Hap2(占2%)仅在兴国出现(表3)。
2.2 种群遗传关系
江西亚洲柑橘木虱的单倍型网络结构为单一直线型模式(图1)。Hap1均衡地分布在所有采集区域,为祖先单倍型;出现在兴国的单倍型Hap2是由祖先单倍型Hap1经一次突变形成;来自大余和崇义的单倍型Hap3則由Hap2经一次突变产生。
2.3 种群动态历史
错配分布分析结果见图2。单峰型分布模式,以及小而不显著的HR(Harpendings raggedness)指数值(P>0.05)(图2)表明:亚洲柑橘木虱种群在近期入侵江西,并经历迅速的动态扩张[26]或因相邻地区间存在高的种群迁移水平而形成区域扩张[2728]。最低的核苷酸突变(如0和1)发生频率高(图2)同样暗示:该地区的亚洲柑橘木虱种群是由少数祖先个体通过近期扩张形成。单倍型网络结构模式(图1)也证实该害虫在入侵江西后经历快速的种群扩散过程。
3 讨论
江西省是我国重要的柑橘产地,生产的脐橙、蜜橘、柚类享誉海内外。20世纪70年代末,亚洲柑橘木虱入侵赣州地区,进而引发黄龙病[29]。此后由于该省柑橘栽培区冬季气温转暖,木虱种群变大,其地理分布明显北移,发生范围进一步扩大。本研究扩增了江西10个地点亚洲柑橘木虱的2个线粒体COⅠ基因序列片段,总长度达到1 431 bp,但分析所有序列后仅发现2个多态性位点,且都为非同义突变类型(A/G转换)。这种低的遗传变异现象说明该害虫在江西地区经历了最近的入侵事件,并且可能是单个单倍型的入侵。其3个单倍型(Hap1,Hap2和Hap3)在不同地区出现的频率不同。在瑞金、龙南、石城、寻乌和章贡只发现一个单倍型(Hap1),可能意味着这些种群在入侵后由于繁殖体数目小和瓶颈效应,它们还在继续维持这个祖先单倍型。而兴国除了具有祖先单倍型外,由于少数个体发生点突变,形成一个新的单倍型(Hap2);崇义和大余在该突变之后再次发生点突变,又增加了一个单倍型(Hap3),因而这些地区的柑橘木虱显示出相对较高的遗传多态性。这可能是由于多次入侵和/或在一个相对较长的扩张历史过程中,由于栖息地环境的改变(如柑橘种植地大量使用杀虫剂或地区性气候剧烈变化等)导致基因发生突变。目前在伊朗、巴基斯坦、巴西、美国等地也有关于亚洲柑橘木虱遗传多样性的报道[1620],且使用与本文相同的分子标记(COⅠ1),但采样区域、所分析样本的数量,以及COⅠ序列片段的长度不同。本文增加了一个用于遗传结构分析的COⅠ基因片段(COⅠ2),从而获得了更多的序列变异信息。在本研究中,亚洲柑橘木虱的单倍型网络关系及错配分布分析结果都表明,该害虫在近期入侵江西地区,并且经历了快速的种群动态扩张。然而我们并不清楚江西亚洲柑橘木虱的来源及与全国其他省份有着怎样的遗传学关系;对全国各地入侵种群的遗传变异规律和分化格局等还有待深入研究。
參考文献
[1] YANG Y, HUANG M, BEATTIE G A C, et al. Distribution, biology, ecology and control of the psyllid Diaphorina citri Kuwayama, a major pest of citrus: A status report for China [J]. International Journal of Pest Management, 2006, 52: 343352.
[2] 邓明学.以控制木虱为重点的柑桔黄龙病综合防治理论的形成过程、依据和技术要点[J].中国农学通报,2009,25(23):358363.
[3] DA GRAA J V. Biology, history, and world status of Huanglongbing [C]∥Taller International sobre Huanglongbing de los cítricos (Candidatus Liberibacter spp.) yel psílido asiático de los cítricos (Diaphorina citri), 7-9 May 2008, Hermosillo, Sonora, Mexico.
[4] HALBERT S E, MANJUNATH K L. Asian citrus psyllids (Sternorrhyncha: Psyllidae) and greening disease of citrus: a literature review and assessment of risk in Florida [J]. Florida Entomologist, 2004, 87: 330353.
[5] HOLLIS D. A new citrusfeeding psyllid from the Comoro Islands, with a review of the Diaphorina amoena species group (Homoptera)[J]. Systematic Entomology, 1987, 12: 4761.
[6] WATERHOUSE D F. Biological control of insect pests: Southeast Asian prospects [M].ACIAR Monograph Series No. 51. Canberra: Australian Centre for International Agricultural Research. 1998.
[7] HALBERT S E, NU'EZ C A. Distribution of the Asian citrus psyllid Diaphorina citri Kuwayama (Rhynchota: Psyllidae) in the Caribbean basin [J]. Florida Entomologist, 2004, 87: 401402.
[8] LUO Y F, AGNARSSON I. Global mtDNA genetic structure and hypothesized invasion history of a major pest of citrus, Diaphorina citri (Hemiptera: Liviidae)[J]. Ecology and Evolution, 2018, 8: 257265.
[9] ZHAO X. Occurrence of citrus yellow shoot (greening) disease in Guangxi and southern Sichuan: a brief review[C]∥The FAOUNDP Project Coordinator in Fuzhou. Regional workshop on citrus greening huanglongbing disease, 6-12 December 1987, Fuzhou, China.
[10]YANG Y. Effects on light, temperature and humidity on the development, reproduction and survival of citrus psylla[J]. Acta Ecologica Sinica, 1989, 9: 348354.
[11]XU C, XIA Y, KE C. Study on the biology and control of citrus psylla [J]. Acta Phytophylacica Sinica, 1994, 21: 5356.
[12]WANG Z. Distribution and transmission of citrus psylla in Guizhou Province [J]. Tillage and Cultivation, 2002, 22(4): 6263.
[13]CARMICHAEL L E, KRIZAN J, NAGY J A, et al. Historical and ecological determinants of genetic structure in arctic canids [J]. Molecular Ecology, 2007, 16: 34663483.
[14]PINHO C, HARRIS D J, FERRAND N. Comparing patterns of nuclear and mitochondrial divergence in a cryptic species complex: the case of Iberian and North African wall lizards (Podarcis, Lacertidae)[J]. Botanical Journal of the Linnean Society, 2007, 91: 121133.

