HPLC法测定箭根薯中薯蓣皂苷元的含量
王志杰 张伟 彭霞 姜明辉 卯明霞


【摘 要】目的:测定箭根薯中薯蓣皂苷元的含量。方法:HPLC法,色谱柱为十八烷基硅烷键合硅胶;乙腈-水(90∶10)为流动相;检测波长为203nm,流速为1.0mL/min,柱温35℃。理论板数以薯蓣皂苷元峰计算应不低于5000。结果: 薯蓣皂苷元在0.5370~6.716μg的范围内线性良好,r=0.9996;平均加样回收率(n=6)为101.5%,RSD为1.1%;样品溶液在24h内稳定,日内精密度良好,RSD = 0.65%。结论:此法简便、可靠,可用于箭根薯中的薯蓣皂苷元的含量测定。
【关键词】高效液相色谱法;箭根薯;薯蓣皂苷元;含量
【中图分类号】R284.1 【文献标志码】A【文章编号】1007-8517(2019)5-0027-04
箭根薯是傣医常用药之一,傣语称咪火蛙,意译为“味苦似牛胆”,为蒟蒻薯科蒟蒻薯属植物箭根薯(Tacca chantrieri Andre)的干燥块茎(见图1~2)。性味苦、凉,入水、风塔。具有清火解毒,消肿止痛,排脓生肌,止咳化痰功效。用于疮疡肿毒,痄腮,乳痈,咽喉肿痛、咳嗽痰多,脘腹疼痛,解食毒[1]。箭根薯是傣药雅解片、西双版纳州傣医院制剂“解毒养颜胶囊”、“健胃止痛胶囊”、“五宝胶囊”处方药材之一。箭根薯含有薯蕷皂苷元、豆甾醇、胡萝卜甙、根薯酮内酯类化合物[2-3]。据报道利用多种波谱技术从箭根薯的根及根茎中分离鉴定出10多个根薯酮内酯类化合物[4]。薯蓣皂苷元 (Diosgenin)又名薯蓣皂素,是薯蓣皂苷的水解产物[5-6 ];该化合物具有溶血、降血脂、抗菌、消炎、抗肿瘤作用[7-11]。目前,箭根薯药材的标准收载于《云南省中药材标准》2005年版第一册中,应用HPLC法对其中薯蓣皂苷元的含量测定并未见报道。参考文献[12-15]采用了HPLC法对其中薯蓣皂苷的水解产物薯蓣皂苷元进行含量测定,建立箭根薯中薯蓣皂苷元含量测定方法,为箭根薯质量控制和质量标准的提升提供参考方法和依据。
1 仪器与材料
1.1 仪器 Agilent1260高效液相色谱仪,T-214型电子天平(德国赛多利斯),MS205DU型十万分之一天平(梅特勒-托利多)。
1.2 材料 薯蓣皂苷元对照品(批号:111539-200001,中国食品药品检定研究院)使用前置五氧化二磷减压干燥器中干燥12h后使用。乙腈为色谱纯,水为超纯水,其余试剂均为分析纯。箭根薯样品采自西双版纳州景洪市和勐腊县,经西双版纳州食品药品检验所彭霞主任药师鉴定为蒟蒻薯科蒟蒻薯属植物箭根薯干燥块茎。
2 方法与结果
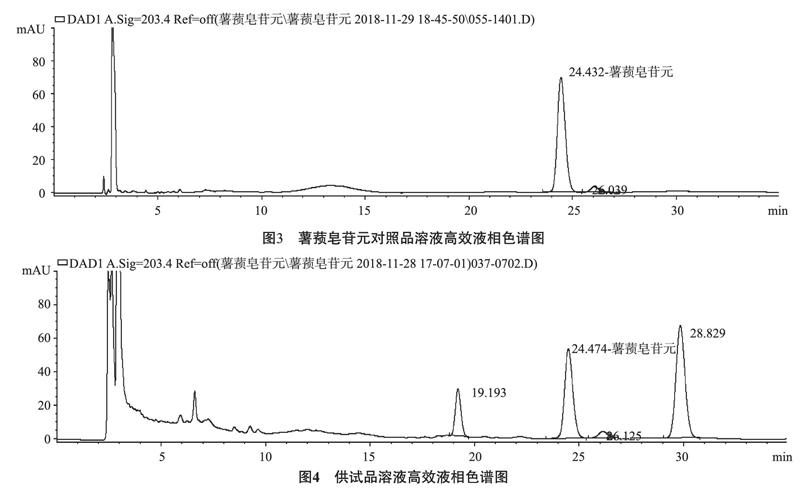
2.1 色谱条件与系统适用性 色谱柱:十八烷基硅烷键合硅胶;流动相:乙腈-水(90∶10);检测波长:203nm;流速:1.0mL/min;柱温:35℃;进样量:10μL。理论塔板数按薯蓣皂苷元峰计算应不低于5000。薯蓣皂苷元峰与前后峰分离度应大于1.5。在此色谱条件下,薯蓣皂苷元对照溶液色谱图和供试品溶液色谱图如图3~4所示。
2.2 溶液制备
2.2.1 供试品溶液制备 取本品粉末2.0g,精密称定,置具塞锥形瓶中,精密加入甲醇50mL,密塞,称定重量,加热回流1h,放至室温,再称定重量,用甲醇补足减失的重量,摇匀,滤过,精密量取续滤液25mL,置具塞锥形瓶中,蒸干,残渣加3mol/L盐酸溶液25mL使溶解,加热回流1h,取出,放至室温,用石油醚(60~90℃)振摇提取4次,每次25mL,合并石油醚(60~90℃)提取液,回收溶剂至干,残渣加甲醇溶解并转移至25mL量瓶中,加甲醇稀释至刻度,摇匀,即得。
2.2.2 对照品溶液制备 精密称取薯蓣皂苷元对照品适量,加甲醇制成每1mL含0.2mg的溶液,即得。
2.3 方法学考察 按《中国药典》2015年版四部“药品质量标准分析方法验证指导原则”(通则9101)[16]的要求进行方法验证。
2.3.1 线性关系考察 取浓度为671.6μg/mL的对照品储备液适量,加甲醇配制得53.70、100.6、144.2、263.0、671.6μg/mL的对照品溶液,摇匀。按上述色谱条件分别进样10μL,以进样量为横坐标,峰面积积分值为纵坐标,进行线性回归。本品进样量在0.5370~6.716μg的范围内线性良好,回归方程为:Y=7.4659X-8.02026(r=0.9996)。
2.3.2 重复性试验 取同一批次的供试品(批号:20130911)6份,分别按照“2.2.1”项下方法制备供试品溶液,按照上述相同色谱条件测定,按干燥品计算,薯蓣皂苷元含量的RSD为1.2%(n=6)。
2.3.3 稳定性试验 取同一批次的供试品溶液(批号:20130911),在0、2、6、12、18、24h进样测定,测得薯蓣皂苷元峰面积的RSD为0.65%。结果表明供试品溶液在24h内稳定。
2.3.4 加样回收率试验 精密称取已知含量的样品(批号:20130911)约1.0g,分别加入6个具塞锥形瓶中,分别加入对照品约3.9mg,按“2.2.1”项下方法制备供试品溶液,按上述色谱条件测定。结果见表1。
2.3.5 样品测定 按上述色谱条件测定,分别测定4个不同产地4批样品,按干燥品计算含量,结果见表2。
3 讨论
3.1 检测波长的选择 用二极管阵列检测器分析比较了薯蓣皂苷元对照品色谱峰和样品所测成分相应色谱峰的紫外光谱。试验证明,两者的紫外光谱基本一致,均在203nm处有一最大吸收峰,故选择检测波长为203nm。
3.2 流动相的选择 在其他因素不变的情况下,比较不同比例的甲醇-水、乙腈-水-冰醋酸溶液、乙腈-水作为流动相对测定结果的影响。结果表明,以乙腈-水溶液(90∶10)作为流动相,被测成分色谱峰拖尾因子和分离效果最好。因此,确定乙腈-水溶液(90∶10)为该分析方法的流动相。
3.3 色谱拄温度的选择 在其他因素不变的情况下,比较不同色谱拄温度(25℃、30℃、35℃)对测定结果的影响。结果表明,当色谱拄温度35℃时被测成分色谱峰拖尾因子和分离效果最好。因此,确定35℃为该分析方法的色谱柱温度。
3.4 考察盐酸浓度的选择 取供试品(批号:20130911),分别选用了2、3、4mol/L盐酸溶液进行水解,结果三者测定值分别为3.74、3.92、3.93mg/g,取3mol/L盐酸溶液时,已经能水解完全,考虑到经济成本,故选择3mol/L。
3.5 加热回流提取时间考察 在其它条件不变的情况下,取供试品(批号:20130911),分别进行了0.5、1、2h回流提取,结果三者测定值分别为3.61、3.92、3.91mg/g,说明1h已基本提取完全,考虑到经济和时间成本等因素,故选择加热回流提取时间为1h。
3.6 水解时间考察 取供试品(批号:20130911),选用了0.5、1.0、2.0h进行水解,结果三者测定值分别为1.92、3.94、3.91mg/g,说明1h已基本水解完全,考虑到经济和时间成本等因素,故选择水解时间为1.0h。
3.7 提取次数考察 取供试品(批号:20130911),分别进行了3、4、5次提取,结果三者测定值分别为3.55、3.93、3.94mg/g,说明4次已基本提取完全,考虑到经济和人工成本等因素,故选择提取次数为4次。
3.8 耐用性试验 《中国药典》2015年版四部“药品质量标准分析方法验证指导原则”(通则9101)[16],规范了中药质量标准分析方法,为了进一步验证“HPLC测定箭根薯中薯蓣皂苷元含量”方法的可靠性,笔者参照该指导原则以测定方法进行了验证。为了给本方法用于常规检验提供依据,对其耐用性试验进一步探讨,考察了随机变动因素对精密度的影响。考察了不同色谱柱:Agilent XDB-C18 (5μm,250mm×4.6mm);InertSustain C18 (5μm, 250mm×4.6mm);资生堂MGⅡ C18(5μm,150mm×4.6mm)、不同检测波长(201nm、203nm、205nm)。结果基本一致,进一步确保了试验方法的科学性及数据的准确性,为箭根薯质量标准的提高提供了科学依据。箭根薯的同属植物裂果薯发现较好的抗癌活性[17-19],目前对箭根薯研究报道较少,希望此研究为今后箭根薯的进一步研究、应用、开发提供参考。
参考文献
[1]云南省食品药品监督管理局.云南省中药材标准(第一册)[M].昆明:云南科技出版社,2005: 59.
[2]周俊,陈昌祥,刘润民,等.滇产箭根薯的化学成分研究[J]. 植物学报(英文版),1983,25(6):568-573.
[3]张琳.傣药藤苦参及箭根薯化学成分的研究[D]. 北京:中国协和医科大学,2005:1-154.
[4]戴闻韬.箭根薯和圆叶大黄的活性成分研究[D]. 北京:北京中医药大学,2014:8-68.
[5]王丽娟,王岩,陈声武,等.薯蓣皂苷元体内、外的抗肿瘤作用[J]. 中国中药杂志, 2002,27(10):777-779.
[6]彭晓英,周朴华,裴刚,等.薯蓣皂苷元测定方法的研究概况[J]. 湖南林业科技,2004,31(1):27-29.
[7]何焱,王继双,张鹏,等.薯蓣皂苷元药理作用及其机制研究进展[J]. 中草药, 2013 ,44(19): 2759-2765.
[8]刘梦萱,张风霞.薯蓣皂苷元抗炎作用及其机制研究进展[J]. 湖南中医杂志,2016, 32(6) : 205-207.
[9]刘梦萱,张风霞,荀丽英,等.薯蓣皂苷元降血脂作用及其机制研究进展[J].中华中医药学刊,2016,34(4): 798-800.
[10]曾倩倩,孙贝贝,罗卓玛,等.薯蓣皂苷元衍生物的合成及其抗肿瘤活性和细胞毒性研究[J]. 天然产物研究与开发, 2017,29(9): 1455-1463.
[11]邓运宗,孙向东,郭寒冰,等.薯蓣皂苷元对三阴乳腺癌细胞系HCC1937增殖及凋亡的影响[J]. 中华实用诊断与治疗杂志,2017,31(7): 657-659.
[12]国家药典委员会.中华人民共和国药典(一部)[M] .北京:中国医药科技出版社,2015: 1309-1310.
[13]朱祥松,张德军.HPLC测定金刚藤颗粒中薯蓣皂苷元的含量[J]. 中国医药指南,2010,8(33): 45-46.
[14]杜易平,龚成明,李楠,等.穿山龙中薯蓣皂苷元的萃取与测定[J]. 中成药,2017,39(11): 2409-2411.
[15]罗静,沈昱翔,周浓,等.HPLC法测定14个不同产地滇重楼中薯蓣皂苷元的含量[J].中国药房,2015,26(21): 2965-2967.
[16]國家药典委员会.中华人民共和国药典(四部)[M] .北京:中国医药科技出版社,2015: 374-377.
[17]刘振花.裂果薯化学成分的进一步研究及TaccalonolideA的修饰[D].北京:中国科学院大学,2014:1-129.
[18]欧明春,孙悦文,刘布鸣,等.裂果薯醇提物对人肝癌裸鼠移植瘤生长与血管生成的影响[J]. 中国实验方剂学杂志,2015,21(8):106-110.
[19]罗舜仁,邱汉琛,陈燕燕,等.裂果薯皂苷的特征图谱及总皂苷中有效组分的抗肿瘤活性研究[J]. 天然产物研究与开发,2018,30(2): 294-298.
(收稿日期:2018-12-25 编辑:陶希睿)

