双孢蘑菇工厂化栽培中四种木霉病害的精准鉴定
宋晓霞 王 倩 隽加香 张津京 陈 辉 陈明杰 黄建春* 谢斌强
(1上海市农业科学院食用菌研究所,上海奉贤201403;2上海联中食用菌专业合作社,上海金山201516)
双孢蘑菇栽培量占世界总食用菌产量的31.8%[1]。中国双孢蘑菇工厂化栽培起步较晚,但增长速度却很快[2],其中劳动力成本低、原材料来源广泛、环保要求低、鲜菇市场需求量大、地方政府支持力度大等是主要原因[3]。但与国外发达国家的双孢蘑菇工厂化栽培相比,我国双孢蘑菇工厂化栽培存在着设备设施精准度和稳定性不足、生产原料质量难以控制并保持稳定、管理体制不配套等问题,使得我国将在引进和消化国外双孢蘑菇工厂化栽培技术并根据我国特有情况进行创新的道路上还要走很久[3-5],相应的病虫害数量和种类也在不断增多[6]。
木霉属(Trichoderma)真菌为世界性分布真菌,可以在多种基质上生长:木材、纤维素、软木、几丁质、稻草、蘑菇以及植物根际环境、植物病原菌菌体、不锈钢、柴油、合成橡胶、聚乙烯以及沥青等[7],是许多食用菌栽培过程中极易感染和传播的真菌性病害[8-9]。由于许多木霉属的菌落多数呈现绿色,所以在双孢蘑菇工厂化栽培过程中,大家一看到绿色的菌落都会称为绿霉,而且许多便于企业技术人员参考的病虫害鉴定和防治的专业书籍在介绍时也统称为绿霉,并没有具体介绍是木霉属的哪个物种,更没有对应的显微形态特征和分子特征[8-9]。
精准鉴定木霉是有效预防和控制双孢蘑菇工厂化栽培中木霉病害的前提,许多学者都对木霉属的分类进行了研究[10-16],并详细描述了各个木霉属物种的显微形态特征。随后,加入了内转录间隔区(Internal Transcribed Spacer,ITS)、延伸因子 1-α(EF-1α)等分子数据的支撑[17],Druzhinina等[15]还利用每个物种的ITS1、ITS2序列发展出了一个DNA条形码系统用于快速鉴定木霉(http://www.isth.info/tools/molkey/index.php)。但专业性和生产指导性书籍之间衔接性很差,其中最关键的是缺少每个木霉物种病害特征、显微形态特征和分子数据之间的联系性。
为了建立三者之间的联系,笔者对收集到的四种木霉属病害进行病害、形态特征观察和ITS序列测定,希望能摸索出一套精准鉴定双孢蘑菇工厂化栽培过程中木霉属病害的通用方法,为企业技术人员能在生产中精准鉴定木霉属病害提供技术参考,为我国双孢蘑菇工厂化栽培事业的发展贡献力量。
1 材料与方法
1.1 病害样本收集
笔者在2018年4-7月分别在上海联中食用菌专业合作社(以下简称联中)和山东临沂瑞泽生物科技股份有限公司(以下简称瑞泽)的双孢蘑菇工厂化出菇房采集病虫害样本,共收集到了10份木霉病害样本。具体收集过程如下:先用相机拍照病害样本,然后手戴无菌手套取2~3块表面携带病害样本的覆土或2个双孢蘑菇子实体放入无菌的塑料培养皿中(直径90 mm),用封口膜封住培养皿,平放进袋内带回实验室。整个运输过程中保证培养皿呈平放状态。等样本带入实验室后,立即在实体解剖镜下观察病害样本的形态特征、拍照,并确定菌种分离的位置。
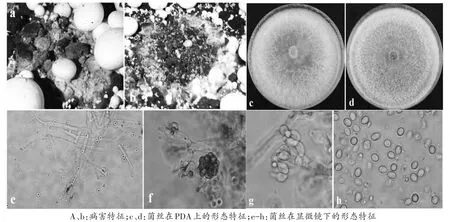
图1 绿木霉病害及形态特征
1.2 菌种分离
在超净工作台中进行菌种分离。由于木霉病害样本有许多孢子,所以分种时不通风,在近酒精灯处操作即可。用无菌的接种针轻轻接触一下菌种分离的位置,然后在事先做好的马铃薯葡萄糖琼脂培养基上划一下,封口后在25℃下暗光培养。每天观察培养皿中的菌落情况,如有细菌污染,通过不断转接挑取菌落最前沿菌丝的方式获得纯菌种;如有多种真菌,也通过挑取每个形态单一的真菌菌落最前沿菌丝的方式获得每个真菌的纯菌种。每个纯菌种各有2个培养皿。
1.3 形态鉴定
取一个快长满菌丝培养皿,揭去培养皿盖拍照,并在实体解剖镜和电子显微镜下观察菌丝的显微结构;另外1个培养皿继续培养,等产孢区出现后,开盖拍照并在实体解剖镜和电子显微镜下观察菌丝、孢子等显微结构。将观察到的形态特征与文献[16]进行比对,最终确定所属物种。
1.4 分子鉴定
利用ITS序列对各菌丝进行分子鉴定。菌丝裂解液制备、PCR反应体系、PCR反应条件及产物检测、PCR产物回收、连接、转化、克隆和测序详情参照参考文献[18]。每个菌丝测3个克隆。
用DNASTAR Lasergene 7.1.0软件中的SeqMan合并同一菌丝的ITS序列,剔除上游引物前端和下游引物后端冗余的序列,将各个物种的ITS序列递交 到 NCBI(National Center Biotechnology Information)申请GenBank号。然后,将每个菌丝的ITS序列在NCBI和 TrichOKEY:molecular Barcode数据库中进行检索以确定所属物种。
用DNASTAR Lasergene 7.1.0中的EditSeq软件统计各个物种ITS序列的碱基组成、长度和GC含量。用MEGA 7.0比对各个物种序列,并用DNAMAN 5.2.2将比对结果输出。
2 结果与分析
2.1 绿木霉Trichoderma virens
病害特征:菌丝在覆土表面呈蘑菇圈分布,里层绿色,边缘白色(图1a),随着菌落的扩大,中间部分的菌丝会变弱(图1b)。被该病害覆盖的地方,子实体萎缩或腐烂。一般在第一潮菇分布较少,但一旦出现,随着潮次的增加,病害现象不断加重,最后可能分布于整个覆土表面。该病害样本在联中采集到4份,在瑞泽采集到2份。除联中1份样品中分离到绿木霉和2种非木霉真菌之外,其他5份样品都仅分离到1种绿木霉真菌。
形态特征:菌丝在PDA平板上呈现白色、卷毛状,2~3 d长满整个平板。随着菌落不断扩大,中间部分的菌丝变弱(图1c)。25℃暗光培养3 d后开始出现产孢区,产孢区平展,从中间不断向边缘扩散,直至覆盖整个培养皿(图1d)。分生孢子梗半透明,从没有分化的菌丝上生出(图1e),向基部不分枝,向顶分枝不规则(图1e-g)。瓶梗基部缢缩,中部膨大,逐渐向顶变细,呈坛形至安瓿形(图1f,g)。分生孢子阔椭球形至倒卵圆形,基部细(图1 h),相邻瓶梗上的分生孢子常常聚合为头状体(图1f)。
ITS序列:GenBank号为MK552404,序列长度为614 nt,GC 含量为 55.54%(图 2)。在 NCBI和 Tri-chOKEY:molecular Barcode数据库中比对到的都是绿木霉。

图2 四种木霉病害的ITS序列比对
2.2 哈茨木霉Trichoderma harzianum
病害特征:大片子实体表面有褐斑,特别是菌盖表面(图3 a)。等带回实验室的第二天,褐变的菌盖表面长出许多卷毛状的白色菌丝(图3 b、c)。该病害样本在联中采集到1份,仅分离到1种哈茨木霉真菌。
形态特征:菌丝在PDA培养基上白色、卷毛状,3~4 d长满平板(图3d)。25℃暗光培养4 d后开始出现扁平产孢簇,边缘出现的较早,随着培养时间延长,许多致密的扁平产孢簇愈合为形状不规则的聚合体,边缘包围有不育的白色菌丝体。产孢区绿色至灰绿色(图3e、f)。由于分生孢子丰富,产孢区表面常呈颗粒状或者粉状(图3f)。在显微镜下,分生孢子梗透明,初级分枝几乎呈直角或稍微向顶方向弯曲,二次分枝复杂,终极分枝多数为单细胞(图3g)。瓶梗基部缢缩,中部膨大,顶部突然变细,呈安瓿形或坛形(图3h)。分生孢子亚球形至倒卵形,尖端阔圆,基部细圆(图3i)。
ITS序列:GenBank号为MK552405,序列长度为619 nt,GC 含量为 55.09%(图 2)。在 NCBI和 TrichOKEY:molecular Barcode数据库中比对到的都是哈茨木霉。
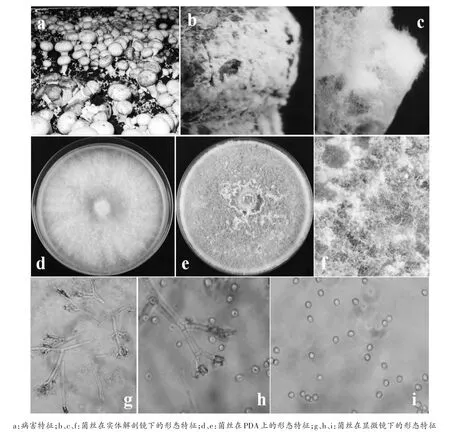
图3 哈茨木霉病害及形态特征
2.3 子座木霉Trichoderma stromaticum
病害特征:在覆土表面呈现致密的、绒毛状的白色、淡绿色或灰绿色菌落(图4a、b),被该菌落覆盖的地方,子实体萎缩或腐烂。该病害样本在联中和瑞泽各采到1份,都分离到了1种子座木霉。
形态特征:在PDA培养基上,菌丝绒毛状、雪白,6~7 d长满平板(图4c)。25℃暗光培养15 d后才出现明显的产孢区,初期为绿色,后期为灰黄色(图4d)。在显微镜下,分生孢子梗的不育和可育延伸物明显突出在孢子堆外面(图4e)。可育分生孢子梗较长,分枝少或不分枝,瓶梗位于分枝顶端,单生或成对(图4f、g)。分生孢子椭圆形或短圆柱形(图4h)。
ITS序列:GenBank号为MK552406,序列长度为618 nt,GC含量为 55.50%(图2)。在 TrichOKEY:molecular Barcode数据库中比对到的是俄罗斯木霉T.rossicum,在NCBI中比对到相似度在98%以上的物种较多,有俄罗斯木霉、T.barbatum,长枝木霉T.longibrachiatum,T.ivoriense,子座木霉T.stromaticum等,其中匹配度最高的是俄罗斯木霉。但比对俄罗斯木霉与本样本的形态特征、产孢簇特征、分生孢子梗形态都明显不同。经过逐个形态比对,最终确定该样本为子座木霉。
2.4 钩状木霉Trichoderma hamatum
病害特征:在覆土层呈现许多白色斑点(图5a、b),打水后白色斑点会消失,在实体解剖镜下观察会发现这些白色斑点为白色菌丝(图5c)。该病害样本在联中采集到1份,分离到了1种钩状木霉。

图4 子座木霉病害及形态特征
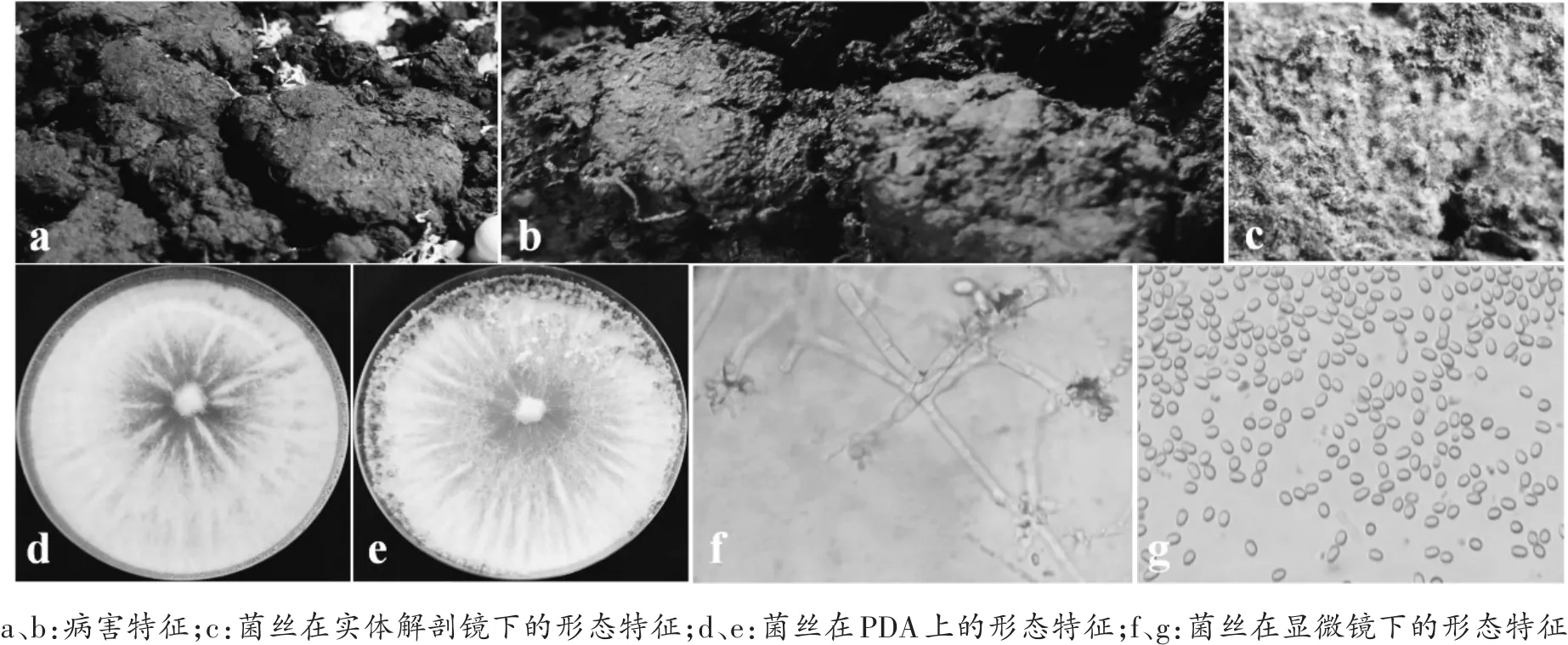
图5 钩状木霉病害及形态特征
形态特征:在PDA培养基上,菌丝白色,多数为基内菌丝,气生菌丝有限、呈卷毛状,4~5 d长满平板(图5d)。25℃暗光培养7 d后出现产孢区,产孢区垫状或半球形,初期白色,后期绿色,从菌落边缘开始生长(图5e)。分生孢子梗主轴直,多次分枝。瓶梗亚球形或安瓿形,基部缢缩,顶端突然变细,呈紧密的涡状排列(图5f),分生孢子椭球形(图5g)。
ITS序列:GenBank号为MK552407,序列长度为602 nt,GC 含量为 53.65%(图 2)。在 NCBI和 TrichOKEY:molecular Barcode数据库中比对到的都是钩状木霉。
3 小结与讨论
观察到的绿木霉、哈茨木霉、子座木霉和钩状木霉的产孢出现时间分别为3 d、4 d、15 d和7 d,绿木霉在联中和瑞泽许多菇房都采到过,而且随着双孢蘑菇潮次的增加,为害程度也上升,有的菇房在第3潮菇时整个覆土表面都会有该病害;哈茨木霉的为害面积从图4a中就能看出;子座木霉在菇床上的菌落一般都很小;钩状木霉病害面积虽然较大,但打水后白色菌丝会消失,后期覆土中也能长出子实体,并且没有病害特征出现。可见,双孢蘑菇工厂化栽培过程中某一木霉病害的为害时间、范围与该木霉产孢区出现的时间长短有关,产孢区出现时间短的木霉为害时间较长、范围较广,产孢区出现时间长的木霉为害时间较短、范围较小。因此,可从产孢区时间长短上来判断木霉病害对双孢蘑菇工厂化栽培的为害时间和范围,做好针对性的预防和控制。
虽然分子数据鉴定物种有不受环境影响、方便快捷等优势,但现在界定的木霉种类绝大多数还是基于培养、产孢簇和分生孢子梗分枝形式等形态特征,基因序列分析只作为确认手段或者特征描述的补充[16]。除子座木霉的ITS序列鉴定与形态特征不一致以外,绿木霉、哈茨木霉和钩状木霉的形态和分子鉴定结果都一致。虽然TrichOKEY:molecular Barcode数据库将子座木霉的ITS序列鉴定为俄罗斯木霉,NCBI也首推的是俄罗斯木霉,但笔者经过形态比对之后还是鉴定为子座木霉。为了保证鉴定的正确性,又将原始菌株进行重新培养、形态观察和ITS序列测定,结果是一样的,所以这里保留笔者自己鉴定的结果。
因双孢蘑菇工厂化栽培是一个开放的环境,观察到的病害样本可能是许多病害样本的混合体,所以除了精准鉴定分离到的病原菌外,最好是将分离到的病原菌进行回接试验,以确认分离到的病原菌就是引起病害微生物。因采集到病害样本的是两个较大的双孢蘑菇工厂化企业,每个菇房至少有三排三层床架,如果做回接试验造成的污染和经济损失不可估量,而实验室也无法模拟双孢蘑菇工厂化栽培的条件,所以回接试验未做。为了确定分离到的4种木霉就是引起病害的病原菌,笔者只能通过多点采样、多次分种,分种前和分种后菌丝形态保持一致等间接性证明。
多点采样和多次分种:共10份样本,每份样品分离纯化时至少取了3个不同的地方分种,每个地方又分了2个平板,如果这6个平板分出的真菌形态和分子数据都一致就认为分离到了该病害样本。10份样本中有9份仅分离到了一种真菌,而在1份从联中采集到的样本中除了绿木霉,还分离到了1株冻土毛霉Mucor hiemalis和1株被孢霉属物种Mortierellasp.。分种前就是菇床上,分种后就是PDA培养基上,分别在实体解剖镜下观察病害样本在分种前和分种后的形态特征:绿木霉无论是在菇床上还是在PDA上,随着菌落的扩大,中间菌丝都会变弱;哈茨木霉无论是在子实体上还是PDA上,菌丝都为白色卷毛状;钩状木霉无论是在覆土上还是在PDA上,气生菌丝都不如其他3种木霉那么明显等等。

