基于Cleaved caspase-9研究丹酚酸B对肝纤维化细胞凋亡的影响
阚 悦,杨 雁
(安徽医科大学基础医学院药理学教研室,安徽 合肥 230023)
肝纤维化是肝脏组织细胞外基质(extracellular matrix,ECM)异常增生和过度沉积的病理性变化[1],是所有慢性肝病的必经过程[2]。目前认为,肝纤维化是可逆的,而肝硬化、肝癌不可逆。因此,防治肝纤维化具有重要意义。抑制肝星状细胞(hepatic stellate cells, HSCs)的活化、促进其凋亡是目前抗纤维化的主要研究策略。线粒体通路是细胞凋亡的主要途径之一,激活的caspase-9即cleaved caspase-9是启动细胞凋亡的关键蛋白[3],体内实验表明,升高cleaved caspase-9的蛋白表达水平可触发细胞凋亡[4]。
丹参是治疗肝纤维化的传统中药,近年来其水溶性有效成分丹酚酸B(salvianolic acid B,Sal B)在慢性肝病治疗中得到了广泛应用[5]。体内实验表明,Sal B具有延缓二乙基亚硝胺(diethylnitrosamine,DEN)诱导小鼠肝纤维化-肝细胞癌(hepatocellular carcinoma,HCC)进程的作用[6]。体外实验表明,Sal B可抑制HSC中转化生长因子β1(transforming growth factor β1,TGF-β1)表达及其激酶的活性,来抑制体外培养的原代大鼠HSC增殖[7],抑制内源性TGF-β1的表达逆转肝纤维化[8]。
目前,Sal B对体内外HSC的抑制活化[9]及增殖作用均有报道,其抗纤维化、延缓HCC进程与调控TGF-β1/Smad通路、p-Smad3C/3L有关[6]。然而,从细胞凋亡角度观察Sal B对外源性TGF-β1刺激的HSC-T6(来源于大鼠的活化的HSCs)的影响及其对凋亡蛋白cleaved caspase-9的影响,尚未见报道。我们推测,Sal B抗肝纤维化作用可能与促进体内、体外HSCs凋亡,调控cleaved caspase-9有关。本实验采用DEN诱导小鼠肝纤维化模型,并结合体外培养HSC-T6,从细胞凋亡角度探讨Sal B对体内外肝纤维化细胞的影响,并探究Sal B对凋亡蛋白cleaved caspase-9的影响。
1 材料与方法
1.1 材料
1.1.1药物与试剂 Sal B(纯度≧95%,批号:PS12091001)、秋水仙碱(colchicine,Col)(纯度≧98%,批号:PS08092201),购于成都普思生物科技有限公司;DEN(0.95 kg·L-1)购于美国Sigma公司;TGF-β1,购于Peprotech公司;AnnexinV-FITC/PI凋亡检测试剂盒、Hoechst 33258荧光染液、Western及IP细胞裂解液、兔抗Cleaved caspase-9单克隆抗体,均购自上海碧云天生物技术有限公司;小鼠抗β-actin单克隆抗体、辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记山羊抗小鼠lgG,均购自北京中杉金桥。
1.1.2实验动物与细胞株 50只健康♂昆明系小鼠,SPF级,体质量(20±2)g,由安徽医科大学实验动物中心提供,许可证号:sexk(皖)2011-002。大鼠肝星状细胞株HSC-T6,购于中国科学院上海细胞库,于37 ℃、5% CO2、饱和湿度的无菌培养箱中培养。
1.1.3仪器 JA1003电子天平(上海精科仪器有限公司);荧光倒置显微镜(日本Olympus 公司);LEICA RM2035型生物组织切片机(湖北孝感市亚光医用电子技术公司);超净工作台(苏州净化设备有限公司);Napco-6100型CO2培养箱(美国杜邦公司);流式细胞仪(美国BD公司)。
1.2 方法
1.2.1肝纤维化模型的制备及Sal B干预 适应性饲养7 d后,将50只小鼠随机分为5组:正常组、模型组、Sal B低、高剂量(15、30 mg·kg-1)组、阳性药秋水仙碱(0.2 mg·kg-1)组,每组10只。正常组小鼠注射无菌的生理盐水,其余4组注射1.0% DEN溶液来诱导肝纤维化模型,每组按照体质量10 mL·kg-1腹腔注射给药,同一时间每周1次,共12周。在此基础上,Sal B低、高剂量组及阳性药秋水仙碱组于造模当天开始灌胃,正常组小鼠给予相应溶媒灌胃,每天同一时间段给药至12周末。于12周末处死小鼠,取材,按照步骤进行组织的固定、病理检测以及蛋白表达检测。
1.2.2HSC-T6细胞株的培养、分组及TGF-β1干预 HSC-T6培养于含有10%胎牛血清的DMEM高糖培养基中,置于37 ℃、5% CO2饱和湿度的培养箱中无菌培养。每2~3 d传代,细胞状态良好时消化,6孔板中培养至对数生长期。实验分为6组:对照组、TGF-β1组、Sal B组(Sal B 25、50、100 μmol·L-1+TGF-β1)、Sal B对照组(Sal B 50 μmol·L-1)。待6孔板内细胞处于对数生长期,将培养基更换为无血清的DMEM,继续培养24 h,避光环境下配制低、中、高浓度Sal B溶液(现配现用),于Sal B组和Sal B对照组加入相应浓度的Sal B,继续培养24 h,终止培养前6 h,于TGF-β1组和Sal B组加入TGF-β1(9 pmol·L-1)。
1.2.3HE染色法评估病理学特征并确定纤维化病变区域 小鼠腹部正中切口,无菌条件下打开腹腔,摘除整个肝脏,选取小鼠肝脏左叶,采用4%多聚甲醛固定,常规步骤进行梯度乙醇脱水,浸蜡,石蜡包埋,4 μm切片,烤片,脱蜡,苏木精-伊红(HE)染色。常规步骤脱水,透明,干燥,中性树胶封固。按照标准实验操作规范,使用数字扫描仪显微镜,每组随机拍摄图片10张,请病理老师阅片,确定纤维化病变程度。
1.2.4Hoechst 33258荧光染色法检测细胞凋亡情况 切片梯度乙醇脱蜡后,用PBS或0.9% NaCl洗2遍,每次3 min,吸尽切片上的液体后,于玻片侧边轻轻滴加0.5 mL Hoechst 33258染色液,倾斜玻片,让染色液慢慢浸过组织切片表面,避光均匀染色5 min,PBS清洗2遍去除染色液。染色后吸尽表面液体,滴加抗荧光猝灭液于组织切片上,镊子夹取洁净盖玻片盖上,避光环境下,在荧光显微镜下观察和拍摄图片,每个样本随机拍摄10张,保持曝光度和对比度一致。
1.2.5流式细胞术检测HSC-T6细胞凋亡率 将培养至对数生长期的HSC-T6细胞均匀种于6孔板内,更换为无血清的DMEM培养基,Sal B组分别加入浓度为25、50、100 μmol·L-1的Sal B,Sal B对照组加50 μmol·L-1的Sal B,37 ℃继续培养24 h,终止培养前6 h,于Sal B组和TGF-β1组加TGF-β1进行干预。用不含EDTA的胰酶消化离心后,收集细胞,调整细胞浓度为1.0×109·L-1,冷PBS洗涤细胞2次后,分别加入400 μL Annexin V结合液和5 μL Annexin V-FITC染色液,轻轻混匀后,于2~8 ℃孵育15 min,加入5 μL PI染色液混匀后,于2~8 ℃孵育5 min。染色完成后用流式细胞仪上机检测,采用Flowjo软件进行分析,实验重复3次。
1.2.6Western blot法检测小鼠肝组织和HSC-T6中cleaved caspase-9蛋白的表达 常规方法分别提取小鼠肝组织和HSC-T6细胞中的蛋白,采用BCA法定量样本蛋白浓度,PBS缓冲液调整各样本蛋白提取液至同一浓度水平。常规步骤进行SDS-PAGE电泳、转膜、5%脱脂奶粉封闭,分别以抗β-actin、cleaved caspase-9抗体,4 ℃孵育过夜,TBST洗膜3次,每次10 min,继而以相应的辣根过氧化物酶标IgG常温孵育120 min,TBST洗膜3次,每次10 min,ECL法曝光显影。采用Image J软件进行灰度值分析,结果以目的蛋白与内参蛋白β-actin条带的灰度值比值表示。
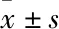
2 结果
2.1 Sal B对DEN诱导的纤维化小鼠肝组织病理学的影响Fig 1的HE染色结果显示,12周时正常组小鼠肝小叶结构完整,有肝小叶和汇管区、肝细胞的细胞核呈圆形,着色较浅,位于细胞中央。与正常组比较,模型组纤维化程度明显,表现为细胞大小不一,能清楚地观察到肝小叶被分隔成假小叶,提示DEN诱导小鼠12周为肝纤维化时期。Sal B低、高剂量组纤维化程度均轻于模型组,且未形成假小叶结构。HE染色结果提示,Sal B能够改善DEN诱导的肝纤维化期小鼠肝组织病理学变化,并确定纤维化病变区域。
2.2 Sal B对DEN诱导的纤维化小鼠肝组织中细胞凋亡的影响在HE染色确定纤维化病变区域的基础上,采用Hoechst 33258荧光染色法对同一区域进行染色。如Fig 2所示,低倍镜下,正常组呈现弥散均匀的蓝色荧光,模型组呈现较浅的絮状蓝色;与模型组相比,Sal B低、高剂量组在纤维化病变区域呈现明显的蓝白色荧光。高倍镜下,正常组肝细胞核呈圆形或椭圆形,呈现弥散均匀的蓝色,致密浓染的颗粒状荧光为凋亡细胞核,凋亡细胞均匀分布在组织中;模型组高倍镜下呈现浅蓝色,大量细胞核形态不规则,失去正常形态,仅发现少量荧光碎片;与模型组相比,Sal B低、高剂量组在纤维化区域呈现大面积的致密浓染的荧光,其中高剂量组高倍镜下荧光强度最大,提示Sal B能够有效促进纤维化区域的细胞凋亡,尤以高剂量最佳。
2.3 Sal B对DEN诱导的纤维化小鼠肝组织中cleaved caspase-9蛋白表达的影响如Fig 3所示,与正常组相比,模型组小鼠肝组织中cleaved caspase-9蛋白表达量降低;与模型组比较,Sal B低、高剂量组cleaved caspase-9表达明显升高。提示Sal B能够明显升高肝纤维化组织中cleaved caspase-9的表达水平。
2.4 Sal B对TGF-β1刺激的HSC-T6凋亡的影响流式细胞术检测结果显示(Fig 4),TGF-β1组与对照组相比,凋亡率明显下降(P<0.01),提示TGF-β1抑制HSC-T6的凋亡。Sal B药物对照组与对照组相比,凋亡率上升,提示Sal B有促凋亡的作用(P<0.01)。Sal B组(TGF-β1+Sal B 25、50、100 μmol·L-1)与TGF-β1组相比,凋亡率上升,且呈现浓度依赖性(P<0.01),提示Sal B对经TGF-β1刺激的HSC-T6仍有促进凋亡的作用。
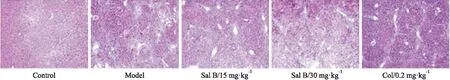
Fig 1 Effect of Sal B on hepatic fibrosis in DEN induced mice(HE,×100)
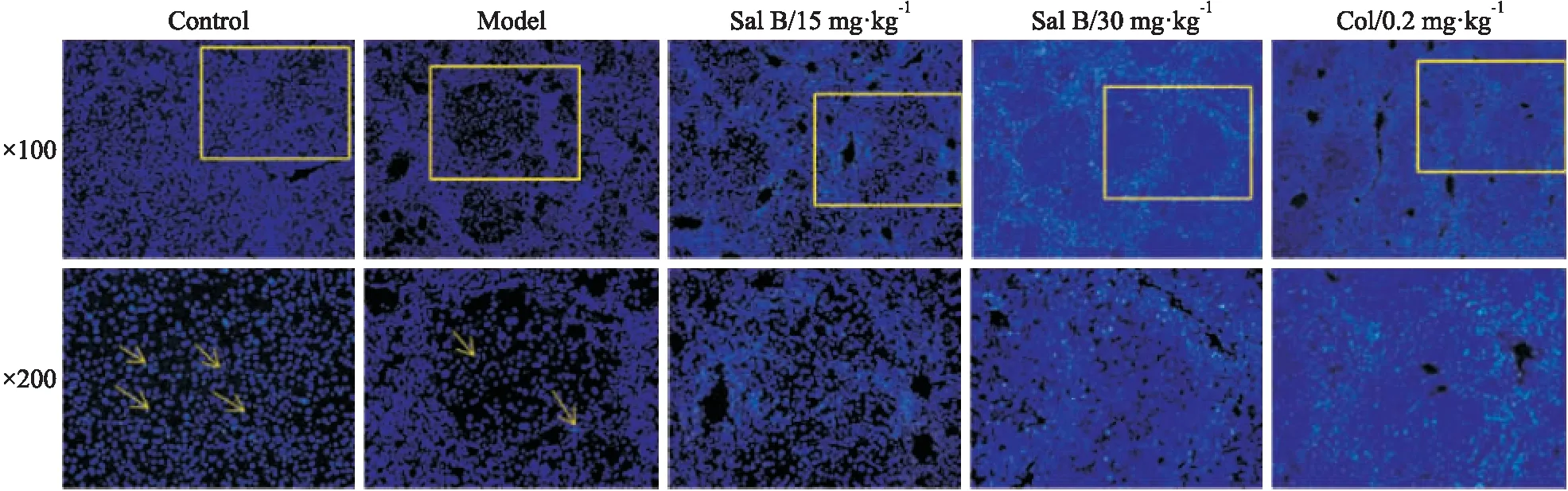
Fig 2 Effect of Sal B on apoptosis of liver tissues in DEN induced fibrotic mice(Hoechst 33258 staining)
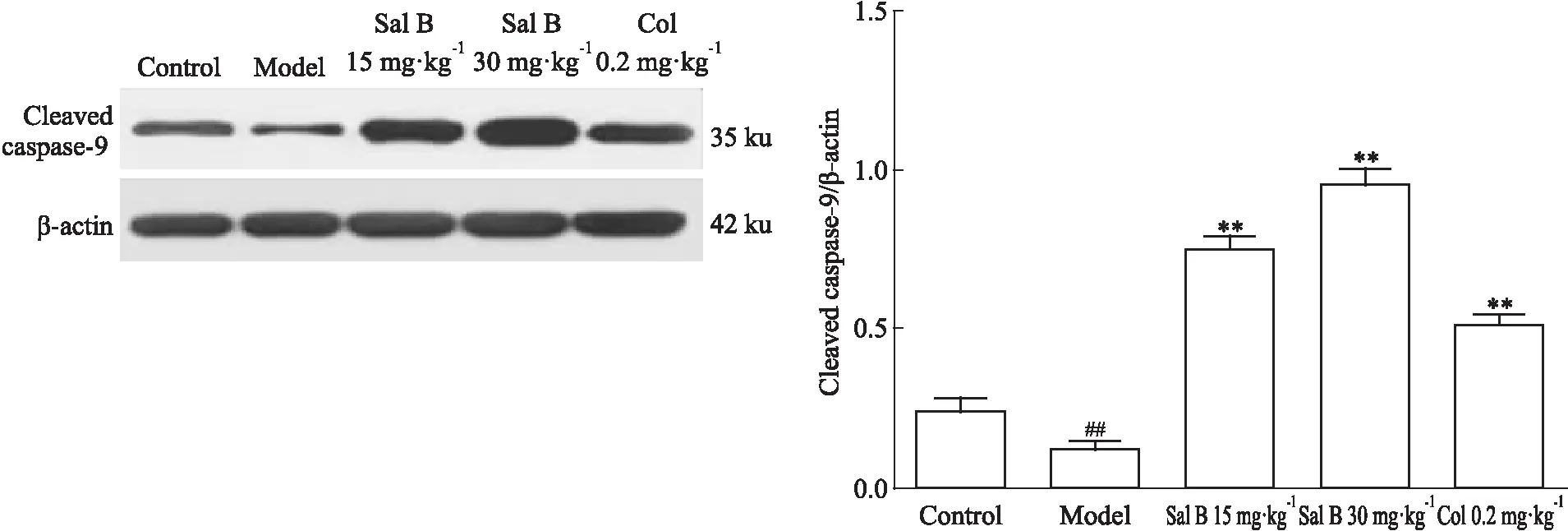
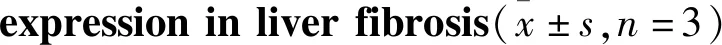
##P<0.01vscontrol;**P<0.01vsModel
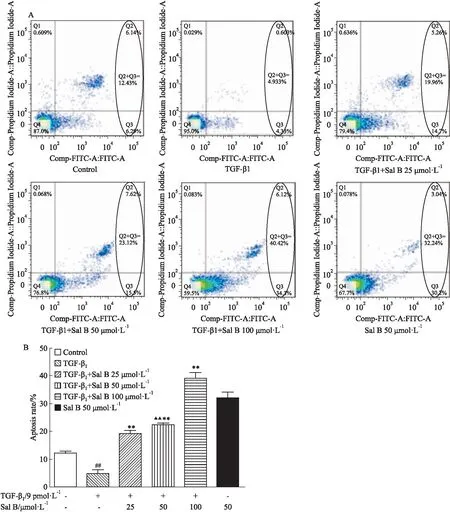
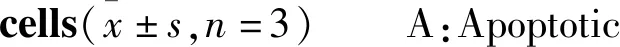
2.5SalB对TGF-β1刺激的HSC-T6中cleavedcaspase-9蛋白表达的影响Fig 5的Western blot结果显示,与对照组相比,TGF-β1组cleaved caspase-9蛋白表达量降低(P<0.01),药物对照组(Sal B 50 μmol·L-1)的凋亡率上升(P<0.01),提示TGF-β1降低cleaved caspase-9的表达,Sal B升高cleaved caspase-9表达水平;与TGF-β1组相比,Sal B组(TGF-β1+Sal B 50 μmol·L-1)cleaved caspase-9蛋白表达量明显升高(P<0.01),提示Sal B能够升高TGF-β1刺激的HSC-T6中cleaved caspase-9的表达水平。
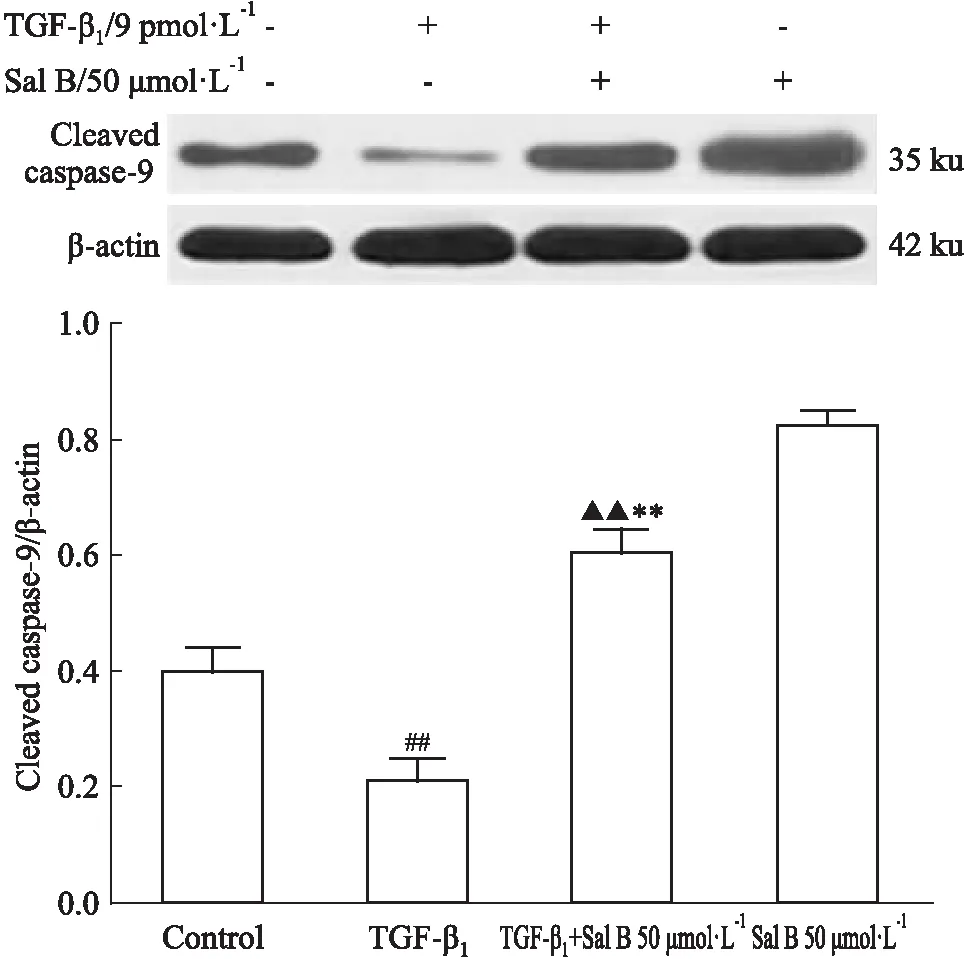
Fig 5 Effect of Sal B on expression of cleaved-caspase-9 in HSC-T6 cells stimulated by
##P<0.01vscontrol;**P<0.01vsTGF-β1;▲▲P<0.01vsSal B 50 μmol·L-1
3 讨论
肝纤维化是肝硬化、肝癌等肝病发生的关键环节,目前已有大量肝纤维化动物实验证实,肝纤维化是一种可逆的瘢痕修复反应,在其形成过程中进行适当干预可阻断,甚至逆转肝纤维化[10]。本实验采用DEN腹腔注射给药诱导肝纤维化模型,实验结果表明,12周末小鼠肝脏切片模型组HE染色能够发现明显的假小叶结构,具备肝纤维化的基本特征,提示DEN诱导小鼠肝纤维化模型制备成功。
肝纤维化主要由于ECM过度沉积所致,而活化的HSC是ECM的主要来源,HSC活化为成纤维样细胞是公认的肝纤维化进展中的重要环节[11],因而通过促进活化的HSC凋亡是目前研究抗纤维化的热点,但是在组织中我们无法直接辨认出凋亡的是否是HSC。因此,本实验采用HE染色来确定纤维化的病变区域,在同一区域采用Hoechst 33258进行荧光染色检测细胞凋亡情况。结果显示,Sal B低、高剂量组与模型组相比,纤维化病变区域呈致密浓染的颗粒状荧光明显增多,即凋亡的纤维化细胞明显增多,提示Sal B促进纤维化肝组织中活化的HSC细胞凋亡。
本实验采用HE、Hoechst 33258两种染色方式,在体内的细胞水平上提示了Sal B促进HSC的凋亡,为进一步探究Sal B可能的促凋亡机制,采用体外培养活化的肝纤维化细胞HSC-T6,Annexin V-FITC/PI双染法检测凋亡率。结果提示,TGF-β1可明显抑制HSC-T6凋亡,Sal B可促进经TGF-β1刺激的HSC-T6的凋亡,且随着药物浓度的增加,凋亡率也随之增加。体内外实验结果均提示,Sal B能够明显促进体内外HSC凋亡。
细胞凋亡关联到一系列调控因子,主要受细胞内凋亡蛋白的调控,pro-caspase-9是线粒体通路的启动者,线粒体释放细胞色素C后,pro-caspase-9可以与细胞色素C及信号接头分子Apaf-1结合并形成复合物,同时自身被剪切为cleaved caspase-9,cleaved caspase-9进一步激活下游的凋亡执行者caspase-3,进行一系列级联反应,从而导致细胞凋亡的发生[11-12]。本实验检测了Sal B对小鼠肝纤维化组织及HSC-T6细胞中cleaved caspase-9蛋白表达的影响。体内实验结果表明,与模型组相比,Sal B低、高剂量组均能够明显上调cleaved caspase-9的表达;体外实验结果表明,TGF-β1能够下调cleaved caspase-9蛋白表达,Sal B组(TGF-β1+Sal B 50 μmol·L-1)可明显上调cleaved caspase-9的表达,体内外实验均提示Sal B促肝纤维化细胞凋亡与上调cleaved caspase-9表达相关。
综上,Sal B能够有效促进体内外HSCs的凋亡,其促凋亡机制可能与上调cleaved caspase-9蛋白表达有关。本实验为进一步明确Sal B抗肝纤维化的机制研究提供了依据,为临床治疗提供帮助。