应用钛表面二氧化钛纳米管诱导牙周膜干细胞成骨分化的实验研究
迟丹丹 徐海峰 李阳
种植材料对机体内牙种植体成功植入十分重要[1]。以往临床上多应用钛以及钛合金作为种植材料,但是仍存在骨诱导性差、生物活性低、金属离子释放、塑性行变等问题[2]。目前纳米仿生表面修饰逐渐应用于钛种植体上,研究显示二氧化钛纳米管加在BMP-2后能够促进成骨细胞的黏附与生长、骨向分化[3]。牙周膜中的牙周膜干细胞(human periodontal ligament stem cells,hPDLSCs)具有成脂、成骨以及神经分化的能力[4]。本研究通过在采用阳极氧化法在钛金属表面制备双层二氧化钛并通过羰基二咪唑、rhBMP-2化学修饰法构建复合生物活性层,并在其上培养hPDLSCs,探究二氧化钛纳米管表面处理对hPDLSCs成骨分化的影响,为钛种植体在临床应用提供一定的参考。
1 材料与方法
1.1 主要仪器与试剂
蛋白凝胶成像仪、荧光定量PCR仪(Bio-Red公司, 美国); 流式细胞仪(Thermo Fisher Scientific公司,美国); 碱性磷酸酶染色剂、β-甘油磷酸钠、抗坏血酸、茜素红(Sigma 公司, 美国); 2×SYBR Premix Ex Taq II [宝生物工程(大连)有限公司]; 胎牛血清、DMEM培养基、 兔抗人ALP、 OCN、 CD44、 CD90、 CD146、 CD105、 BMP2、 RUNX2抗体(Gibco公司, 美国);辣根过氧化物酶标记山羊抗兔二体(R&D公司, 美国); RNA提取和反转录试剂盒均(北京天根生化科技有限公司)。
1.2 hPDLSCs分离、培养
选择因正畸治疗需要所拔除的第三磨牙,按常规方法分离、 原代和传代培养hPDLSCs, 第三代时用于后续研究。
1.3 hPDLSCs细胞鉴定
1.3.1 显微镜下观察hPDLSCs细胞形态 取原代细胞以及培养至第3 代的hPDLSCs细胞培养3 d的后置于显微镜观察细胞形态。
1.3.2 流式细胞仪检测hPDLSCs细胞 将hPDLSCs细胞用胰蛋白酶进行消化后,制备细胞悬浮液分别添加在4 个流式管内,A管入5 μl CD44-FITC,B管内加入5 μl CD105-FITC 单抗CD90-APC 单抗,C管内加入5 μl CD146-PE单抗,D管为空白对照组。将所有流式管置于4 ℃冰箱中孵育45 min, PBS清洗后离心收集细胞,制成细胞悬浮液,流式细胞仪测定。
1.3.3 细胞生长曲线测定 将第三代培养的hPDLSCs细胞用胰蛋白酶进行消化后,制备细胞悬浮液调整细胞密度为4×103个/L接种细胞培养板,加入成骨诱导培养基在37 ℃ 5% CO2培养箱进行培养, 在450 nm波长测定培养液A值,绘制生长曲线。
1.4 hPDLSCs诱导培养
1.4.1 钛片处理 钛片尺寸(Ti-6Al-4V)为1 mm×1 mm×0.01 mm,采用钛金属表面处理器进行处理,参数设置:电压为520 V,电泳缓冲液中钙磷比为2.14∶1,处理后采用激光切割为小钛箔片,并用碳化硅金相砂纸将将钛片打磨抛光,随后在无水乙醇、丙醇溶液中进行超声波清洗,高压灭菌后备用。
1.4.2 二氧化钛纳米管制备 在电解槽中添加浓度为88 mmol/L的氟化铵乙二醇电解液,试件为阳极,石墨作为阴极,预先活化电解液30 min,随后采取两步法制备双层二氧化钛纳米管:①电压设置为60 V,电解2 h后超声清洗去掉表面阻挡层;②恒定电压设为12 V,电解40 min后完成双层二氧化钛纳米管,用去离子水超声清洗后,干燥后备用。
1.4.3 羰基二咪唑-rhBMP-2处理二氧化钛纳米管 将双层二氧化钛纳米管置于20 g/L含丙酮的羰基二咪唑溶液中充分混匀30 min,用丙酮溶液清洗后,干燥后备用。将预处理后的羰基二咪唑加入500 μl 0.1 g/L rhBMP-2/PBS溶液,清置于37 ℃摇床上, 30 r/min 24 h,丢掉上层溶液后,在PBS溶液中清洗2 次后干燥后置于4 ℃冰箱中备用。
1.4.4 实验分组 实验主要分为3 组。实验组:将处理后钛片置入培养板内,取单细胞悬浮液,调整细胞密度为5×104/ml,接种钛片表面,添加DMEM培养基没过钛片培养,3 d后在电镜下观察钛片表面hPDLSCs细胞粘附情况。阳性对照组:取单细胞悬浮液,接种于成骨诱导培养基(含10%胎牛血清, 0.1 μmol/L地塞米松, 0.5 mmol/L β-甘油磷酸钠, 50 mg/L维生素C的DMEM)进行培养。空白组:取单细胞悬浮液,接种于DMEM培养基进行培养。
1.5 碱性磷酸酶(Alkaline phosphatase,ALP)与茜素红染色检测
取单细胞悬浮液接种于放置载玻片的6 孔细胞培养板中,培养11 d后进细胞染色,培养结束PBS溶液清洗细胞,加入多聚甲醛进行固定30 min,PBS溶液清洗后,加入ALP与茜素红染色剂染色30 min,PBS清洗后,将切片置于显微镜下观察记录。
1.6 RT-PCR法测定hPDLSCs细胞DMP-1、Runx-2、Osterix、OCN表达
将培养11 d后的细胞收集后进行RNA提取并反转录为cDNA,RT-PCR反应体系:10×cDNA模板1 μl, 上下游引物各0.5 μl, H2O 8 μl,10 μl 2×SYBR Mix。按照反应程序95 ℃ 3 min, 94 ℃ 10 s、 60 ℃ 20 s, 72 ℃ 2 min, 30 cycles, 72 ℃10 min, 以GAPDH作为内参按照2-ΔΔCq算法进行基因相对定量表达分析。
1.7 Western blot检测hPDLSCs细胞DMP-1、Runx-2、Osterix、OCN蛋白表达
收集hPDLSCs细胞,加入蛋白裂解液在冰上裂解后离心收集上清,提取总蛋白后采用PAGE-SDS电泳分离蛋白,结束后将蛋白凝胶转移至PVDF膜上,行转膜反应,加入封闭液后,加入一抗稀释液(DMP-1、 Runx-2、 Osterix、 OCN抗体), 4 ℃震荡过夜,清洗后加入二抗稀释液,室温下孵育2 h,用凝胶成像仪对蛋白表达结果进行分析。
1.8 统计学方法
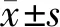
2 结 果
2.1 hPDLSCs细胞鉴定
显微镜观察显示原代细胞培养第4~5 天细胞逐渐聚集形成纤维状,细胞呈梭形,紧密相邻(图 1A)。细胞培养至第三代时,细胞迅速贴壁均匀生长细胞形态较单一,恢复至长梭形(图 1B)。生长曲线见图 2。
流式细胞仪检测结果显示,hPDLSCs表面CD44阳性表达率为99.2%,CD146为29.3%,CD105为3.7%,CD90为99.5%,符合牙周膜干细胞表面特异性标记物特征(图 3)。
2.2 钛片表面变化以及hPDLSCs细胞粘附情况

图 1 hPDLSCs细胞形态 (×100) 图 2 hPDLSCs生长曲线
Fig 1 Morphology of hPDLSCs (×100) Fig 2 Growth curve of hPDLSCs
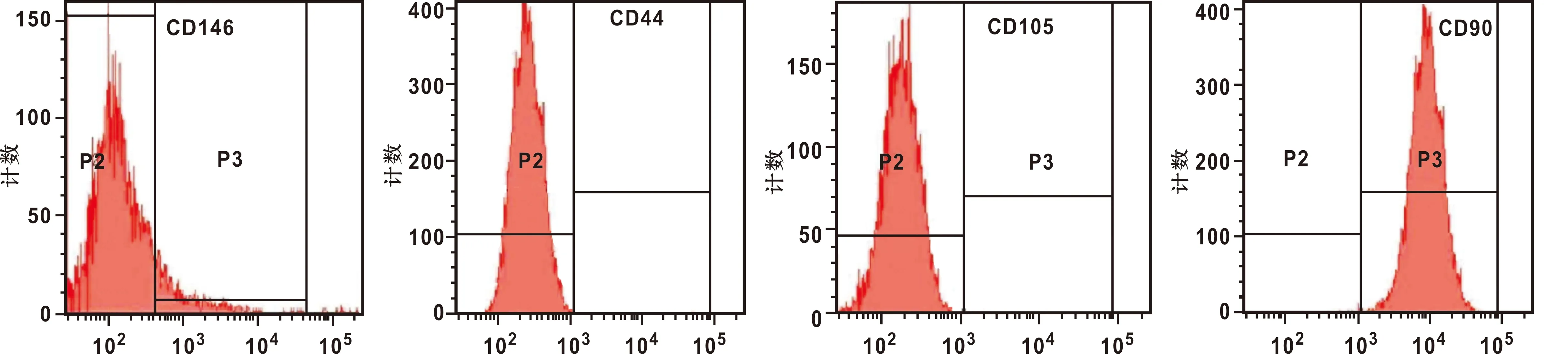
图 3 hPDLSCs细胞表面抗原细胞(FCM)
扫描电镜显示羰基二咪唑、rhBMP-2处理后的钛片表面双层纳米管阵排列整齐,内外管紧密相连,表面出现粟粒状颗粒(图 4),hPDLSCs细胞细胞粘附于钛片表面,表面饱满光滑,突起状互相连接(图 4)。
2.3 ALP、茜素红染色结果
hPDLSCs细胞ALP染色显示细胞核染色呈蓝紫色,细胞质呈淡紫色(图 5),阳性对照组以及实验组ALP阳性细胞数、钙结节数量明显多于空白对照组(图 5)。
2.4 DMP-1、Runx-2、Osterix、OCN基因表达
与空白对照组相比,阳性对照组与实验组 hPDLSCs细胞DMP-1、Runx-2、Osterix、OCN基因表达量均升高,差异有统计学意义(P<0.05)(图 6)。
2.5 DMP-1、Runx-2、Osterix、OCN蛋白表达
Western blot 结果显示,阳性对照组与实验组 hPDLSCs细胞DMP-1、Runx-2、Osterix、OCN蛋白表达量均高于对照组,差异有统计学意义(P<0.05)(图 7, 表 1)。

图 4 扫描电镜观察
3 讨 论
对钛表面氧化层进行预处理后能够改变表面生物活性,使有机硅烷以及光敏物质与氧化层强力结合,将多肽、细胞生长因子等固定其表面,引导发生特异组织学行为[5]。近期较多研究对钛表面进行处理使其发生羟基化后再经过交联剂向外接枝偶联来构建新型表面生物活性材料[6]。目前常用的交联剂主要有羟基二咪唑、聚多巴胺、硅烷化、聚乙二醇等[7]。本研究将二氧化钛纳米管阵列作为基体,羰基二咪唑作为中间体,外接rhBMP-2,因为二氧化钛纳米管表面粗糙,具有抑菌作用,rhBMP-2能够为早期细胞生长提供一定的微环境, 但由于半衰期较短因此通过虹吸与二氧化钛表面缓解其释放速度;羰基二咪唑与rhBMP-2通过共价结合产生更为稳定的物理吸附作用,在机体内存留的时间更为持久。
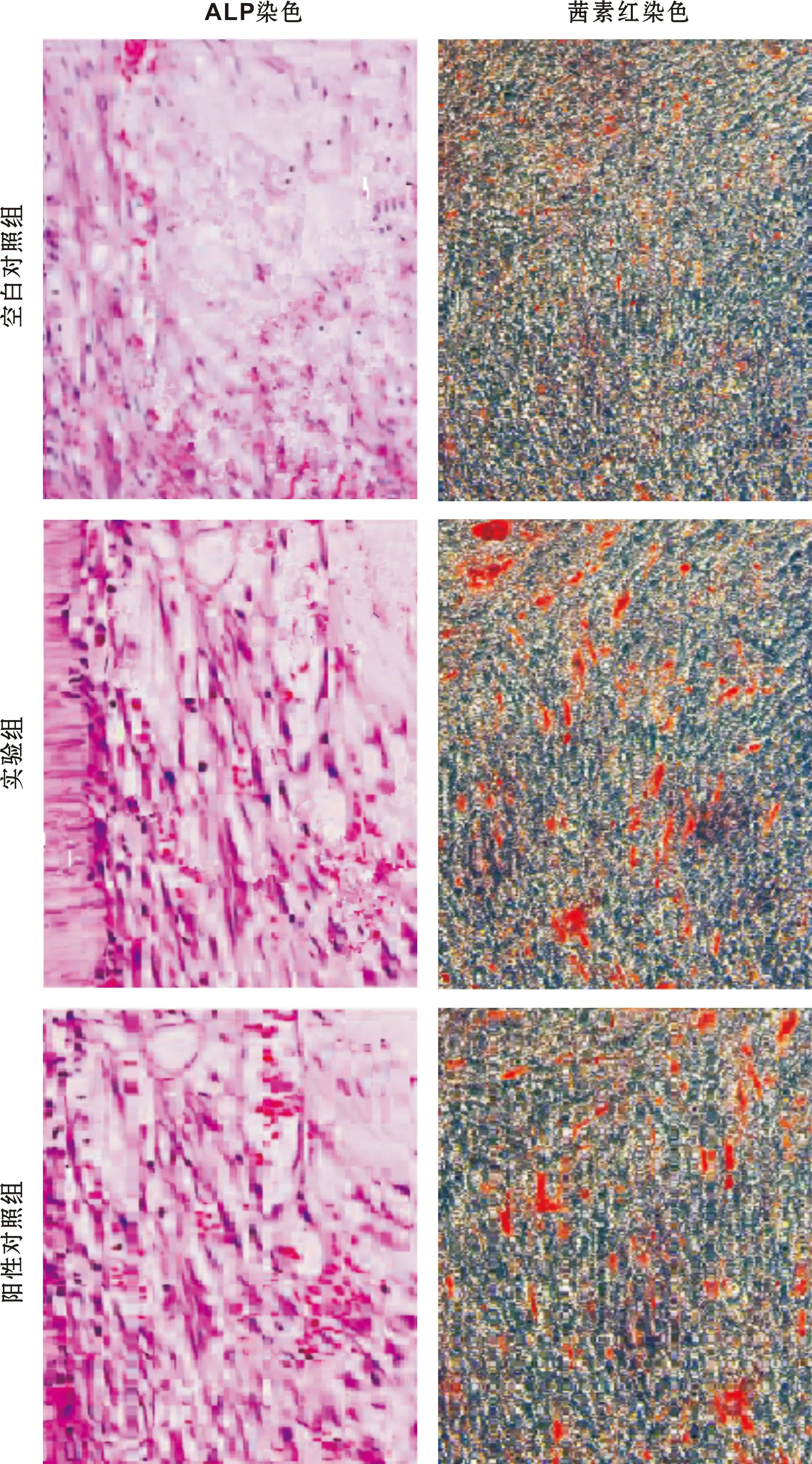
图 5 hPDLSCs细胞ALP、茜素红染色
(×100)
Fig 5 ALP and alizarin red staining of hPDLSCs
(×100)
本研究培养的hPDLSCs符合典型细胞特征[8]。流式细胞仪检测显示hPDLSCs细胞CD90、CD44高表达,CD146、CD105低表达,与国外相关文献报道结果相符合[9]。较多研究均证实骨髓间充质干细胞、牙髓干细胞均能够在钛表面进行成骨分化[10]。动物研究研究发现成骨细胞能够粘附在钛表面进行增殖分化[11],还有相关研究显示钛表面的粗糙、内部多孔构造,能够使提高材料表面的生物相容性,加大亲水性,促进细胞的吸附,细胞在钛金属表面粘附率达70%[12]。本研究扫描电镜显示羰基二咪唑、rhBMP-2处理后的钛片表面双层纳米管阵排列整齐, 内外管紧密相连,表面出现粟粒状颗粒,表明二氧化钛纳米管-羟基二咪唑-rhBMP-2复合生物层内部结构有利于细胞粘附生长。ALP与钙结节染色是评价细胞成骨能力的重要检测方法,ALP是成骨细胞中重要的膜结合蛋白,能够分解磷酸化合物产生磷酸盐离子,聚集于骨组织中, 茜红素能使富含钙离子物质着色[13], 本研究显示阳性对照组以及实验组ALP染色程度均明显高于空白对照组, 提示hPDLSCs细胞在二氧化钛纳米管-羟基二咪唑-rhBMP-2复合生物层具有成骨分化能力,进一步说明钛片上存在骨基质,hPDLSCs细胞趋向成熟矿化。
图 6 hPDLSCs细胞DMP-1、 Runx-2、 Osterix、 OCN基因表达情况
Fig 7 Protein expression of DMP-1, Runx-2, Osterix and OCN in hPDLSCs
Runx2在充质间干细胞分化成骨祖细胞过程中发挥着关键作用,是成骨重要性标准,Osterix位于Runx2下游,两者均属于细胞核内重要转录因子[14]。动物研究证实Runx-2基因缺失后骨细胞无分化能力,Osterix基因敲除后成骨细胞丧失分化功能,骨形成受到阻碍[15]。DMP-1属于磷酸化非胶原蛋白,在牙本质和骨骼中大量表达,在牙本质形成中起到关键性作用。动物研究显示敲除DMP-1后小鼠出现骨软化、佝偻病等骨骼缺陷病症,还有研究显示DMP-1由于具有自身结构具有酸性结构域能够集合钙离子形成磷酸钙结晶,因此与骨细胞矿化关系密切[16]。OCN主要存在于牙本质、软骨、 骨中是骨形成标志性物质。本研究结果显示阳性对照组与实验组 hPDLSCs细胞DMP-1、 Runx-2、Osterix、OCN基因、蛋白相对表达量均高于对照组,说明hPDLSCs细胞在二氧化钛纳米管-羟基二咪唑-rhBMP-2复合生物层上培养也具有一定的成骨分化能力,可能通过控制成骨相关基因DMP-1、Runx-2、Osterix、OCN来实现。

Tab 1 Scanning gray values of DMP-1, OCN, Runx-2 and Osterix protiens in hPDLSCs

n=10)
注: ①与阳性对照组相比,P<0.05; ②与实验组相比,P<0.05
综上所述,hPDLSCs细胞在二氧化钛纳米管-羟基二咪唑-rhBMP-2复合生物层上粘附生长具有一定的成骨分化能力,能够影响成骨相关蛋白DMP-1、Runx-2、Osterix、OCN的表达。本研究也存在一定的局限,未对比不同钛材料对hPDLSCs细胞成骨分化的影响,有待后续进行深入研究。

