PCR-HRM方法分析16S rRNA基因进行细菌鉴定的可行性研究*
邱会茹,王佳琳,薛文成,杨 婧,任 微
(1.锦州医科大学北部战区总医院研究生培养基地,辽宁锦州 121000;2.北部战区总医院a.检验科;b.感染控制科,沈阳 110016)
目前临床上引起感染的病原菌种类繁多,传统表型等鉴定方法已不足以满足细菌感染性疾病临床诊断的需要。操作简单、准确的诊断方法对于病原菌的早期鉴定十分重要[1]。一个快速、可靠的诊断平台,可以提供广泛的病原菌筛查和特定的感染性细菌鉴定,对于实现感染性疾病的早期诊断、科学指导患者进行个体化抗生素治疗具有重大意义[2-3]。
近年来,PCR扩增产物的高分辨熔解曲线(HRM)分析技术有望为临床常见感染菌的鉴定提供一种快速、经济的鉴定方法[4]。目前,16S rRNA不同结构域在细菌鉴定中的功能已得到明确分析和广泛认可,已有多篇研究报道16S rRNA可用于鉴定临床分离菌[5]。本文对基于16S rRNA基因进行HRM分析鉴定细菌的可行性进行研究,以实现常见临床感染菌的早期诊断及治疗。
1材料和方法
1.1 菌株来源 收集中国人民解放军北部战区总医院2017年8月~2018年10月期间临床分离的167株常见细菌(同一患者同一部位相同细菌做一次计数),菌株标本类型分布:尿液68株,痰49株,血液30株,引流液13株和导管7株。质控菌株为金黄色葡萄球菌ATCC 29213,铜绿假单胞菌ATCC 27853,大肠埃希菌ATCC 25922,均购于国家卫健委临床检验中心。
1.2 试剂与仪器 Ezup柱式细菌基因组DNA抽提试剂盒(上海生工生物工程有限公司),Light Cycler 480 High Resolution Melting Master PCR扩增试剂盒(瑞士罗氏公司),3对扩增引物(上海生工生物工程有限公司),Roche LightCycler480 PCR定量分析仪(瑞士罗氏诊断公司);Bruker MicroflexTMMALDI-TOP MS质谱鉴定仪(德国布鲁克公司)。
1.3 方法
1.3.1 DNA提取:使用MALDI-TOF MS对临床分离菌株进行鉴定,分纯菌落并传代培养以获取遗传性状稳定的纯菌落。挑取血琼脂培养基上5~8个菌落加入盛有1.5 ml去离子水的EP管中,配置菌悬液。采用Ezup柱式细菌基因组DNA抽提试剂盒提取细菌DNA,并将DNA液浓度标准化至20~40 ng/μl备用。
1.3.2 PCR扩增及HRM分析:所用引物参照文献[6]设计,并进行BLAST(http://www.nc-bi.nlm.nih.gov/tools/primer-blast/)序列比对以验证引物特异性[7],引物由上海生工生物工程有限公司合成。引物序列见表1。
采用含有饱和荧光染料的Roche LightCycler 480 High Resolution Melting Master PCR扩增试剂盒(罗氏诊断公司)配制20 μl的PCR-HRM反应体系:Master mix 10 μl,MgCl22.4 μl,三对F/R引物各0.5 μl,模板DNA 1 μl,H2O 3.6 μl。利用Roche Light Cycler480实时荧光定量PCR仪(瑞士Roche公司)进行PCR-HRM实验,反应程序为:①预变性95℃ 1 min;②PCR反应:变性95℃ 30 s,退火55℃ 1 min,延伸72℃ 1 min,共40个循环反应;③扩增产物HRM测定:95℃ 1 min,28℃ 1min,60℃~95℃升温变性,温度变化速率为0.03℃/s;④HRM分析:采用HRM基因扫描分析软件分析所有样本熔解曲线。

表1 实验所需引物序列
1.3.3 167株临床常见菌PCR-HRM分析方法的应用:通过预实验获得最佳反应条件以进行167株临床常见细菌PCR-HRM实验。将分离的167株细菌分为葡萄球菌、链球菌、非发酵阴性杆菌以及其它临床常见分离菌四组进行实验,探讨该实验方法对临床常见细菌的鉴别能力。
1.3.4 灵敏度检测:选取2株肺炎克雷伯菌DNA模板,将浓度调至20 ng/μl,采用10×倍比稀释法得到20 ng/μl~2 fg/μl的8个DNA模板浓度进行HRM实时荧光定量PCR检测。
1.3.5 PCR-HRM重复性实验:随机选取6株革兰阴性菌,一式三份,在相同条件下与阴性对照同时进行PCR-HRM检测,以此结果分析该方法的可重复性。
1.3.6 常见临床感染细菌盲法验证试验:将2种临床常见标准菌株、24株临床随机分离的细菌基因组DNA浓度调至20~40 ng/μl,取DNA模板1 μl进行PCR-HRM以进行盲法验证试验。
1.3.7 测序:以MALDI-TOF MS和PCR-HRM对临床分离菌株鉴定结果进行对比,对结果不一致的细菌测序,并将测序峰图与GenBank BLAST数据库进行比对,以确定临床分离菌株的菌种。
1.4 统计学分析 采用SPSS 22软件对MALDI-TOF MS和PCR-HRM两种方法进行统计分析,分型方法采用配对四格表的χ2检验,P<0.05为差异有统计学意义。
2结果
2.1 使用MALDI-TOF MS对167株临床分离菌株进行鉴定 其中有118株评分>2分,42株质谱评分在1.8~2.0之间,7株细菌评分<1.8。对PCR-HRM和MALDI-TOF MS鉴定结果进行对比,将结果不一致的PCR产物送去上海生工生物工程有限公司测序。以测序结果为金标准,MALDI-TOF MS与PCR-HRM鉴定结果,见表2。
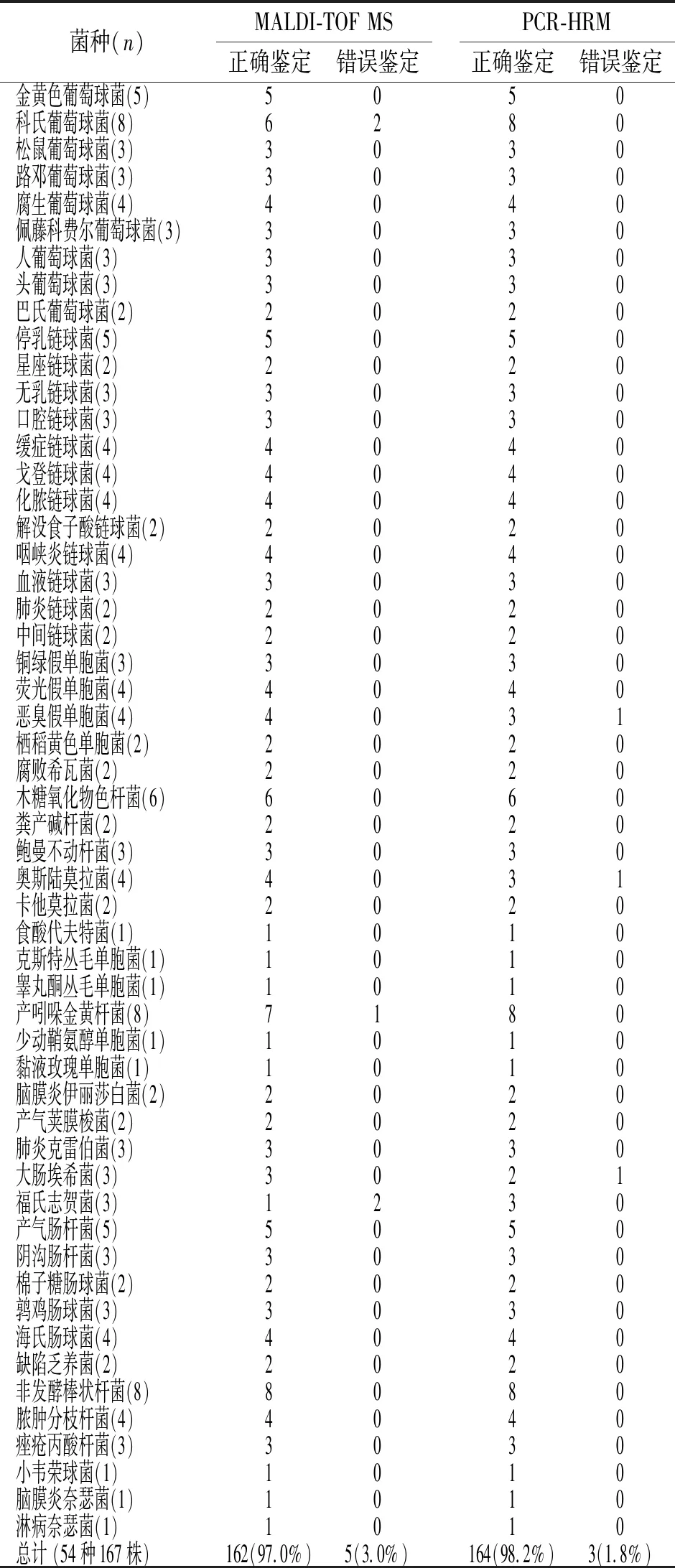
表2 MALDI-TOF MS和PCR-HRM对临床 分离的167株实验菌进行鉴定结果对比
注:1.PCR-HRM鉴定正确:多菌株同类聚为区别于其它菌种的一类;单独一株有区别于其它菌株,尤其是革兰染色相同或种属相近菌株的单独特征曲线。PCR-HRM鉴定错误:未和已知(测序确定,或标准菌株,或同种菌株中的多数)聚为同类。2.采用SPSS 22软件计算后显示PCR-HRM与MALDI-TOF MS鉴定结果差异无统计学意义(χ2=1.97,P=0.727>0.05)。
实验结果显示该实验方法可区分金黄色葡萄球菌及凝固酶阴性葡萄球菌,甚至可将凝固酶阴性葡萄球菌区分到种级,见图1。对于链球菌、非发酵阴性杆菌以及其它常见临床分离菌,PCR-HRM方法可将细菌区分至属级,并且大部分临床感染菌可区分至种级。
2.2 灵敏度检测 采用10×倍比稀释法得到20 ng/μl~2 fg/μl的8个DNA模板浓度,进行PCR-HRM分析测定其灵敏度。图3所示,DNA模板浓度在20 ng/μl~2 pg/μl范围可获得特征性熔解曲线,200 fg/μl~2 fg/μl浓度与阴性对照结果聚类,结果显示该实验方法可检测到2 pg/μl浓度的DNA模板。
2.3 重复性实验 随机选取6株革兰阴性菌,一式三份,在相同条件下与阴性对照同时进行PCR-HRM检测。6株实验菌3份的重复性结果完全一致,见图4,证明该实验重复性良好。
2.4 常见临床感染细菌盲法验证试验 见图5。常见临床感染细菌PCR-HRM盲法验证试验结果显示,24株临床分离感染细菌与2株标准菌株均产生特征性熔解曲线。根据标准菌株产生的扩增曲线,可成功鉴别出5株金黄色葡萄球菌和3株大肠埃希菌。其它16株细菌均经MALDI-TOF MS鉴定,分别为5株鲍曼不动杆菌、3株人葡萄球菌、3株屎肠球菌、3株黏质沙雷菌、2株洋葱伯克霍尔德菌,评分均>1.8,PCR-HRM盲法验证试验结果与MALDI-TOF MS鉴定结果一致。
3讨论人体常见致病菌种类繁多,如葡萄球菌、链球菌、大肠埃希菌与变形杆菌等,许多临床常见病原菌以其能够产生广泛的耐药性而闻名,其中最常见的是“ESKAPE”病原菌(肠球菌、金黄色葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌和肠杆菌属)[8]。虽然常见致病菌感染后的临床表现相似,但最佳的治疗方案取决于致病菌的种类。通常,用于经验性治疗可疑细菌感染的第三代头孢菌素和呋喃喹诺酮类药物对铜绿假单胞菌感染没有作用;鲍曼不动杆菌对头孢菌素和氨基糖苷类抗生素耐药;大肠埃希菌和克雷伯氏菌等肠杆菌有着广泛的耐药基因,需要进一步检测以确定其药敏。因此,病原菌种类的鉴定可引起治疗方案的改变,对科学指导患者进行个体化抗生素治疗有着重要意义[9-10]。
在我国临床诊断实验室中,菌种鉴定通常基于传统培养技术,这种方法可能需要8~120 h。然后经革兰染色显微镜观察,将分离出的病原菌分为革兰阴性或革兰阳性两种,并利用选择性培养基和生化试验进一步鉴定。二次培养步骤通常需要8~48 h,利用生化鉴定板(如API20E肠道菌试剂鉴定条)鉴定需要24 h的孵育[11]。
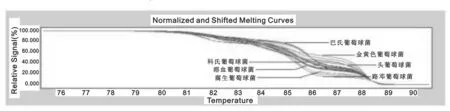
图1 临床常见葡萄球菌熔解曲线图
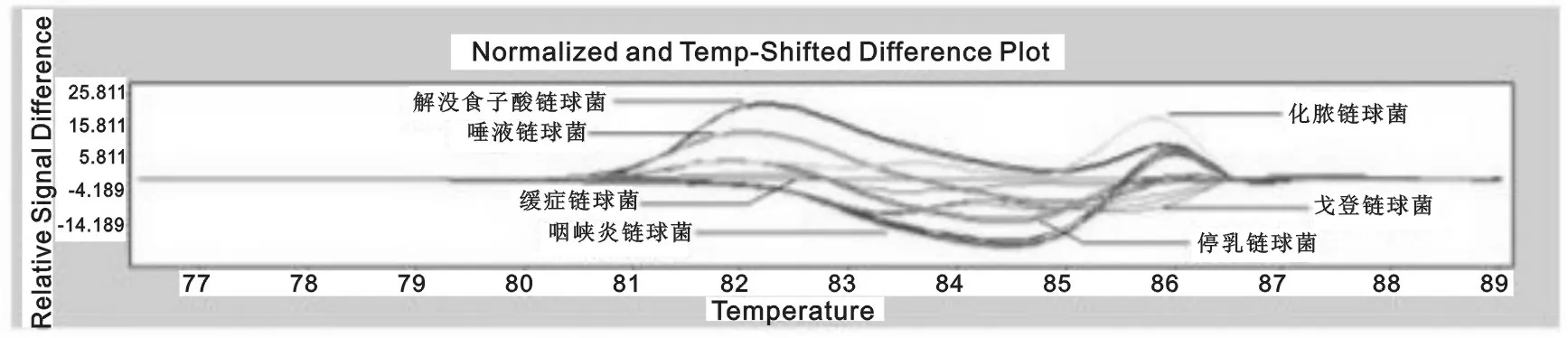
图2 临床常见链球菌熔解曲线图
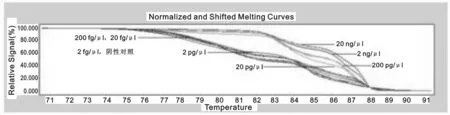
图3 PCR-HRM灵敏度检测结果
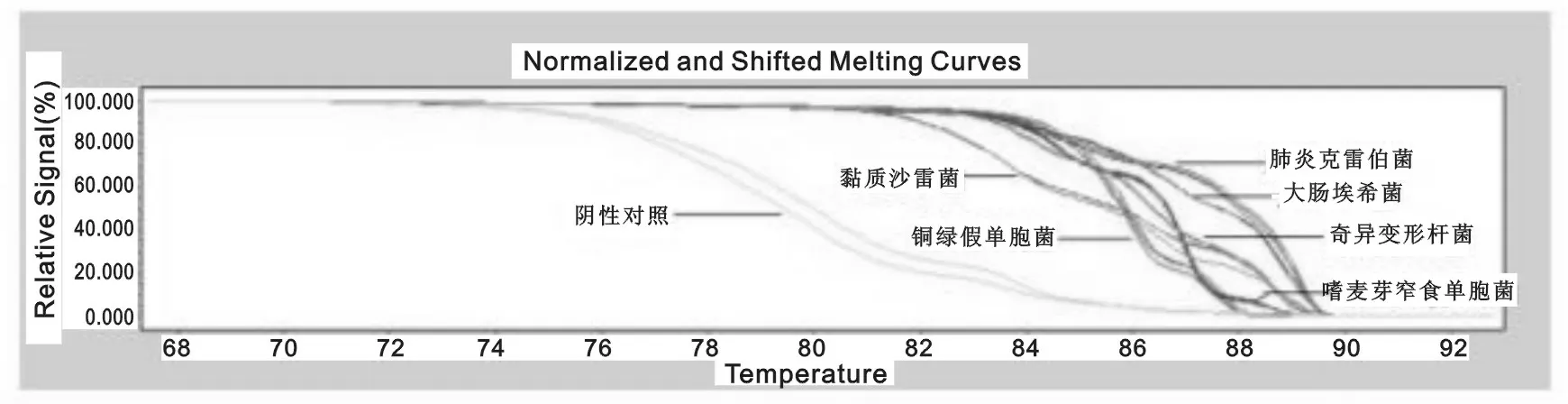
图4 PCR-HRM重复性试验熔解曲线结果
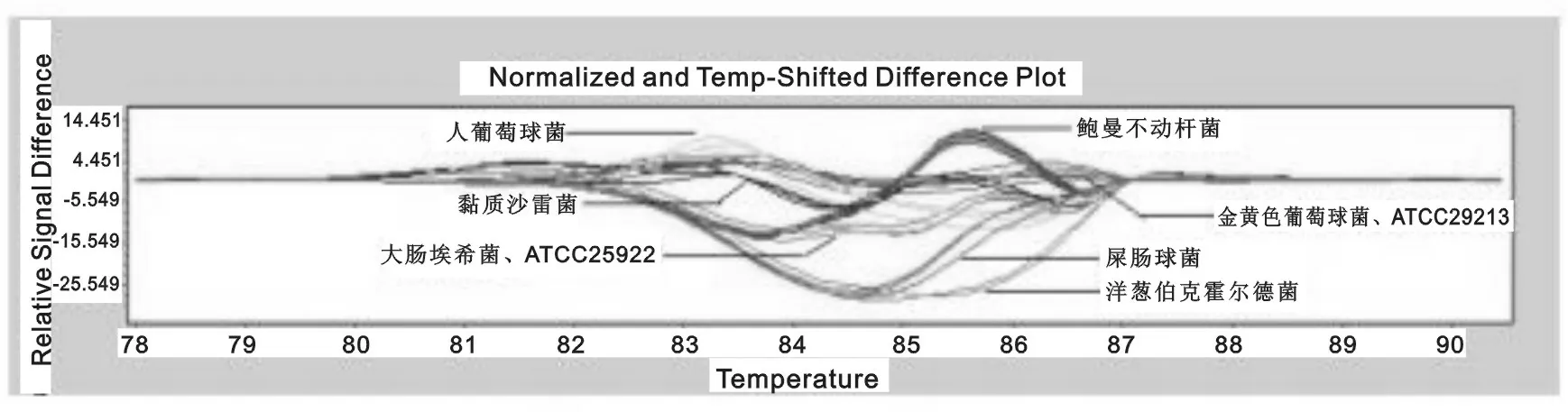
图5 临床分离24株感染细菌与2株标准菌株的盲法验证曲线图
近年来,分子检测技术已用于细菌种类的鉴定,这种方法提供的结果比传统鉴定更快速。已有研究表明快速分子检测的运用缩短了最佳治疗时间和病原菌感染者的出院时间。16S rRNA序列测定可用于细菌鉴定,但成本高、耗时长、临床应用有限[12]。其它可提供高度复用性的细菌检测方法,如FilmArray血培养鉴定组合(Biofre Diagnotics,美国)和Verigene革兰阴性血培养分析(Nansphere,美国)可以在样本初始培养阳性后2 h内提供结果,但这些检测方法不仅费用昂贵,还需要专门的仪器检测。
本研究的目的是建立一种基于HRM分析鉴别临床常见感染细菌的检测方法,通过使用3对细菌高覆盖度的16S rRNA引物构造多重差异曲线对细菌进行分类,为培养初期病原菌的快速鉴定提供依据[13]。在PCR反应后,反应以0.1℃递增加热,荧光信号则由实时PCR系统监测。扩增产物在熔解温度下进行解离释放饱和染料,导致荧光信号改变,通过捕获荧光信号产生特征性荧光曲线,对临床常见病原菌进行鉴别。PCR-HRM分析可提供一种快速、简单、低成本、封闭的扩增分析方法,具有单核苷酸识别能力[14],并且有较高的灵敏度、特异度与可重复性[15]。这种方法大大降低了临床常见病原菌对DNA测序的需求与鉴定成本。
该分子诊断方法存在的一个局限性是无法通过标准曲线对细菌进行量化。由于饱和染料的非特异性,任何扩增产物都能产生荧光,多个目标可能同时被放大,使定量不可靠。这种方法的另一个缺点是,扩增区域内具有相同序列的、亲缘关系密切的菌种不容易被区分,所以应用这项技术进行亲缘关系较近的细菌鉴定时应设计特异度较强的引物。预测这项鉴定方法将成为鉴别临床常见感染菌有用的诊断工具,它不仅可快速检测实验结果,其成本与传统检测方法相比也更低。但这种鉴定方法的推广需要进行更多样本的验证,以便更准确地确定其性能。此外,该方法可指导临床个体化用药治疗,我们可以进行一项实验研究,以衡量快速检测病原菌在抗生素个体化治疗方面的临床意义。
综上所述,该方法通过使用3对16S rRNA引物构造多重HRM曲线可对临床常见细菌进行分类到属级甚至种级,且灵敏度高、特异度强,可以作为鉴定临床常见感染菌的新选择。

