用于水生病原菌的3种高通量活菌计数方法的比较*
邹培卓 杨 倩 董 宣 谢国驷 黄 倢①
(1.上海海洋大学水产与生命学院 上海 201306;2.中国水产科学研究院黄海水产研究所 青岛海洋科学与 技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 农业农村部海水养殖病害防治 重点实验室 青岛市海水养殖流行病学与生物安保重点实验室 青岛 266071)
细菌计数方法是微生物学研究的基础技术,主要分为直接计数法和间接培养计数法。直接计数法主要有显微镜观察法(包括光学显微镜技术、荧光显微镜技术等)和比浊计数法等;间接培养计数法主要有平板菌落计数法(包括传统平板计数法、微菌落技术等)和最大或然数计数法(Most probable number,MPN法,也称为稀释培养法)等(王婷婷等,2008)。传统的直接计数法不能区分细菌的死活,且灵敏度低、线性范围狭窄,间接培养计数法虽然能确定活菌数量,但工作量大,难以对大批量样品进行同时操作。例如,食品安全国家标准中的菌群计数法采用MPN法和平板计数法(GB 4789.3-2010),这2种方法都需要培养24~48 h,且工作量大、检测线性范围窄,难以进行快速、大批量的检测工作,MPN法的精确性还存在疑问;为了简化检测程序、缩短检测时间,国内外学者进行了大量的快速检测方法的研究,提出了电阻抗检测法、Sim PlateTM全平皿计数法、微菌落技术、最大或然数-聚合酶链式反应计数法(MPN-PCR法)、流式细胞仪测定法等检测方法,取得了一定的成果,但也存在不同的缺陷和不足。例如,流式细胞仪测定法虽然灵敏度、简便性都有了较大的提升,但由于其成本昂贵,且不能区分细菌的死活,在实际应用中受到了很大的制约。
MTT是 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,能穿过细胞膜被活细胞线粒体中的琥铂酸脱氢酶还原,形成蓝紫色不溶于水的甲瓒(Formazan) (Mosmann,1983),死细胞酶活性丧失而没有颜色反应。用有机溶剂溶解甲瓒后(边兴艳,1998),测定溶液的吸光度(OD 值)而确定活细胞数(Gerlieret al,1986)。该法快速、经济、操作相对简便、重复性较好,近年来被广泛应用到大肠杆菌(Escherichia coli) (王栩等,2002)、保加利亚乳杆菌(Lactobacillus bulgaricus)、嗜热链球菌(Streptococcus thermophilus) (黄立坤等,2008)、伴放线菌嗜血菌(Haemophilus actinomycetemcomitans) (王忠朝等,2010)和酵母菌 (龚加路等,2016)等的活菌计数中。
三磷酸腺苷(ATP)是所有生命活动的能量载体(Veltenet al,2007),活细菌中 ATP 含量会维持在一定范围,细菌死亡后 ATP会在短时间内被细胞内酶所分解(Holm-Hansenet al,1966),样品中 ATP 含量即可间接反映活细菌数量。ATP生物发光法(Milleret al,1992; Selanet al,1992; Nyrén,1994; McElroyet al,1949)是荧光素酶在Mg2+条件下催化荧光素与ATP反应形成荧光素-AMP的复合物,与O2结合时发光,发光强度与ATP浓度呈线性关系,从而检测活菌的数量(Moyeret al,1983; Grönrooset al,1983)。ATP 生物发光法操作简便,能快速得到结果,与传统的平板计数法相比,不仅能区分细菌的死活,而且还能检测出不可培养的微生物(Hammeset al,2010)。
借鉴实时定量 PCR的扩增曲线原理,利用微生物类似于PCR扩增的指数生长曲线(Brewster,2003),建立了高通量生长曲线法,该法与传统的MPN法完全不同,是根据细菌生长达到特定浊度的时间进行活菌的计数,在微孔板的微量培养体积上,设置多个平行,以高通量的方式对微生物的生长进行实时监测,达到类似实时定量 PCR那样在极宽的线性范围进行微生物的准确计数的效果。在上述背景下,本研究对MTT比色法、ATP生物发光法和高通量生长曲线法进行了比较。
1 材料与方法
1.1 细菌
实验用副溶血弧菌(Vibrio parahaemolyticus)的编号为 20130629002S01(以下简称 2S01),取自中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理学研究室(王娜等,2016; Donget al,2017)。将冻存的2S01菌株在胰蛋白胨大豆琼脂培养基(TSA)平板上划线,28℃培养12 h,挑取单个菌落接种于胰蛋白胨大豆肉汤培养基(TSB)中,于28℃以110 r/min过夜振荡培养,3000 r/min离心10 min,并用磷酸缓冲溶液(PBS)清洗沉淀、重悬,调整其OD600 nm=0.5,经平板计数方法检测其浓度约为1.12×108CFU/ml。取 2 ml接种于 200 ml TSB 培养基中,在 28℃以110 r/min恒温震荡培养4~6 h,待细菌刚达到指数生长期时,用冷冻离心机4℃离心3次,并用PBS溶液清洗沉淀、重悬,调整其OD600 nm=0.5,备用。
1.2 MTT比色法
1.2.1 检测波长确定 将 100 μl重悬菌液加入 96孔细胞培养板(Corning,美国),然后每孔加入 20 μl 5 mg/ml的 MTT 溶液(溶于 PBS 溶液并经 0.22 µm 滤膜过滤除菌)(Solarbio),用微孔板振荡仪混匀,放入37℃恒温培养箱孵育2 h,取出后于4000 r/min离心10 min,吸出上清液,每孔加入 150 μl DMSO (Solarbio,中国),振荡混匀10 min,设定 Varioskan Flash全波长扫描式多功能读数仪(Thermo,美国)波长在400~700 nm范围内进行波长扫描,只加DMSO作为空白对照组,每组3个平行。
1.2.2 MTT溶液的使用剂量 在相同量的菌液中分别加入终浓度为 0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50 mg/ml的 MTT 溶液,充分反应后离心,弃上清液,每组3个平行,按MTT比色法的步骤测量各组OD值。
1.2.3 干扰物质的影响 以DMSO为参比,以PBS溶液和121℃灭菌20 min的死亡菌体为样品,用MTT法测量,每组3个平行。
1.2.4 MTT溶液与菌液反应时间 分别将MTT法的 37℃孵育反应经 0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h后,离心弃上清液,终止反应,每组3个平行,按上述方法测量各组OD值。
1.2.5 检测范围与标准曲线 将浓度为1×109CFU/ml的菌悬液按 2倍浓度梯度依次稀释为9.77×105~1×109CFU/ml,每组 3 个平行,用 MTT 法测量各组OD值,用SigmaPlot 12.0软件进行数据分析,用Polynomial进行线性分析,建立菌液浓度与其反应后OD值的标准曲线。
1.3 ATP生物发光法
1.3.1 试剂盒可靠性检测 按增强型 ATP检测试剂盒(Beyotime)说明书操作步骤用试剂盒提供的ATP标准品进行试剂盒验证,并建立标准曲线。
1.3.2 检测范围与标准曲线 将调整 OD 后的菌液稀释成浓度为 3×103、1×104、3×104、1×105、3×105、1×106、3×106、1×107、3×107、1×108、3×108、1×109CFU/ml的菌悬液,然后按照试剂盒说明书测量各组相对发光度值(RLU),每组3个平行,建立菌液浓度与其反应后RLU的标准曲线。
1.4 高通量生长曲线法
1.4.1 不同浓度菌液连续培养进行OD值测定 将调整 OD 后的菌液稀释成 1×102、1×103、1×104、1×105、1×106、1×107、1×108、1×109CFU/ml 的菌悬液,每个梯度取2 µl,用8通道移液器加至预先加有 198 μl TSB培养基的96孔板中,每个浓度3个重复,设置PBS空白对照,用涡旋振荡仪混匀,放入 28℃恒温培养箱,300 r/min振荡培养。在培养的0、1、2、3、4、5、6、7、8、9、10、11 h 测定 OD600 nm。
1.4.2 建立标准曲线 将细菌培养时间和 OD600 nm的读数扣除未接种细菌的培养基孔的OD600 nm值,用SigmaPlot 12.0软件进行数据分析,按Sigmoid曲线类型用3参数模式拟合,根据拟合出的方程,统计其各组菌液生长曲线达到a/2值的时间x0,建立菌液浓度与该时间的标准曲线。
1.5 副溶血弧菌菌液的测量
取 10份不同浓度的副溶血弧菌菌液,分别用 3种计数方法与平板计数法进行对比,分析3种计数方法的计数结果(C)与平板计数法的计数结果(CP)的线性关系和变异系数(C.V.)。
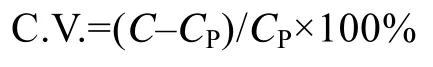
2 实验结果
2.1 MTT比色法
2.1.1 检测波长 MTT经细菌产物呈蓝紫颜色,将培养的副溶血弧菌悬液进行波长扫描(图1),结果显示,蓝紫色产物的最大吸收峰值在550~560 nm之间。DMSO的吸光度对实验组吸光度影响很小,且没有峰值出现,属于背景吸收,因此,将MTT法的检测波长定为555 nm。
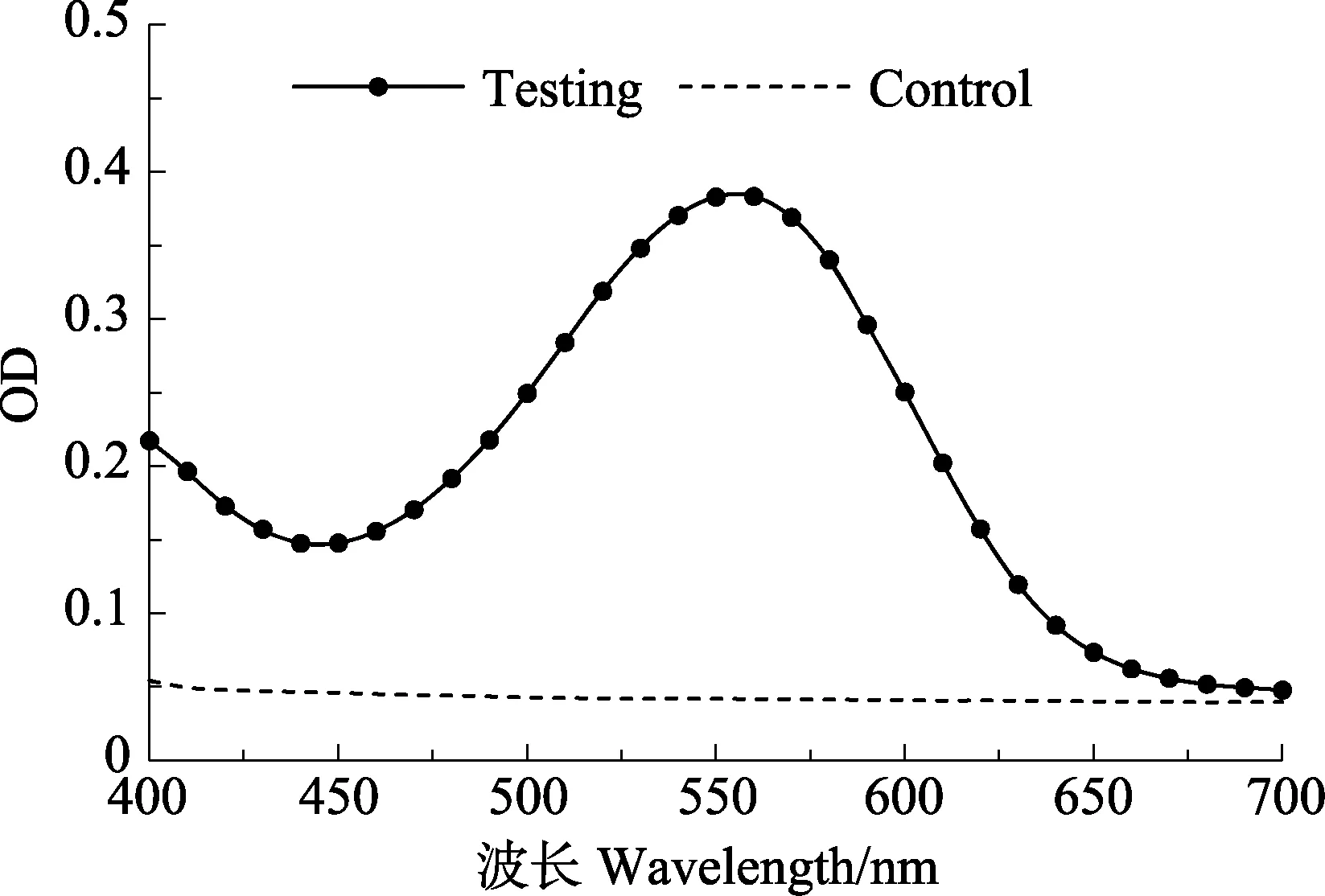
图1 MTT产物甲瓒的光吸收检测波长扫描Fig.1 The scanning of photoabsorption detection wavelength of formazan produced by MTT
2.1.2 MTT溶液的使用剂量 设定不同的MTT用量进行分析,结果显示(图2),当细菌反应液中MTT浓度为0.2 mg/ml,产生甲瓒沉淀的量最多,甲瓒的吸收曲线呈现峰值,因此,将 MTT终浓度定为0.2 mg/ml。MTT 量超过 0.2 mg/ml时,产生的甲瓒量会逐渐减少。

图2 MTT浓度对检测结果的影响Fig.2 Effects of the MTT concentration on the measuring results
2.1.3 干扰物的影响 以 DMSO为参照,用 PBS或灭活菌体作为样品进行MTT反应检测,所得的检测值很低(表1),经t检验,得出 3组数据两两间均无显著差异(P>0.05),因此,可以忽略这些干扰物对实验结果的影响。
2.1.4 反应时间的影响 细菌与MTT的反应时间在0.5~2 h时,形成甲瓒的量在逐渐增多,2 h后维持在相对稳定的数量(图3),因此,将反应时间定为2 h。

表1 不同干扰物以DMSO为对照时的OD值Tab.1 OD value of the different interfering substances compared with DMSO
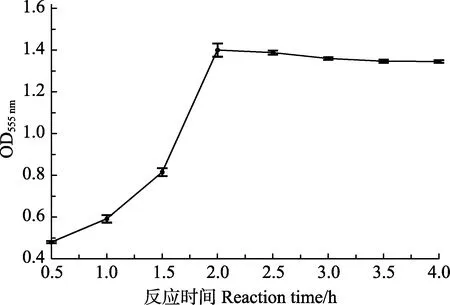
图3 反应时间对检测结果的影响Fig.3 Effects of reaction time on the measuring results
2.1.5 检测范围 通过选择上述参数,用优化的MTT法在微孔板中进行副溶血弧菌的高通量活菌计数,用SigmaPlot的Polynomial线性分析,当菌液浓度为7.81×106~2.50×108CFU/ml时,其对应的OD555 nm值与活菌数的线性关系极显著,线性范围跨度约为 2个细菌浓度数量级,其关系式为 LgC=(1.0439± 0.0200)LgOD555 nm+(8.0565±0.0125),R²=0.9965 (图4)。

图4 菌液浓度对数LgC与OD值对数 LgOD555 nm 的标准曲线Fig.4 Standard curve between the logarithmic concentration of bacteria (LgC) and logarithmic OD555 nm value (LgOD555 nm)
2.2 ATP生物发光法
2.2.1 ATP标准溶液的标准曲线 用增强型 ATP检测试剂盒对 ATP标准溶液进行检测,ATP标准溶液浓度在 1.0×10-1~1.0×104nmol/L 时,ATP 浓度的对数(LgATP)与发光强度对数(LgRLU)的线性关系极显著,其关系式为 LgATP=1.0509LgRLU-4.3223,R²=0.9974(图5),表明该试剂盒在该范围内的测定结果可靠。

图5 ATP浓度对数(LgATP)与相对发光强度(RLU) 对数(LgRLU)的标准曲线Fig.5 Standard curve between the logarithmic concentration of ATP (LgATP) and logarithmic relative intensity of luminescence(LgRLU)
2.2.2 菌液浓度对数 LgC与相对发光强度对数LgRLU的标准曲线 用增强型 ATP试剂盒对已知浓度的副溶血弧菌样品进行检测,用 SigmaPlot的Polynomial 线性分析,当菌液浓度在 1.0×104~3.0× 108CFU/ml时,其对应的相对发光强度对数(LgRLU)与活菌数对数(LgC)的线性关系极显著,线性范围跨度约为 4.5个细菌浓度数量级,其关系式为 LgC= (0.9590±0.0065)LgRLU+(0.9949±0.0366),R²=0.9994 (图6)。
2.3 高通量生长曲线法
将浓度为 1.0×100~1.0×107CFU/ml的副溶血弧菌加到预先加有培养基的多孔板中,每隔 1 h,测定OD600 nm值,扣除未接种细菌孔的OD600 nm后,得出各初始浓度的细菌吸光度所代表的生长变化,可看到这些生长变化都呈S形(Sigmoid)曲线分布,不同浓度的S曲线在拐点处的生长速率基本接近,经SigmaPlot的Sigmoid曲线类型3参数模式拟合,得到各初始浓度的细菌生长曲线(图7)。用SigmaPlot的Polynomial线性分析,取各浓度拟合曲线的拐点时间参数(Ts),即为生长达到最大值的50%的生长时间,该时间在所测定的初始细菌浓度范围内均与活菌数的对数值(LgC)具有极显著的线性关系,线性关系跨度达 7个数量级,其关系式为 LgC= -(0.8727±0.0230)Ts+ (9.0128±0.1572),R²=0.9924(图8)。
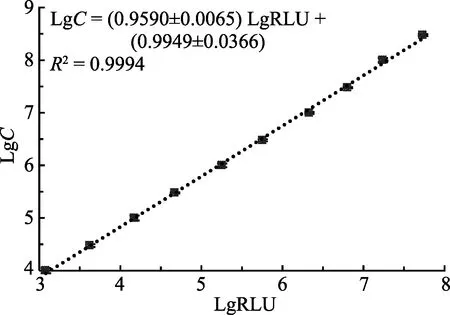
图6 菌液浓度对数LgC与相对发光强度 对数LgRLU的标准曲线Fig.6 Standard curve between the logarithmic concentration of bacteria (LgC) and logarithmic intensity of luminescence(LgRLU)
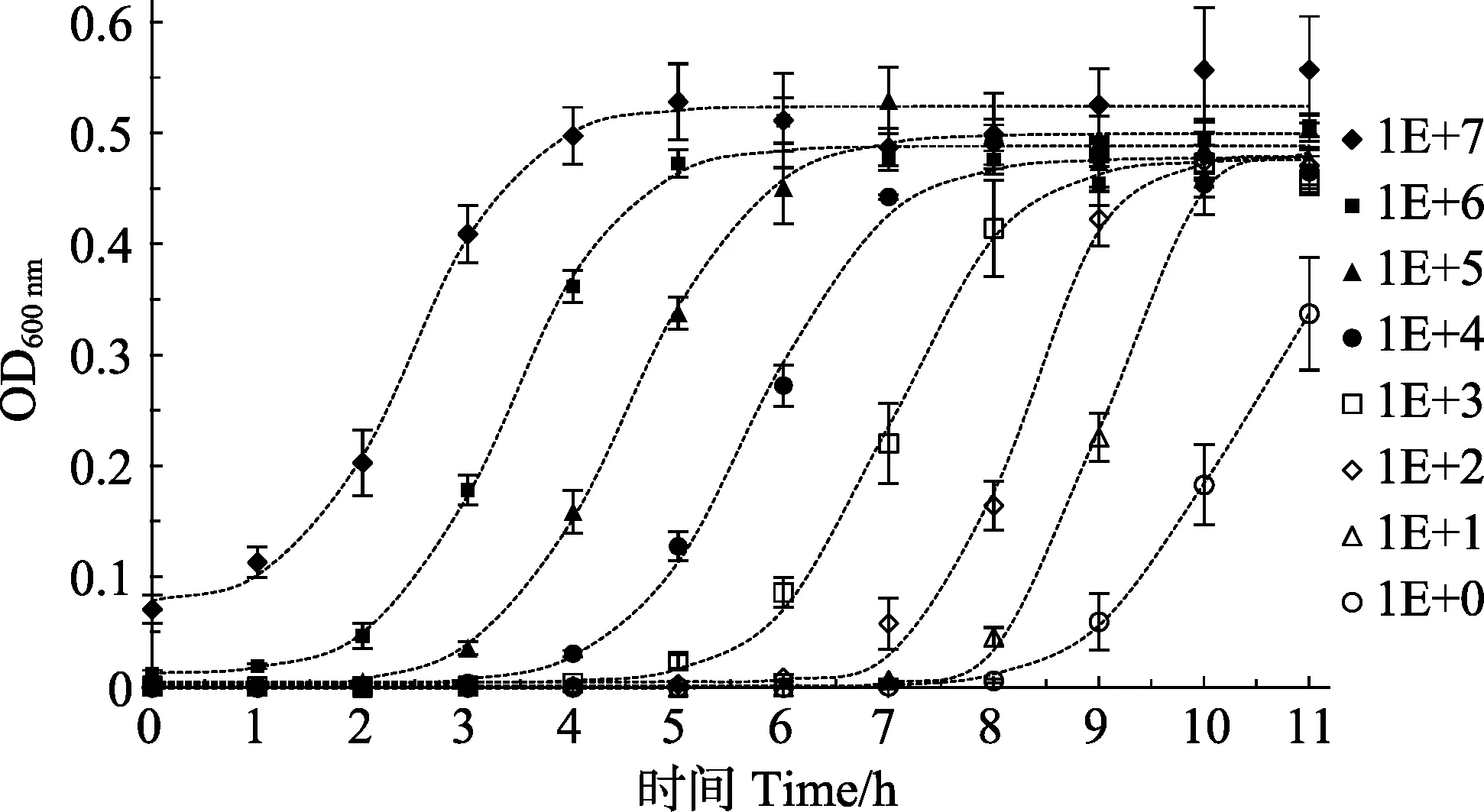
图7 各初始浓度菌液的生长曲线Fig.7 Growth curve of each initial concentration of bacteria
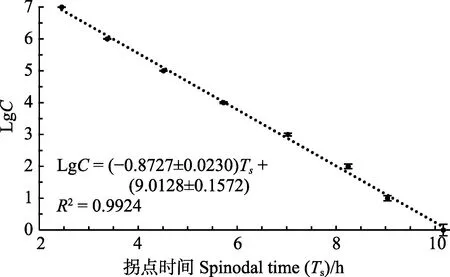
图8 菌液浓度LgC与生长曲线的 拐点时间(Ts)的标准曲线Fig.8 Standard curve between the concentration of bacteria (LgC) and the spinodal time (Ts) of growth curves
2.4 副溶血弧菌菌液检测
分别采用MTT比色法、ATP发光法和高通量生长曲线法对10份不同浓度的副溶血弧菌菌液进行检测,并与平板计数法进行比较(图9)。结果显示,MTT法计数的 9个在线性范围内的样品计数值的对数(LgCMTT)与平板计数法结果的对数(LgCP)之间具有极显著的线性关系(R²=0.9620,P=3.42×10-7),其关系式为 LgCMTT/LgCP=1.0123(图9)。9个样品的变异系数为(18.50±12.03)%,超出检测线性范围的1个样品的浓度为 4.82×106CFU/ml,其变异系数为 36.61%。ATP发光法计数的 9个在线性范围内的样品计数值的对数(LgCATP)与平板计数法的结果的对数(LgCP)之间具有极显著的线性关系(R²=0.9981,P=1.72×10-11),其关系式为LgCATP/LgCP=0.9981(图9)。9个样品的变异系数为(8.59±5.90)%,超出检测线性范围的1个样品的浓度为6.43×103CFU/ml,其变异系数为23.65%。高通量生长曲线法计数的 9个在线性范围内的样品计数值的对数(LgCG)与平板计数法结果的对数(LgCP)之间具有极显著的线性关系(R²=0.9985,P=3.89× 10-11),其关系式为LgCG/LgCP=0.9985(图9)。9个样品的变异系数为(9.78±7.46)%,超出线性范围的1个样品的浓度为77.00 CFU/ml,其变异系数为68.43%。
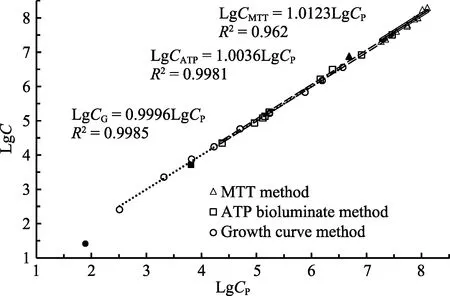
图9 3种高通量活菌计数法与平板计数法的结果比较Fig.9 Comparison of logarithmic counting value three high throughput counting methods for living bacteria(LgC) and logarithmic value of plate counting (LgCP)
上述3种方法与平板计数法的比较显示,ATP发光法和高通量生长曲线法的曲线斜率很接近1,说明这 2种方法与平板计数法得出的结果高度接近,而MTT法的斜率与1有所偏离,而且在偏低或偏高浓度上有明显系统误差,说明这一方法所得结果存在一定误差。
3 讨论
平板计数作为活菌计数的最基本方法,通常能应用于大多数需要进行活菌计数的场合,但在一些研究不同培养条件,例如液体发酵(高戈等,2017)或固体发酵(孙静等,2017)等;理化因素,例如消毒剂或紫外线等处理;药物制剂,例如中草药或抑菌剂等;这些对特定细菌生长或存活的影响效果时,需要大量的活菌计数工作,而平板计数方法由于工作量大,材料消耗大,在用到这些大量研究对象时效率很低,且不确定度高(凌云等,2010),因此,需要高效可靠的活菌计数方法。工作效率较高的细菌计数法可采用酶标板的高通量OD值测定,但该方法并不能区分样本中的活菌和死菌,而且如果样本中存在大量带颜色的或悬浮物等干扰光吸收的物质时(孙静等,2017),就难以进行直接的OD值测定。因此,需要其他的活菌计数方法以弥补在特定应用中的不足。
MTT比色法操作相对简单,能满足高通量操作的需求,适用于较高浓度的活菌数检测,但其检测的线性范围只有2个数量级的跨度。当活菌数较低时,MTT的反应产物过低,从而在OD555 nm值太低而超出检测的线性范围,不适用于检测浓度太低或太高的细菌,由于高通量分析实验的场合常常会有细菌数量大大偏离MTT检测范围的情况发生,这种方法实际上在高通量活菌计数的应用中受到了较大局限,与之前报道的MTT比色法在大肠杆菌活菌计数研究的结论相符合(汪志荣等,2011)。对 7.8×106~2.5×108CFU/ml线性范围内的实际样品进行检测时,所得结果与平板计数结果有一定偏离,5×106CFU/ml以下的检测结果可能会有明显偏差。此外,不同种类和不同生理状态的细菌中琥珀酸脱氢酶含量可能不同,对多种细菌混合检测的适用性可能受影响。
ATP生物发光法操作更加简便,是3种方法中检测速度最快的,准确性比MTT法高,反应速度较快,能对样品进行实时的检测反馈,线性范围能达到4个数量级的跨度。对 1×104~3×108CFU/ml跨度的线性范围内的实际样品进行检测时,所得结果与平板计数结果高度吻合,对104CFU/ml以下的检测结果偏差明显增加(Chenet al,2006)。在检测较低浓度的活菌时,需要较长的检测时间来收集微弱的发光,对于大量样品的高通量检测来说,顺序检测过程会造成前后样品的时间差太大,ATP的发光会逐渐消散而对准确性造成显著影响(Selanet al,1992)。因此,该方法也不适于大样本量的高通量检测。此外,如果样品中有其他来源的 ATP干扰,也会对分析的准确性产生很大的影响。
高通量生长曲线法准确性略低于 ATP发光法,在本研究的手动操作条件下,检测的线性范围达7个数量级以上,对特别低或特别高的活菌数都能进行有效检测。对 100~107CFU/ml跨度的线性范围内的实际样品进行检测时,所得结果与平板计数结果高度吻合,102CFU/ml以下的实际样品检测时有误差增大的可能,与 Brewster(2003)的研究结果相符。高通量生长曲线法操作耗费时间较长,而且需要定时对OD值进行测定,如果完全人工手动操作,这个过程将较为辛苦。该方法不需要借助特别试剂,可以不受试剂缺乏的限制而得以应用。如果有自动生长曲线测定仪,那这样的操作将十分方便,而且能进一步增加其检测的线性范围和结果的准确性。
综合比较3种高通量方法:ATP生物发光法与高通量生长曲线法有很好的准确性,MTT比色法准确度稍差;而高通量生长曲线法有最宽的线性范围,也最适合高通量测定。

