全腔镜下经腹膈入路全胃切除治疗Siewert Ⅱ型食管胃交界部腺癌的围手术期疗效分析
张 炎,庞 玮,刘 刚,张朝军
食管胃交界部腺癌(adenocarcinoma of esophagogastric junction,AEGJ)的发生率在过去的几十年迅速增加,尤其是在亚洲和一些西方国家[1-2]。发病率上升的主要原因是肥胖率、吸烟率和胃食管反流病的增加[3-4]。目前,手术仍是AEGJ的首选治疗方案,但既往针对SiewertⅡ型AEGJ的手术多需采用胸腹联合入路,创伤大。近年来日本学者率先报道了全腔镜下左侧经胸腔食管空肠吻合的新术式[5]。解放军总医院第六医学中心普通外科从2017年4月开始尝试该手术入路行全胃切除,并对部分操作进行改进,报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2017年4—2017年12月解放军总医院第六医学中心普通外科开展的10例Siewert Ⅱ型AEGJ患者病例资料,均行全腹腔镜下全胃切除+D2淋巴结清扫,其中,男性7例,女性3例;平均年龄66(56~74)岁;体重指数23.4(18.8~28.5)。术前评估诊断方法主要包括胃镜、超声内镜和腹部CT检查。所有患者术前病理学检查和胃镜检查证实为SiewertⅡ型AEGJ。对胃癌肿瘤分期是根据国际抗癌联盟TNM分期系统第八版分类和淋巴结的分站、分类是根据日本胃癌协会的定义编号。本研究经医院伦理委员会批准。
1.2 手术方法 全麻后,患者取仰卧位,两腿分开,呈“人”字形。手术台尾端向下倾斜10°~20°,呈头高脚低位。
1.2.1 Trocar位置及术者站位 Trocar采用常规五孔法,其中两侧操作孔应根据患者身长和肿瘤侵及食管位置有时须将Trocar整体向头侧移动1~2 cm以便操作。
1.2.2 全胃切除+淋巴结清扫 进腹后常规探查肿瘤位置,确定病变部位、有无淋巴结及腹腔转移等情况。断离胃周血管及清扫胃周淋巴结同腔镜下根治性全胃切除术。此术式不同点在于扩大食管裂孔,以左侧膈肌角为起点向左打开膈肌约4~5 cm(图1),解剖食管裂孔的肌纤维,对远端食管的前部和左侧进行解剖,观察到气管分叉的水平。左侧壁胸膜在心包附近切开,左侧胸腔开放至纵隔间隙,左胸与纵隔相通,形成较大的手术野。解剖的后层为胸主动脉的表面,确认并分离出正常食管动脉的根部,胸导管常规保存。以这种方式解剖并清扫下胸部食管旁(NO.110)、膈上(NO.111)和中纵膈后(NO.112)淋巴结。确认距肿瘤近端(尽可能选择术中胃镜定位)3~5 cm处应用直线切割闭合器离断食管,切缘送冰冻病理学检查,若为阳性可继续切除近端食管送检,如遇左膈下动脉须尽量避开或应用可吸收夹夹闭,切开时勿损伤左下肺叶及心包。

图1 扩大术野—切开左侧膈肌
1.2.3 消化道重建 食道-空肠吻合方式的选择应根据肿瘤位置、下牵食道长度、空肠上提系膜张力等酌情选择。本组8例选择圆型吻合器进行吻合,置入圆形吻合器抵钉座方式为反穿刺法和手工荷包缝合两种方式(图2,图3),吻合器身经上腹部取标本小切口置入。另外2例使用直线吻合器,上提空肠,将空肠置于食管右侧,用自牵拉法将胃底体和食管一起向左上牵引,肿瘤上缘3cm食管右侧开孔,行食管空肠侧侧吻合术(图4),再利用线性吻合器切除共同开口,同时关闭食管及空肠残端。应连续缝合关闭膈肌开口,重建食管裂孔,宽窄适度,以防止食管裂孔疝。术后吻合口两侧留置腹腔引流管,一侧引流管侧孔应高于吻合口,均未放置胸腔闭式引流。
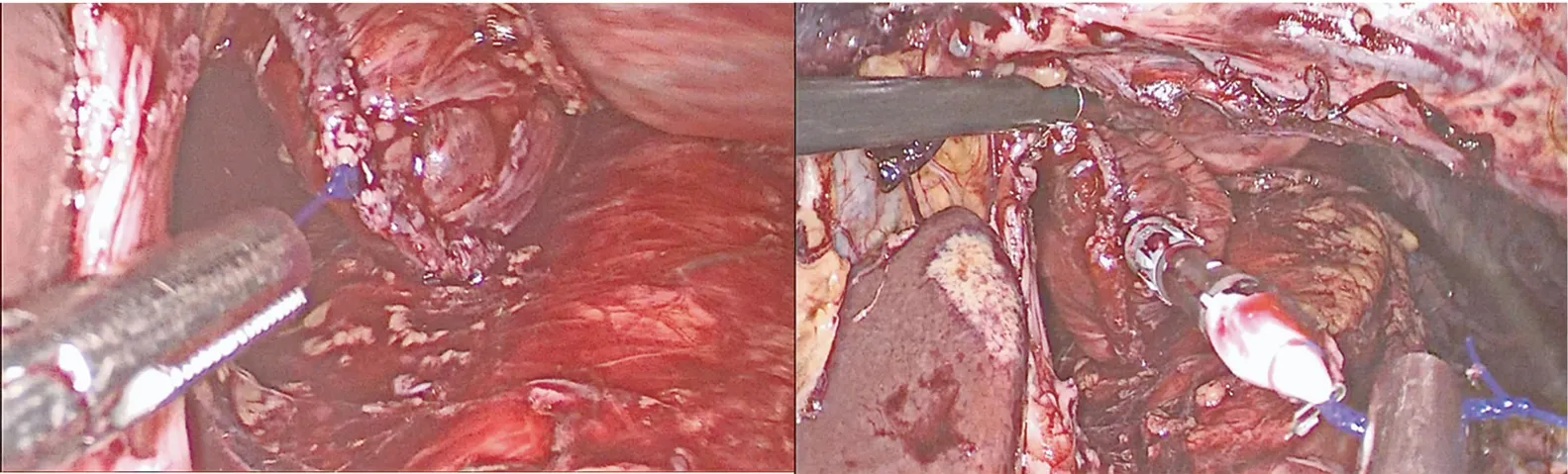
图2 钉座置入—反穿刺法
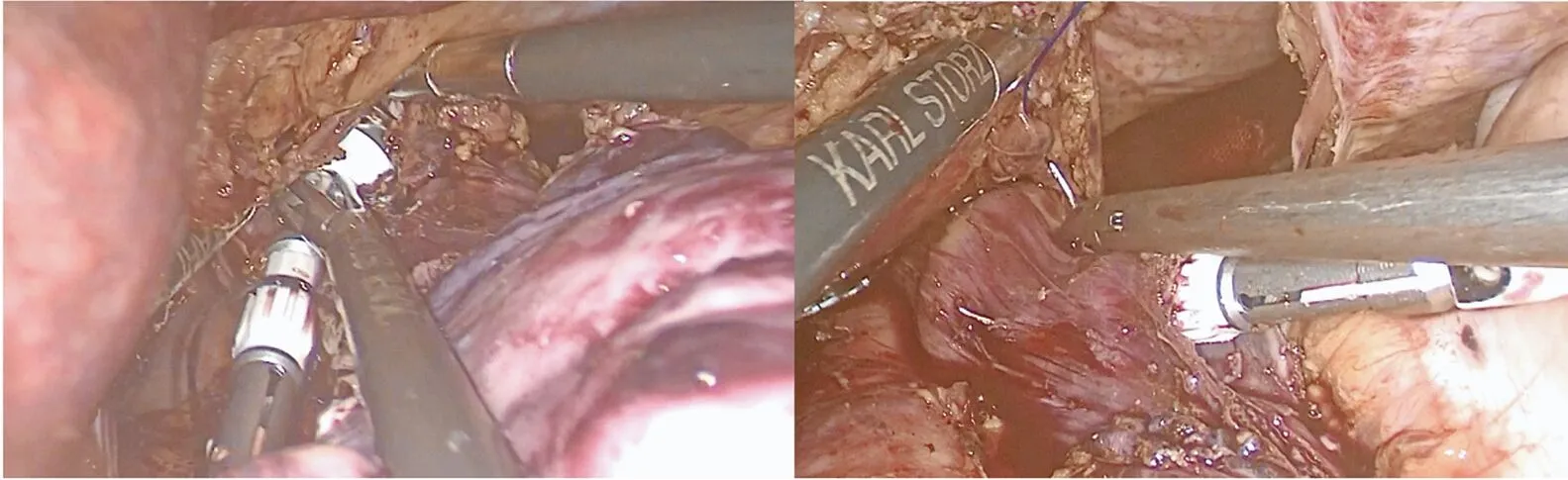
图3 荷包缝合
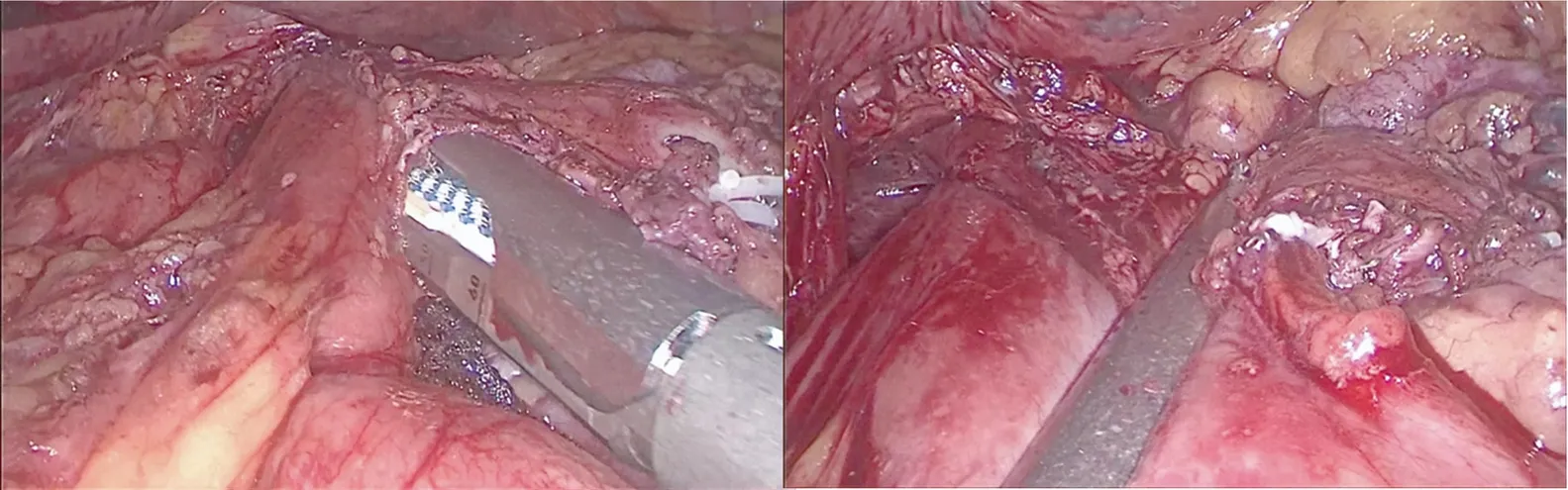
图4 食管空肠侧侧吻合
2 结果
10例患者均顺利完成手术,所有患者在打开膈肌情况下,血氧饱和度未下降,手术由同一组外科医生实施,消化道重建采取食管-空肠吻合,其中8例使用圆型吻合器吻合,2例使用直线吻合器吻合。肿瘤平均直径5.4(3.5~7.1)cm;侵及食管长度为2.0(1.5~4.2)cm。平均手术时间250(230~290)min,消化道重建时间52(40~70)min,术中出血量160(80~350)mL,无中转开腹,术后切缘全部为阴性,见表1。术后病理学检查结果见表2。患者术后第3天进水,术后3~5 d行上消化道造影检查,明确造影剂无外溢后进流食。1例术后第7天出现发热,造影证实吻合口瘘,放置胸腔闭式引流及冲洗管(图5c),经间断冲洗引流,体温恢复正常,2周后复查碘水造影(图5d),吻合口通过良好,未见造影剂外溢,恢复饮食。分析原因可能为肿瘤侵犯食道4 cm以上(图5a),食道切除位置较高,食管空肠吻合有张力,局部血运差;术中放置的引流管术后移位,局部引流不畅(图5b)。
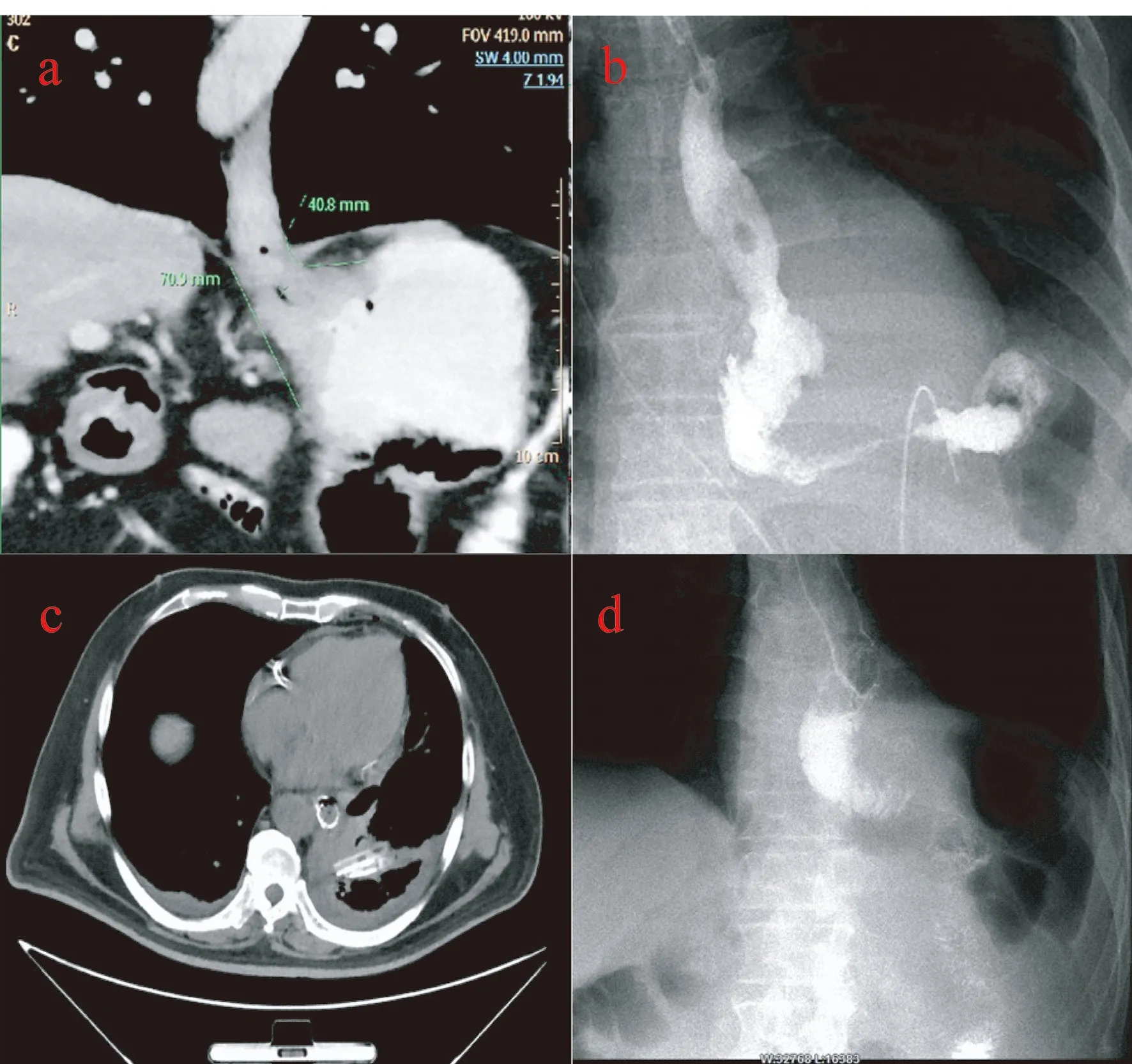
a:CT提示肿瘤侵犯食管约4 cm以上;b:术后5 d造影引流管移位;c:放置胸腔闭式引流;d:术后2周吻合口瘘愈合图5 患者术后上消化道造影检查
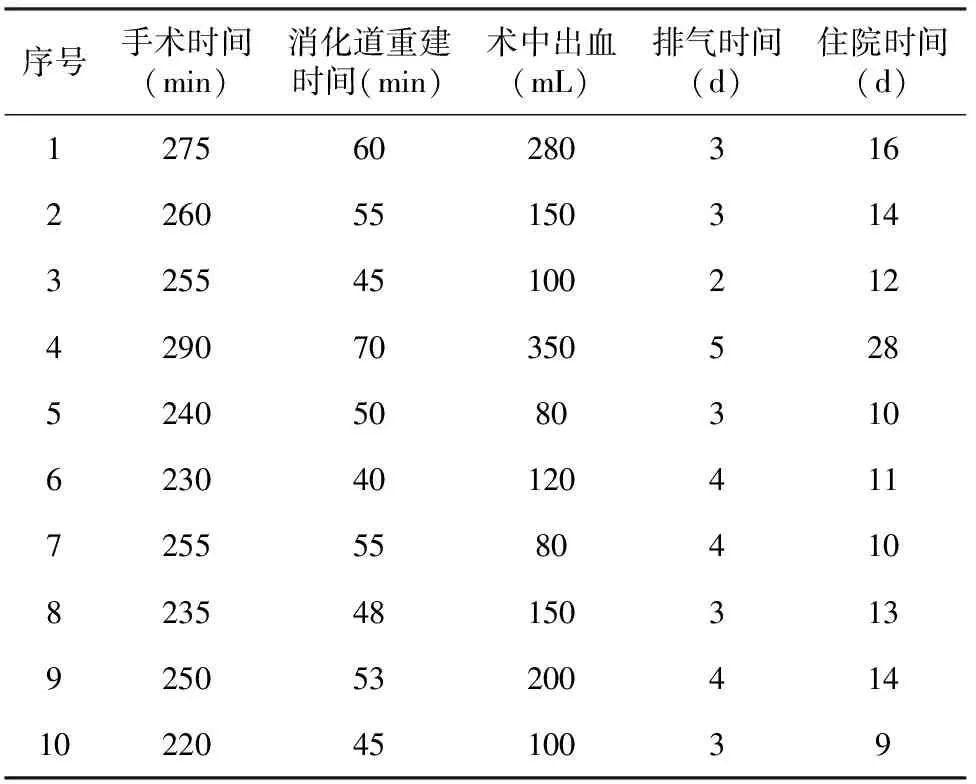
序号手术时间(min)消化道重建时间(min)术中出血(mL)排气时间(d)住院时间(d)1275602803162260551503143255451002124290703505285240508031062304012041172555580410823548150313925053200414102204510039

表2 10例患者术后病理学检查结果
3 讨论
Siewert将AEGJ分为3型[6-7],Ⅰ型肿瘤中心位于胃食管交界处以上1~5 cm并向下生长累及结合部,Ⅱ型肿瘤中心位于胃食管交界处以上1 cm到以下2 cm的区间内,Ⅲ型则是肿瘤中心位于胃食管交界处以下2~5 cm并向上生长累及结合部。既往对Siewert Ⅱ型AEGJ通常采取胸腹联合手术入路,优势在于可以同时对腹部和纵隔淋巴结清扫,但创伤大、手术风险高。而单纯经腹腔入路很难清扫纵隔的淋巴结并进行全腔镜下吻合[8-9]。因此,近年来日本学者开始尝试通过切开左侧膈肌进行淋巴结清扫和消化道重建的手术方式,该方式可以给术者提供充足的操作空间,有效解决食管上切缘高度、下纵隔淋巴结清扫和全腹腔镜下消化道重建的难题,为Siewert Ⅱ型AEGJ的手术方式提供了新思路。然而该手术的实施需要主刀医师具有胸腔食管癌和腹部胃癌手术的双重经验,在多由普通外科医生主刀AEGJ手术的我国,其应用还需一定的学习曲线。本团队从2017年4月开始尝试该手术入路,对10例患者围手术期资料进行总结,探讨其安全性和可行性,为国内同行开展相关手术提供一定经验。
手术方式的选择要考虑以下4个方面:达到阴性的切缘;足够的淋巴结清扫范围和数目;减少围手术期并发症发生率和死亡率;使患者达到最佳的生活质量。
目前对AEGJ手术切缘尚无明确标准,对于经腹AEGJ根治术如何保证食管切缘的阴性是最大的难点。通常的观点认为要保证近端5 cm以上切缘的阴性[10]。Barbour等[11]研究认为对于大于T2期的肿瘤至少应该包括肿瘤原位5 cm内组织和至少3.8 cm的阴性边缘。但Polkowski等[12]研究认为对于AEGJ肿瘤近端2 cm的阴性切缘就足够。同样对于淋巴结切除范围也有一定争论,Hosoda等[13]认为对于Siewert Ⅱ型AEGJ至少应切除第1、2、3和7组;Kurokawa等[10]报道≥2 cm食管浸润的Siewert Ⅱ型AEGJ与下纵隔淋巴结转移明显相关,≥3 cm就应该进行纵隔淋巴结清扫;作者发现通过打开左膈可以暴露出一个足够的空间进行分离和清扫,因此每个患者都可以达到至少5 cm的近侧的阴性边缘,对包括下胸部食管旁(No.110)、膈上(No.111)和中纵膈后(No.112)淋巴结进行了常规清扫。
对于Siewert Ⅱ型AEGJ患者是否需要切除全胃也是目前讨论的热点。Papachristou和Fortner[14]比较了全胃切除与近端胃大部切除术后患者的5年生存率发现全胃切除术患者显著高于近端胃大部切除术者,并且切缘及局部复发率低于近端胃大部切除术者。虽然近端胃切除可以保存部分胃功能,不改变食物的流动顺序,淋巴结清扫也可以满足根治性要求。然而管状胃吻合受限于胰头十二指肠的固定,可切除或吻合范围有限。肿瘤较大或病理分化较差黏膜下浸润情况时,近端胃切除也存在切除范围不够的问题。另一方面,近端胃切除术由于手术破坏了患者原本的食管胃抗反流屏障的解剖结构,切断了患者的迷走神经等原因术后多出现反流性食管炎,使得患者术后生活质量严重下降。因此,本研究主张对SiewertⅡ型AEGJ进行全胃切除。本研究10例手术均采用全胃切除+食管空肠吻合,采用此种方式应确保有足够长度的空肠上提进行吻合,避免吻合口张力过大。如果探查发现肿瘤侵犯食道位置较高,且空肠系膜过短,尝试上牵时系膜张力过高,存在吻合后食管空肠吻合张力过高风险,可考虑行近端胃切除后制作管状胃进行吻合。
胃空肠吻合目前主要有采用圆形吻合器和直线切割闭合器两类,采用腹腔镜手缝食管空肠吻合术也有报道[15]。使用圆形吻合器的优点是外科医生已经熟悉此装置,并知道如何最好地在临床实际中进行调整。全腔镜下使用圆形闭合器端侧吻合主要难点在于吻合器抵钉座的置入,无论是反穿刺法、荷包缝合法或者经口置入法均需要较长的学习曲线。而另外一些医生喜欢使用直线切割闭合器,因为他们更容易在有限的空间进行操作,比圆形吻合器更容易插入空肠和食道,吻合时有更好的观察视角,并通过一个12 mm Trocar即可完成[16-18]。因此,作者认为肿瘤位置较高,更适合圆形吻合器端侧吻合,而在一些肿瘤侵犯食管位置不高,游离远端空肠襻足够长时可以应用直线切割闭合器行侧吻合,较圆形吻合器操作简单,且吻合口不受食管直径限制,降低术后吻合口狭窄发生。
吻合口瘘仍是AEGJ手术最严重的并发症之一,处理不好容易造成纵隔和肺部感染,严重影响预后。本研究1例术后吻合口瘘,分析原因:肿瘤较大且侵犯食道较高,保证切缘阴性的情况下行食道空肠吻合存在张力,进而影响吻合口血供。此后再行食道空肠吻合后因打开膈肌有足够手术操作空间均减张缝合吻合口;另一可能原因,术中吻合口两侧未能正确放置引流管,局部积液感染引起吻合口瘘。术中术野区域的冲洗,放置可靠位置的引流管尤其重要。至于胸腔闭式引流,所有病例均未术中放置。作者认为连续缝合膈肌,并充分鼓肺以后,即使胸腔有少量气体亦能自行吸收,但如果对手术操作不熟悉,膈肌缝合勉强不可靠,建议术中放置胸腔闭式引流。对于吻合口位置过高、吻合后张力较大、高龄、伴有糖尿病等基础疾病的高危患者,建议术中行空肠营养管置入术,可以早期肠内营养亦可避免出现吻合口瘘后营养问题。
总之,作者认为该术式与传统左胸腹联合切口(Ivor Lewis)对比有以下主要优势:①不用变换手术体位;②手术操作相对简单,只需要在腹腔镜下切开膈肌即可进入胸腔,使操作空间手术视野扩大,有利于腹腔及胸腔淋巴清扫及吻合重建;③手术路径是先腹后胸,在胸腔内操作时间大大缩短,很大程度上减少对心肺的影响;④该术式为完全腹腔镜手术,具有微创的优势;⑤可切除的食管位置较高,食管残端切缘阳性率低,食管周围淋巴结清扫彻底。该术式与传统经腹食管裂孔入路比较,则具有视野良好、操作空间较大、吻合操作简单、手术时间短等优势。根据我们的初步经验表明,全腔镜下经腹膈肌入路治疗SiewertⅡ型AEGJ技术上是可行的。然而,它仍然是一个复杂的,需要一定学习曲线的腹腔镜手术,建议目前此手术由经验丰富的腹腔镜外科医生进行。而对其远期疗效的评估需要更多的前瞻性临床试验来验证。

