Mdivi-1对帕金森病大鼠多巴胺能神经元损伤的保护作用研究
郭 欣,朱子建,白 雅,张 云,刘学东
帕金森病(Parkinson’s disease,PD)是临床上常见的神经系统性疾病,其主要临床表现为静止性震颤和肌强直等,其病理特征为黑质纹状体中多巴胺能神经元受损,导致多巴胺(dopamine,DA)的含量显著减少,引起相应的病理改变[1]。目前普遍认为PD的发病可能与遗传、环境因素以及氧化应激等相关[2],但其具体机制仍远未明确。临床上治疗PD的药物多为左旋多巴胺类,但该类药物治疗只能改善临床症状和延缓病程进展,不能阻止疾病向前发展。而且为达到治疗效果需要不断加大剂量,其产生的不良反应如排尿困难等往往令患者难以忍受。因此,开发有效性高且不良反应小的药物已然成为该领域的研究热点之一。
线粒体是真核细胞内一种重要的细胞器,参与能量产生、氧化应激、细胞凋亡等诸多生命活动。研究发现,线粒体功能异常与PD的发病密切相关,例如线粒体ATP产生异常及氧自由基的含量异常升高都参与PD的发生[3-4]。新近研究表明,线粒体处于分裂融合的动态平衡当中,这种平衡对于维持线粒体功能及细胞稳态有重要意义[5]。参与线粒体分裂的分子主要为动力相关蛋白1(dynamin-related protein 1,DRP1)、线粒体分裂蛋白1(mitochondria fission protein 1,FIS1)、线粒体分裂因子(mitochondria fission factor,MFF),参与线粒体融合的分子主要为线粒体融合蛋白1(mitofusin 1,MFN1)、线粒体融合蛋白2(mitofusin 2,MFN2)和视神经萎缩症蛋白1(optic atrophy 1,OPA1)[5-6]。线粒体分裂异常可导致多种疾病的发生[7-9]。α-突触共核蛋白(α-synuclein,α-syn)的氧化损伤被认为是PD的重要发病机制之一[10-11]。有学者研究发现线粒体分裂融合异常可能导致α-syn的氧化损伤,从而参与PD的发生发展[12]。然而,关于线粒体分裂融合异常参与PD进展的具体分子机制尚未研究。本研究从调控线粒体分裂融合的具体分子出发,探究其在PD中的作用及初步机制,并以此为靶点进行干预,为开发治疗PD的药物进行初步探索。
1 材料与方法
1.1 试剂 6-羟基多巴胺(6-hydroxydopamine,6-OHDA)(上海容创生物技术有限公司,货号RKY2061);阿朴吗啡(apomorphine,APO)(美国Sigma公司,货号A4393);美多巴(上海罗氏制药有限公司,批准文号:国药准字H10930198);线粒体分裂抑制剂1(mitochondrial division inhibitor 1,Mdivi-1)(美国Sigma公司,货号M0199);SYBR Green Master Mix试剂盒(日本TAKARA公司,货号RR820A);抗酪氨酸羟化酶抗体(英国Abcam公司,货号ab112);免疫组化试剂盒(北京中杉金桥公司,货号SP-9000-110ml);超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(上海信裕生物科技有限公司,货号XY-1560);丙二醛(malondialdehyde,MDA)检测试剂盒(美国Sigma公司,货号MAK085);还原型谷胱甘肽(glutathione,GSH)检测试剂盒(美国Sigma公司,货号CS0260);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(美国Sigma公司,货号CGP1);一氧化氮(nitric oxide,NO)检测试剂盒(美国Biovision公司,货号K252-200);一氧化氮合酶(nitric oxide synthase,NOS)检测试剂盒(台湾Abnova公司,货号KA1345)。
1.2 仪器 实时定量PCR仪(美国伯乐公司,型号CFX 384);脑立体定位仪(成都仪器厂,型号ST-5ND-C);Panlab旋转记录仪(美国Harvard Apparatus公司,型号LE902);转棒疲劳仪(北京金洋万达科技有限公司,型号JY-YLS-4C);显微镜(日本奥林巴斯奥林巴斯公司,型号SZ51);酶标仪(美国伯乐公司,型号iMark)。
1.3 实验动物分组和处理 将周龄6~8周、体质量220~240 g的SPF级大鼠[许可证号:SCXK(陕)2018-001]随机分为对照组(生理盐水组)、模型组、Mdivi-1组和美多巴组,每组6只。Mdivi-1组给予Mdivi-1 50 mg/(kg·d),美多巴组给予美多巴 50 mg/(kg·d),模型组、对照组给予相同剂量的0.5%羧甲基纤维素钠水溶液(灌胃给药),给药6周,1/d。
1.4 PD大鼠模型制备方法 将大鼠采用剂量为3.5 mL/kg水合氯醛麻醉后,利用脑定位仪固定大脑,消毒后手术切开充分暴露前囟。参照Paxinos等方法确定的脑图谱,并按照Liu等[13]提供的方法对纹状体三点进行注射。每点用微量注射器缓慢注射6-OHDA(浓度为4 g/L,母液为含0.02%抗坏血酸的生理盐水)1.0 μL,结束后针头继续放置5 min。待针头缓慢拔出后缝合切口并预防感染。对照组采用上述方法注射相同剂量的生理盐水。术后第5周,采用APO(0.5 mg/kg)皮下注射的方法诱发大鼠旋转并记录从开始到30 min内旋转的圈数。将向损伤侧旋转的圈数与向健侧旋转的圈数差值大于80 r/h的视为造模成功。
1.5 PD大鼠行为学观察 在注射APO第3周和第6周后,分别观察和记录30 min内大鼠向健侧旋转的圈数。同时,采用旋转棒实验观察大鼠术后第3和第6周的行为学变化。将大鼠置于旋转棒上,旋转棒启动后立即计时。大鼠为稳定在旋转棒上需不断转动,随着旋转棒加速,大鼠最终从旋转棒上掉下,结束计时。
1.6 ELISA法检测氧化应激相关指标 大鼠安乐死后,取出脑组织,将纹状体和中脑黑质区域剥离并称重,放于生理盐水中,制成终浓度为10%的匀浆液。在3 000 r/min条件下离心后小心吸取上清液为待测样品。采用商品化的试剂盒,按照操作说明步骤分别检测SOD、过氧化氢酶(catalase,CAT)、GSH-Px、NOS活性和MDA、GSH、NO含量。
1.7 实时定量PCR检测线粒体分裂融合相关分子 取出各组脑组织的纹状体和中脑后,按照组织RNA提取试剂盒说明书步骤提取RNA,反转录成cDNA。采用实时定量PCR法检测DRP1、FIS1、MFF、MFN1、MFN2和OPA1的mRNA表达水平。以GAPDH为内参,每个样品设3个复孔。所用引物分别如下:DRP1,F:5′-CGTAGTGGGAACGCAGAG-3′和R:5′-ACAGGCACCTTGGTCATT-3′;FIS1,F:5′-AAAGGGAGCAAGGAGGAA-3′和R:5′-GGAGAACAGGGAAAGGACA3′;MFF,F:5′-ACATGCGCATTGGAGCAGTA-3和R:5′-GCCCCACTCACCAAATGAGA-3′;MFN1,F:5′-GTTTTTCCCTGGGCTGGTCT-3′和R:5′-CTCCTTGGCATGGGTGGTC-3′;MFN2,F:5′-GGGACCGCATCTTCTTTG-3′和R:5′-GTCTTGCCGCTCTTCACG-3′;OPA1,F:5′-TCATGGATCCGAAAGTGACA-3′和R:5′-ATCCTTCTGCAGCACCAACT-3′。
1.8 免疫组化检测大鼠脑组织酪氨酸羟化酶(tyrosine hydroxylasez,TH)表达 将大鼠处死后取出脑组织后制成冰冻切片。放入0.3% Triton X-100溶液中处理30 min。在3%的H2O2中封闭15 min,在山羊血清中封闭20 min,加入TH一抗(1∶200稀释)溶液4 ℃孵育过夜。山羊抗鼠二抗孵育20 min,辣根酶标记的链霉卵白素孵育30 min。DAB显色后,苏木素复染,梯度酒精脱水,二甲苯透明后封片。根据TH染色强度,分析并统计黑质区TH阳性细胞数和纹状体区TH阳性纤维密度。
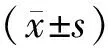
2 结果
2.1 PD大鼠模型制备成功 与对照组相比,模型组在术后第5周给予APO诱导后旋转圈数显著增多(P<0.05),对照组则无明显旋转。同时转棒实验显示模型组在转棒上的停留时间显著短于对照组(P<0.05),表明PD大鼠模型制备成功,表1、表2。
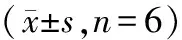
表1 APO诱导大鼠旋转圈数改变
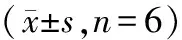
表2 APO诱导大鼠转棒停留时间改变
2.2 PD大鼠线粒体分裂融合相关分子表达 进一步实时定量PCR结果显示,模型组大鼠脑组织中线粒体分裂关键调控因子DRP1的mRNA表达水平显著高于对照组(P<0.001),而其他线粒体分裂相关分子FIS1及MFF,融合相关分子MFN1、MFN2及OPA1的表达未见明显变化(图1)。
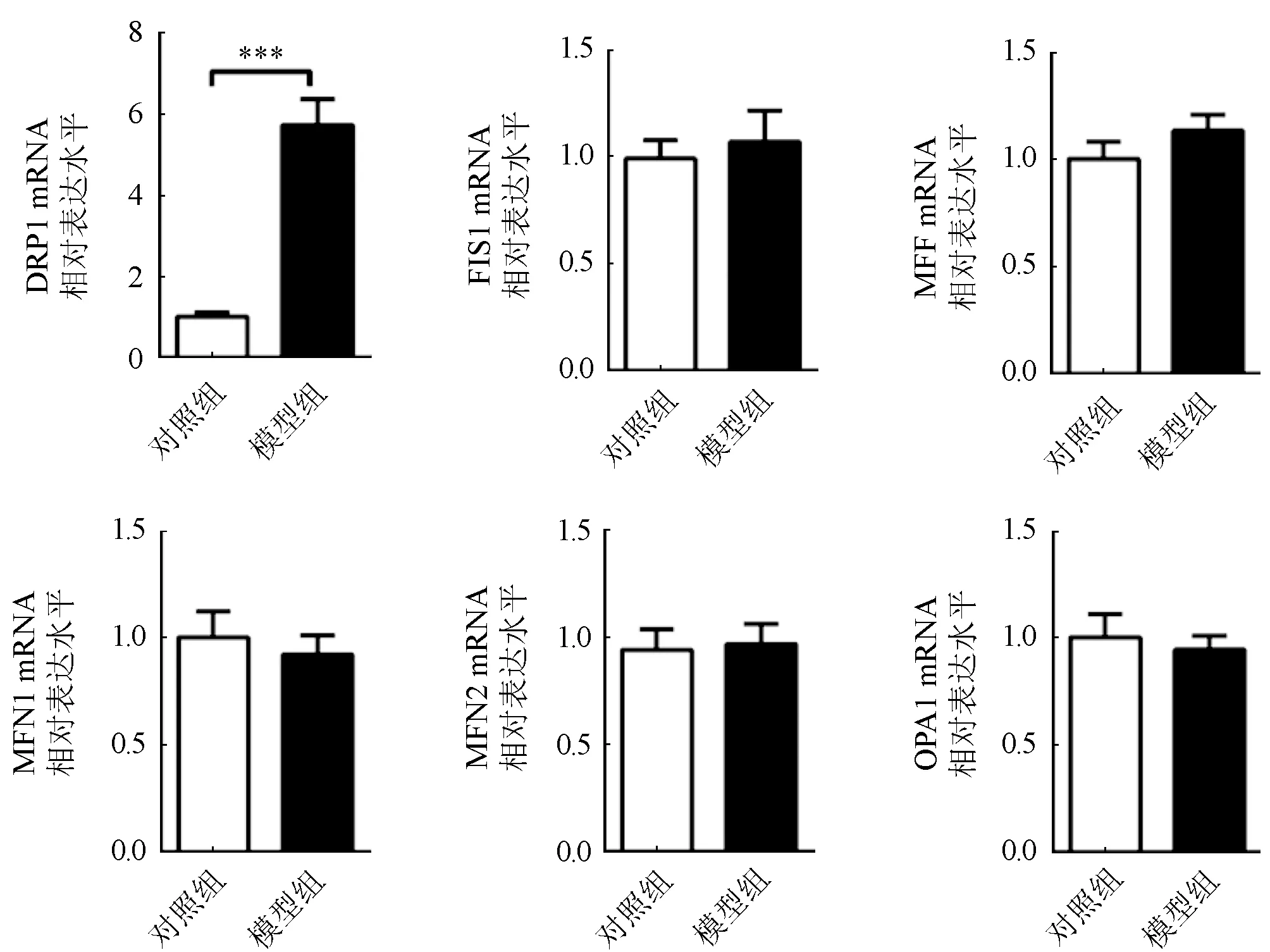
图1 实时定量PCR检测APO诱导大鼠线粒体分裂融合相关分子表达
2.3 DRP1抑制剂Mdivi-1对PD大鼠行为学影响与模型组比较,经过Mdivi-1处理后第3周及6周,大鼠的旋转圈均数显著减少(P<0.05),同时,经美多巴处理后第3周及6周大鼠的旋转圈数均较模型组显著减少,但略高于Mdivi-1组(P<0.05,表3)。旋转棒实验结果显示Mdivi-1组及美多巴组在给药后第3周及6周停留在旋转棒上的时间均长于模型组(P<0.05,表4)。
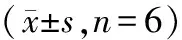
表3 Mdivi-1对APO诱导大鼠旋转圈数改变
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05

表4 Mdivi-1对APO诱导大鼠转棒停留时间改变
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.4 DRP1抑制剂Mdivi-1对PD大鼠脑组织内TH表达影响 与对照组相比,模型组的大鼠脑组织左右两侧黑质的TH阳性细胞数都显著减少(P<0.05),同时左右两侧纹状体中TH阳性纤维密度与对照组比较也都显著降低(P<0.05)。采用Mdivi-1及美多巴处理后第3周和6周,该组大鼠左右两侧黑质TH阳性细胞数均较模型组增多(P<0.05),左右两侧纹状体中TH阳性纤维密度均高于模型组(P<0.05)。表5、表6。
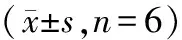
表5 Mdivi-1对大鼠黑质TH表达影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
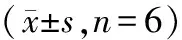
表6 Mdivi-1对大鼠纹状体TH表达影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
2.5 DRP1抑制剂Mdivi-1对PD大鼠SOD,GSH-Px,CAT,NOS活性和MDA,GSH,NO含量的影响 模型组中损伤侧的黑质和纹状体中SOD、GSH-Px和CAT活性显著低于对照组;同时NOS的表达以及MDA、GSH、NO含量显著上升(P<0.05)。Mdivi-1组和美多巴组在处理3周后,大鼠损伤侧的黑质和纹状体中SOD、GSH-Px、GSH和CAT活性均显著高于模型组(P<0.05),而NOS的表达均显著下降,同时MDA、NO含量均较模型组显著下降(P<0.05)。表7、表8。
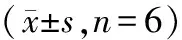
表7 Mdivi-1对大鼠黑质中SOD、GSH-Px、CAT、NOS活性和MDA、GSH、NO含量的影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
表8 Mdivi-1对大鼠纹状体中SOD、GSH-Px、CAT、NOS活性和MDA、GSH、NO含量影响
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05
3 讨论
目前研究认为氧化应激在PD发病过程中起着非常重要作用[14],而线粒体是产生氧自由基的主要细胞器,因此线粒体异常与PD发病的相关性研究已成为该领域的热点[15-16]。线粒体分裂融合是调控线粒体结构与功能的重要方式。因此,干预线粒体分裂融合有望成为治疗PD的重要手段。但到目前为止,关于线粒体分裂融合异常与PD的发生进展尚未进行系统研究。此前,Bido等[17]利用病毒,使大鼠人类A53T-α-突触共核蛋白(human A53T-α-synuclein,hA53T-α-syn)过表达并注射Mdivi-1,结果显示,Mdivi-1可阻止DA的减少以及hA53T-α-syn所引起的神经毒性作用,而且Mdivi-1有抑制α-syn氧化应激的作用。而本研究利用6-OHDA注射单侧纹状体方法建立PD大鼠模型。对PD大鼠模型的行为学进行观察,并通过DA受体激动剂APO诱发的旋转实验和转棒实验作为判断PD大鼠模型是否构建成功的标准[18]。本研究发现,PD大鼠模型组在APO诱导后出现明显的旋转,且该组大鼠在转棒上停留时间显著缩短。同时通过免疫组化实验发现,PD大鼠黑质中TH阳性细胞比例显著下降,在纹状体中TH阳性表达纤维的数量显著减少,与PD的病理特征相符。这表明我们利用6-OHDA注射单侧纹状体的方法成功构建PD大鼠模型,在此模型基础上可进行下一步研究。
在PD大鼠模型组,利用实时定量PCR检测线粒体分裂融合相关分子的表达变化。线粒体分裂关键调控分子DRP1在PD大鼠脑组织中的表达显著高于正常对照组。本研究初步提示线粒体分裂关键调控分子异常增多可能在PD发生进展中扮演重要角色。本研究以DRP1为切入点,探究干预DRP1后能否改善PD大鼠多巴胺能神经元受损状况。
Mdivi-1是一种小分子化合物,是DRP1的有效抑制剂。本研究根据上述结果,采用Mdivi-1抑制DRP1后,观察其对6-OHDA诱导的PD大鼠模型的干预效果,并将实验结果与已知PD治疗药物美多巴进行比对,初步探讨其可能的机制。本研究发现,Mdivi-1组与美多巴组的实验结果相似,都可显著改善PD大鼠的行为学特征。例如PD大鼠模型组在Mdivi-1处理后,可显著减轻APO诱发的旋转圈数,同时大大延长PD大鼠在旋转棒上停留的时间。此外,经过Mdivi-1干预后,PD大鼠脑组织黑质中TH阳性细胞数目和纹状体中TH阳性染色纤维密度较未干预PD组显著增加。本研究表明Mdivi-1可对6-OHDA注射法诱导的PD大鼠多巴胺神经元有着重要的保护作用。
线粒体是氧化应激的重要场所[19],氧化应激已是公认的PD重要病因之一[20]。本研究从氧化应激角度初步探索Mdivi-1显著改善PD大鼠受损的多巴胺能神经元的机制。在6-OHDA引发的PD大鼠黑质及纹状体中,抗氧化酶系统活性如SOD、GSH-Px、CAT显著降低,同时抗氧化物质GSH含量降低,导致氧自由基如MDA和NO含量升高,且增强NOS的表达水平,表明机体抗氧化系统异常,机体处于氧化应激状态。而对Mdivi-1处理后的PD大鼠黑质和纹状体中的抗氧化酶系统活性以及相关物质含量检测后发现,SOD、GSH-Px、CAT和GSH活力显著提高,MDA和NO含量明显降低,与美多巴实验结果相近,同时NOS的表达降低,与美多巴组实验结果相近。本研究表明Mdivi-1可显著提高6-OHDA诱发的PD大鼠抗氧化能力。
综上,DRP1抑制剂Mdivi-1可显著修复PD大鼠受损的多巴胺能神经元,改善PD症状,且提高机体的抗氧化能力。这表明Mdivi-1具有保护6-OHDA诱发的PD大鼠神经元功能,且这种功能可能与增强其抗氧化能力有关。进一步研究Mdivi-1修复多巴胺能神经元和对抗氧化应激的机制,对探索治疗PD的新方法具有重要意义。

