热研4号王草对不同有机磷活化利用能力的评价
黄睿 赵兴坤 虞道耿 刘攀道 刘国道 王文强
摘 要 本研究以热研4号王草(Pennisetum purpureum × P. glaucum cv. Reyan No. 4)为材料,通过砂培试验评价其对4种有机磷的利用能力。结果表明,王草对三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)和6-磷酸葡萄糖(G6P)均具有利用能力,且對磷酸单酯类(AMP和G6P)的利用能力更强。酸性磷酸酶(ACP)活性分析表明,有机磷处理使王草根系内源与分泌的总ACP活性显著增加0.9倍以上,但王草对有机磷的利用能力与根系总ACP活性无相关性。进一步分析发现,王草根系分泌特异ACP活性与不同有机磷处理的植株干重显著正相关,相关系数R2=0.861。综上所述,本研究发现王草对不同类型有机磷的利用能力主要由其根系分泌的特异ACP活性决定。研究结果可为选育磷高效热带牧草品种提供理论依据。
关键词 王草;有机磷;酸性磷酸酶;酸性土壤;低磷胁迫
中图分类号 S543 文献标识码 A
Abstract In this study, Pennisetum purpureum × P. glaucum cv. Reyan No. 4 (King grass) was used to investigate the capacity to utilize four types of organic phosphorus (P) in a sand cultivation experiment. The results showed that King grass had different capabilities to mobilize adenosine triphosphate (ATP), adenosine diphosphate (ADP), adenosine monophosphate (AMP), glucose-6-phosphate (G6P), and more capable of utilizing phosphate monoester (AMP or G6P) as the sole P source. Analysis of acid phosphatase (ACP) activity showed that total internal-ACP and secreted-ACP activities of roots significantly increased by more than 0.9-fold in organic P treatments. However, correlation between root total ACP activity and capacity to utilize organic P in King grass was not significant. Furthermore, significant positive correlation was found between root specific secreted-ACP activity and plant dry weight in different organic P treatments, with the observed R2=0.861. Taken together, our results suggest that root specific secreted-ACP activity control organic P utilization in King grass. Our results would provide a theoretical basis for selecting and breeding tropical grass varieties with high P efficiency.
Keywords King grass; organic phosphorus; acid phosphatase; acid soil; phosphorus deficiency
DOI 10.3969/j.issn.1000-2561.2019.05.003
全世界范围内有超过50%的可耕作土壤为pH低于5.5的酸性土壤[1]。在我国南方各省区,有将近2千万hm2的酸性土壤,约占全国耕地面积的21%[2]。磷是植物生长发育不可缺少的大量营养元素[3]。植物对土壤中磷素的吸收主要以无机可溶性磷(正磷酸根,Pi)形式,但在酸性土壤中,Pi易被铝和铁等离子固定,形成不能被植物直接吸收和利用的无机难容性磷[3]。因此,低磷胁迫已成为酸性土壤限制作物生产的主要障碍因子之一[4]。
土壤中虽然Pi的浓度低,但储藏着丰富的有机磷[5]。有机磷一般占土壤全磷含量的30%~65%,包括磷酸酯、多聚磷酸酯、微生物量磷等类型[5]。其中,磷酸酯在土壤有机磷中占比最大,如磷酸糖类、单核苷酸、植酸磷等[6]。但是,有机磷难于被植物直接利用,只有被酸性磷酸酶(acid phosphatase,ACP)降解后释放出的Pi才能被根系吸收[7]。已有的研究表明,多数作物在缺磷条件下的根系ACP活性显著增加,如:水稻(Oryza sativa)、小麦(Triticum aestivum)、玉米(Zea mays)、大豆(Glycine max)、油菜(Brassica napus)、菜豆(Phaseolus vulgaris)等[8]。通过提高ACP活性促进对有机磷的活化利用,是植物中普遍存在的适应低磷胁迫机制[9]。
热研4号王草(Pennisetum purpureum×P. glaucum cv. Reyan No. 4)是一种由象草和美洲狼尾草杂交获得的禾本科狼尾草属植物[10]。王草的光合效率高,株型大(株高1.5~4.5 m),年鲜草产量一般可达300 t/hm2以上,其营养成分在热带禾本科牧草中处于较高水平[11]。目前,王草在我国南方热带和亚热带地区被大量种植,是一种高产优质的热带牧草与饲料作物[12]。此外,王草可作为培养基质用于栽培平菇、灵芝、猴头菇、滑菇、草菇等食用菌[12]。虽然王草的产量高,但其对肥料的需求巨大[13]。因此,改良王草的养分利用效率对热带牧草的“减肥增效”具有重要意义。本研究将评价王草对土壤潜在磷库—有机磷的利用能力,并分析根系ACP活性与有机磷的利用的相关性,以期为培育磷高效的王草品种提供理论基础。
1 材料与方法
1.1 植物材料和培养条件
以热研4号王草为试验材料,于2017年8—11月在海南大学热带农林学院基地网室进行材料培养。参照Kong等[14]的砂培试验方法,对王草进行不同的磷源处理。选取长度约为15 cm的王草种茎,置于盛有砂子的盆中,盖上2 cm厚的砂子。待种茎发芽后,选取出苗整齐的种苗,低磷(?P)和正常供磷(+P)处理分别以含10 μmol/L KH2PO4和600 μmol/L KH2PO4的Hoag land营养液进行浇灌,每2 d浇营养液一次,每次浇透。在处理后的6、12、18、24 d收获样品。有机磷处理以含不同有机磷源的Hoagland营养液进行浇灌,包括三磷酸腺苷(+ATP,200 μmol/L ATP);二磷酸腺苷(+ADP,300 μmol/L ADP)、一磷酸腺苷(+AMP,600 μmol/L AMP)和6-磷酸葡萄糖(+G6P,600 μmol/L G6P)。处理18 d后收获样品。
1.2 方法
1.2.1 植株干重和全磷含测定 收获的王草样品在75 ℃烘干至恒重后测定植株干重,每处理测4个生物学重复。称取约0.07 g研磨混匀后的干样品,用乙醇/浓硫酸(V/V=95/5)混合液浸湿后,置于马福炉中600 ℃灰化10 h。灰化后的样品用8 mL HCl(100 mmol/L)溶解后即为磷提取液。全磷含量的测定参照Murphy等[15]的方法,取适量体积的样品磷提取液,用双蒸水定容到1.8 mL,再加入0.2 mL钼锑抗显色液,混匀后静置30 min,测OD700的吸光值。
1.2.2 根系内源的ACP活性测定 称取0.1~0.2 g的根系新鲜样品,用1.2 mL Tris-HCl缓冲液(0.1 mol/L,pH 6.8)研磨成匀浆后离心(14 000 r/min,4 ℃,30 min),收集上清液即为内源蛋白提取液。蛋白浓度参照Bradford[16]的方法测定。内源总ACP活性参照Liang等[17]的方法,以硝基苯磷酸环己胺(ρ-NPP)为磷酸酶底物,用醋酸-醋酸钠缓冲液(45 mmol/L,pH 5.0)配制成含1 mmol/L ρ-NPP的底物反应液。取适量体积的内源蛋白提取液与1.8 mL底物反应液混合并用双蒸水定容至2 mL。37 ℃反应15 min,用0.2 mL NaOH溶液(2 mol/L)终止反应,测OD405的吸光度值。内源特异ACP活性的测定参照George等[18]的方法,分别配制ATP、ADP、AMP和G6P的底物反应液(浓度为2 mmol/L),用于测定ATP磷酸酶(ATPase)、ADP磷酸酶(ADPase)、AMP磷酸酶(AMPase)和G6P磷酸酶(G6Pase)的活性。取适量体积的内源蛋白提取液加到0.8 mL底物反应液中,用双蒸水定容至0.9 mL。混匀后于37 ℃反应60 min,用0.3 mL的三氯乙酸溶液(10%)终止反应。参照Irving和McLaughlin[19]的孔雀石绿测磷方法,通过OD650的吸光度值计算ACP催化底物释放的Pi。以不含底物的反应液作为样品对照,计算样品本身的Pi浓度。酶活力单位1 U表示1 min内转化1 μmol底物的酶量。内源ACP活性用单位蛋白(mg)的酶活力单位(U)表示。
1.2.3 根系分泌的ACP活性测定 待测的植株活体根系用CaCl2溶液(0.5 mmol/L)冲洗3次,根据Richardson等[20]的方法测定根系分泌的ACP活性。总ACP活性以ρ-NPP为底物,特异ACP以相应的有机磷为底物。冲洗的根系浸没于200 mL的底物反应液(1 mmol/L),25 ℃避光反应15 min后加入20 mL反应终止液。取出根系,将反应液在室温下12 000 r/min,离心2 min。总ACP活性取上清液测定OD405,特异ACP活性测定OD650。分泌ACP活性用单位根鲜重(g)的酶活力单位(U)表示。
1.3 數据统计
通过SPSS18.0软件对试验数据进行统计分析与相关性分析。数据可视化作图采用Microsoft Excel 2013软件。
2 结果与分析
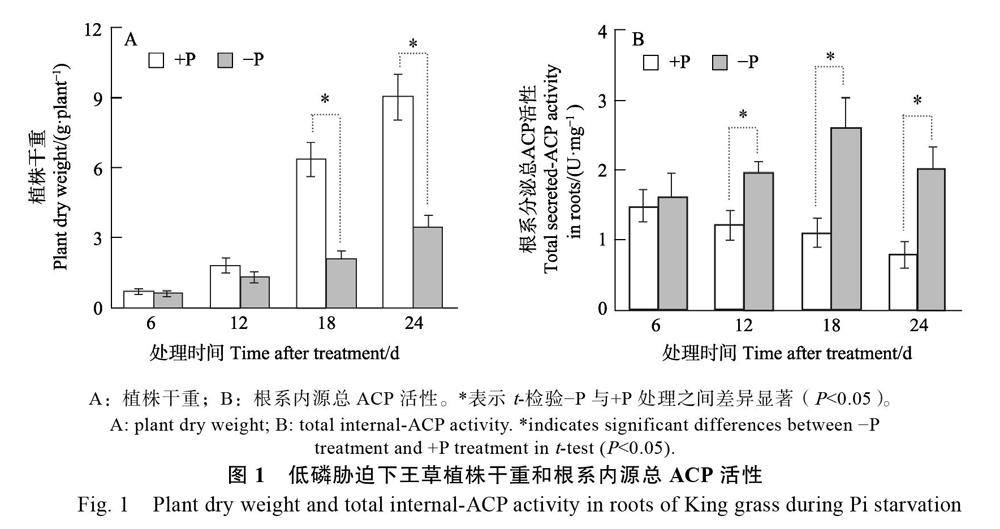
2.1 低磷胁迫对王草植株干重和根系内源总ACP活性的动态影响
低磷胁迫(?P)处理6 d和12 d对王草的生长无显著抑制作用,但从第18天开始,?P处理显著抑制了王草生长,?P处理18 d和24 d的王草植株干重分别只有正常供磷(+P)处理的33%和38%,差异显著。与植株干重不同,王草的根系内源总ACP活性从?P与+P处理第12天开始就出现显著的处理间差异,?P处理12、18、24 d的根系内源总ACP活性比+P处理高60%~153%。以上结果表明王草的ACP活性虽然在?P处理12 d就开始响应低磷胁迫,但植株干重在?P处理18 d后才显著降低。
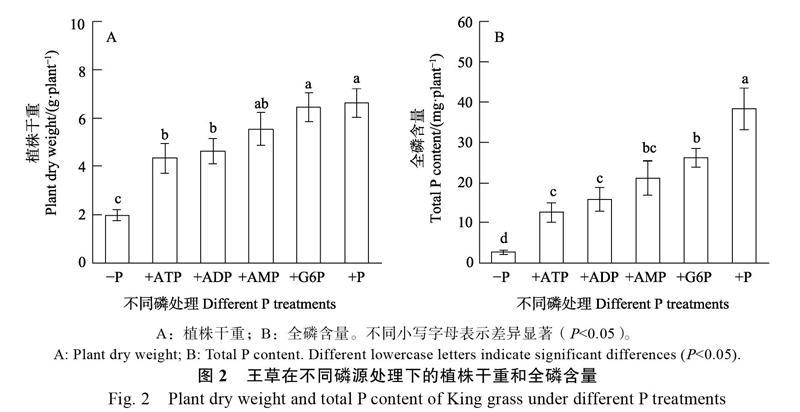
2.2 不同有机磷处理对王草植株干重和全磷含量的影响
根据2.1的实验结果,选取处理时长18 d对王草进行四种不同的有机磷(+ATP,+ADP,+AMP,+G6P)处理。4种有机磷处理使王草的植株干重和全磷含量分别比?P处理提高1.1~2.2倍和3.7~8.8倍,分别达到+P处理下植株干重和全磷含量的66%~98%和33%~68%,表明王草对这4种有机磷均具有利用能力。但是,王草对不同有机磷的利用能力存在差异。在+G6P处理下的植株干重和全磷含量显著高于+ATP处理与+ADP处理,表明王草对G6P具有更强的利用能力。王草对4种不同有机磷的利用能力强弱为:G6P≥AMP≥ADP≥AMP。
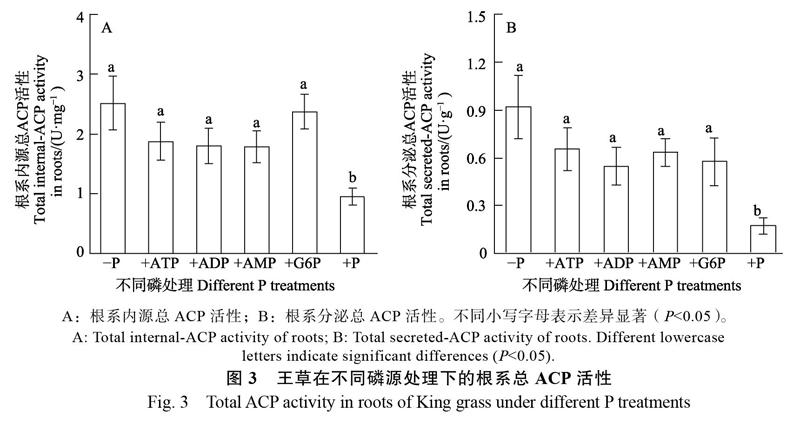
2.3 不同有机磷处理对王草根系总ACP活性的影响
?P处理使根系内源和分泌的总ACP活性分别比+P处理提高1.6和4.5倍,差异显著(P<0.05)。在4种有机磷(+ATP,+ADP,+AMP,+G6P)处理下,虽然根系内源和分泌的总ACP活性与?P处理间无显著差异,但比+P处理增加0.9~1.5倍与2.3~2.9倍,差异显著(P<0.05)。王草对4种有机磷的利用能力与根系总ACP活性的相关性分析,王草在不同有机磷处理下的植株干重与根系内源和分泌的ACP活性均无相关性(P>0.05)。以上结果表明,由于有机磷处理条件下的磷有效性低(Pi含量低),王草的根系内源和分泌的总ACP活性显著增加,但是根系总ACP活性不能解释王草对不同有机磷利用能力的差异。
2.4 不同有机磷处理对王草根系特异ACP活性的影响
为解析王草对不同有机磷利用能力的差异,本研究进一步分析了相应有机磷处理下的特异ACP活性,即测定:+ATP处理的ATPase活性、+ADP处理的ADPase活性、+AMP处理的AMPase活性和+G6P处理的G6Pase活性。+ATP处理下的根系内源的特异ACP活性显著高于其他三种有机磷处理(+ADP,+AMP,+G6P)。相关性分析表明,王草在不同有机磷处理下的植株干重与根系内源的特异ACP活性无显著相关性。与内源的特异ACP活性不同,在+AMP和+G6P处理下,根系分泌的特异ACP活性显著高于+ATP和+ADP处理。并且,在不同有机磷处理下,王草的植株干重与根系分泌的特异ACP活性呈显著正相关关系(R2=0.861, P<0.01)。以上结果表明,王草根系分泌的特异ACP活性高低,决定了其对相应有机磷利用能力的强弱。
3 讨论
土壤中的有机磷根据其分子结构差异分为磷酸酯、膦酸盐、多聚磷酸酯、微生物量磷等[21]。其中,磷酸酯又分为磷酸单酯类和磷酸二酯类[21]。磷酸单酯通过羟基酯化与C链相连,形成磷酸酯(C-O-P)形式,是土壤中含量最为丰富的有机磷类型,如植酸磷、磷酸糖类和单核苷酸等属于此類[22]。磷酸二酯以C-O-P-O-C形式桥接,如磷脂类和核酸等,耕作土壤中磷酸二酯在有机磷含量中占比低于10%[22]。膦酸盐含碳磷键(C-P),主要来源于农业生产中使用的含磷农药残留物,如草甘膦[23]。多聚磷酸酯具有磷酸单酯和膦酸盐的符合结构,如ATP和ADP等[24]。微生物量磷是土壤中所有活体微生物细胞内所含的磷,主要以核酸形式存在,约占土壤全磷的0.4%~7.5%[25]。虽然土壤中的有机磷含量丰富,但需要被ACP催化降解后才能被植物利用。研究植物根系ACP活化利用有机磷的机理,对选育磷高效的作物与牧草品种具有重要意义[26]。
植物根系的ACP根据其亚细胞定位可被分为两大类,第1类为分泌型ACP,包括细胞壁、质外体或根系分泌到土壤中的ACP,主要参与根际环境和胞外空间的有机磷活化利用;第2类为内源ACP,一般指定位于胞内空间的ACP,如细胞质和液泡中的ACP,主要参与细胞中贮存有机磷的再活化利用[27]。已有研究表明,植物对外源有机磷的活化利用主要与根系分泌ACP相关[28]。本研究发现,在4种有机磷处理下,根系内源与分泌的总ACP活性均显著增加,但分泌ACP活性的增幅更大,这可能是由于在缺乏Pi条件下,王草通过调控根系分泌大量ACP来活化外源有机磷。
ACP根据底物特异性可被分为:植酸酶(phytase)、磷酸葡萄糖磷酸酶(glucose phosphate phosphatase)、腺嘌呤核苷三磷酸磷酸酶(ATP phosphatase)、焦磷酸磷酸酶(pyrophosphate phosphatase)等,不同类型的ACP对有机磷的催化活性存在差异[7, 29]。已有的研究表明,小麦、三叶草(Trifolium subterraneum)和苜蓿(Medicago sativa)由于根系分泌的ACP不具有植酸酶活性,导致它们缺乏对植酸磷的利用能力[30]。本研究的结果表明,王草能活化利用所选用的4种有机磷,且对磷酸单酯类有机磷(G6P和AMP)的利用能力强于对多聚磷酸酯类有机磷(ATP和ADP)的利用能力。相关性分析表明,王草对4种有机磷的活化利用能力与根系内源总ACP活性、分泌总ACP活性和内源特异ACP活性均无显著相关性,而与根系分泌特异ACP活性显著正相关。因此,王草对AMP和G6P的利用能力较强主要是由于根系分泌的特异ATPase和G6Pase活性较高导致的。本研究对狼尾草属植物的磷高效种质筛选具有参考价值,分析该属植物对不同类型外源有机磷的利用能力,可以用根系分泌特异ACP活性作为主要评价指标之一。
综上所述,本研究证明了低磷胁迫诱导王草根系内源与分泌的ACP活性增加。王草对磷酸单酯类的利用能力强于多聚磷酸酯,并初步解析了王草对不同有机磷的活化利用能力强弱主要由根系分泌的特异ACP活性决定。研究结果将为后续研究选育磷高效的热带牧草品种提供理论依据。
参考文献
[1]Kochian L V, Pi?eros M A, Liu J, et al. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance[J]. Annual Review of Plant Biology, 2015, 66: 571-598.
[2]赵天龙, 解光宁, 张晓霞, 等. 酸性土壤上植物应对铝胁迫的过程与机制[J]. 应用生态学报, 2013, 24(10): 3003-3011.
[3]Lambers H, Plaxton W C. Phosphorus: back to the roots[M]//Plaxton W C, Lambers H. Annual Plant Reviews Volume 48: Phosphorus metabolism in Plants. Hoboken, NJ, USA: John Wiley & Sons, Inc., 2015: 3-22.
[4]羅红艳, 石零珊, 汪凤林, 等. 低磷和铝毒耦合胁迫对杉木叶片抗坏血酸—谷胱甘肽循环的影响[J]. 热带作物学报, 2018, 39(5): 873-880.
[5]Shen J, Yuan L, Zhang J, et al. Phosphorus dynamics: from soil to plant[J]. Plant Physiology, 2011, 156(3): 997-1005.
[6]汪 洪, 宋书会, 张金尧, 等. 土壤磷形态组分分级及31P-NMR技术应用研究进展[J]. 植物营养与肥料学报, 2017, 23(2): 512-523.
[7]Duff S M G, Sarath G, Plaxton W C. The role of acid phosphatases in plant phosphorus metabolism[J]. Physiologia Plantarum, 1994, 90: 791-800.
[8]Wang L, Liu D. Functions and regulation of phosphate starvation-induced secreted acid phosphatases in higher plants[J]. Plant Science, 2018, 271: 108-116.
[9]刘攀道, 郇恒福, 刘一明, 等. 低磷胁迫对太空诱变耐低磷柱花草酸性磷酸酶活性和磷效率的影响[J]. 草业学报, 2018, 27(8): 78-85.
[10]刘国道, 白昌军, 王东劲, 等. 热研4号王草选育[J]. 草地学报, 2002, 10(2): 92-96.
[11]郭 孝, 邓红雨, 白昌军, 等. 黄河滩区不同刈割期对热研4号王草生产性能和品质的影响[J]. 草地学报, 2017, 25(3): 639-645.
[12]侯冠彧, 王东劲, 周汉林. 热研4号王草利用概述[J]. 热带农业科学, 2009, 29(3): 71-74.
[13]陈 勇, 罗富成, 毛华明, 等. 施肥水平和不同株高刈割对王草产量和品质的影响[J]. 草业科学, 2009, 26(2): 72-75.
[14]Kong Y B, Li X H, Ma J, et al. GmPAP4, a novel purple acid phosphatase gene isolated from soybean (Glycine max), enhanced extracellular phytate utilization in Arabidopsis thaliana[J]. Plant Cell Reports, 2014, 33: 655-667.
[15]Murphy J, Riley J P. A modified single solution method for the determination of phosphate in natural waters[J]. Analytica Chimica Acta, 1962, 27: 31-36.
[16]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[17]Liang C, Tian J, Lam H M, et al. Biochemical and molecular characterization of PvPAP3, a novel purple acid phosphatase isolated from common bean enhancing extracellular ATP utilization[J]. Plant Physiology, 2010, 152: 854-865.
[18]George T S, Gregory P J, Hocking P, et al. Variation in root-associated phosphatase activities in wheat contributes to the utilization of organic P substrates in vitro, but does not explain differences in the P-nutrition of plants when grown in soils[J]. Environmental and Experimental Botany, 2008, 64: 239-249.
[19]Irving G C J, McLaughlin M J. A rapid and simple field-test for phosphorus in Olsen and Bray No. 1 extracts of soil[J]. Communications in Soil Science and Plant Analysis, 1990, 21: 2245-2255.
[20]Richardson A E, Hadobas P A, Hayes J E. Acid phosphomonoesterase and phytase activities of wheat (Triticum aestivum L.) roots and utilization of organic phosphorus substrates by seedlings grown in sterile culture[J]. Plant, Cell & Environment, 2000, 23: 397-405.
[21]Huang L M, Jia X X, Zhang G L, et al. Soil organic phosphorus transformation during ecosystem development: A review[J]. Plant and Soil, 2017, 417: 17-42.
[22]Cade-Menun B, Liu C W. Solution phosphorus-31 nuclear magnetic resonance spectroscopy of soils from 2005 to 2013: A review of sample preparation and experimental parameters[J]. Soil Science Society of America Journal, 2014, 78: 19-37.
[23]Turner B L, Mahieu N, Condron L M. Phosphorus-31 nuclear magnetic resonance spectral assignments of phosphorus compounds in soil NaOH-EDTA extracts[J]. Soil Science Society of America Journal, 2003, 67: 497-510.
[24]Menezes-Blackburn D, Giles C, Darch T, et al. Opportunities for mobilizing recalcitrant phosphorus from agricultural soils: a review[J]. Plant and Soil, 2018, 427: 5-16.
[25]Richardson A E, Simpson R J. Soil microorganisms mediating phosphorus availability update on microbial phosphorus[J]. Plant Physiology, 2011, 156: 989-996.
[26]López-Arredondo D L, Leyva-González M A, González- Morales S I, et al. Phosphate nutrition: improving low- phosphate tolerance in crops[J]. Annual Review of Plant Biology, 2014, 65: 95-123.
[27]Tian J, Liao H. The role of intracellular and secreted purple acid phosphatases in plant phosphorus scavenging and recycling[M// Plaxton W C, Lambers H. Annual Plant Reviews Volume 48: Phosphorus Metabolism in Plants. Hoboken, NJ, USA: John Wiley & Sons, Inc., 2015: 265-287.
[28]劉攀道, 董荣书, 丁西朋, 等. 不同磷效率柱花草基因型对外源DNA活化利用能力的比较分析[J]. 分子植物育种, 2018, 16(4): 1085-1091.
[29]Tran H T, Hurley B A, Plaxton W C. Feeding hungry plants: the role of purple acid phosphatases in phosphate nutrition[J]. Plant Science, 2010, 179: 14-27.
[30]Liu P, Cai Z, Chen Z, et al. A root-associated purple acid phosphatase, SgPAP23, mediates extracellular phytate-P utilization in Stylosanthes guianensis[J]. Plant, Cell & Environment, 2018, 41: 2821–2834.

