脂肪干细胞抑制UVB诱导的细胞外基质降解的机制研究
马旭 杨大平 刘国锋 公美华 李宁 李春阳 张攀

[摘要]目的:细胞微环境在调控细胞定位、细胞行为和细胞分化等方面发挥重要作用。细胞外基质(Etracellular matrix,ECM)在塑造干细胞微环境中起着最关键的作用,与上皮干细胞接触,调节干细胞命运,其中整合素和胶原蛋白在干细胞的调节和维持中发挥重要作用。本研究中,笔者假设UVB照射通过改变ECM诱导皮肤光老化,并且应用脂肪干细胞(Adipose derived stem cells,ADSCs)可以逆转光老化。方法:将C57BL/6J小鼠作为研究对象,分为对照组、UVB组和UVB+ADSCs组。采用HE和Masson染色鉴定各组的组织学差异,应用免疫荧光分析和RT-PCR技术检测三组间ECM组分表达的差异性。评估整合素α2(Integrinα2),增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA),抗凋亡蛋白Bcl-2在各组的表达情况。结果:HE和Masson染色结果显示UVB照射明显增加表皮厚度,应用ADSCs后表皮厚度与对照组接近。UVB组整合素α2、胶原蛋白Ⅲ和抗凋亡蛋白Bcl-2的表达水平均低于对照组,而UVB+ADSCs组各因子表达高于UVB组,与对照组接近(P<0.05)。基质金属蛋白酶2(Matrix metalloproteinase 2,MMP 2)、基質金属蛋白酶9(Matrix metalloproteinase 9,MMP 9)和PCNA的表达趋势与上述相反。结论:笔者发现UVB照射通过改变ECM而导致典型的光老化征象,并且UVB抑制抗凋亡蛋白Bcl-2的表达和整合素α2的表达。Bcl-2和整合素α2有望成为抑制光老化的作用因子。
[关键词]光老化;UVB;脂肪干细胞;细胞外基质;Bcl-2;整合素α2
[中图分类号]R329.2+8 [文献标志码]A [文章编号]1008-6455(2019)06-0067-06
Abstract: Objective The stem cell microenvironment plays an essential role in regulating cell localization, cell behavior and cell differentiation. Extracellular matrix (ECM) plays a key role in shaping the stem cell microenvironment, and ECM contacts with epithelial stem cells which regulates the fate of stem cells. And integrins and collagens play an important role in stem cell regulation and maintenance of stemness. In our study, we hypothesized that UVB irradiation induces skin photoaging by altering ECM, and the transplantation of adipose stem cells (ADSCs) can reverse photoaging. Methods C57BL/6J mice were used to establish photoaging model, and were divided into control group, UVB group and UVB+ADSCs group. The histological differences of each group were identified by HE and Masson staining. The differences of ECM components expression among the three groups were detected by immunofluorescence analysis and RT-PCR. And the expression of integrin α2, proliferating cell nuclear antigen (PCNA) and anti-apoptotic protein Bcl-2 were also evaluated. Results HE and Masson staining showed that UVB irradiation significantly increased the thickness of the epidermis, and after ADSCs transplanted, the thickness of the epidermis was similar to that of the control group. The expression levels of Integrin α2, collagen Ⅲ and Bcl-2 in the UVB group were lower than those in the control group, while the expression of each factor in the UVB+ADSCs group was close to the control group (P<0.05). The expression trends of MMP 2, MMP 9 and PCNA are opposite to those described above. Conclusion We found that UVB irradiation leads to typical signs of photoaging by altering ECM, and UVB inhibits the expression of the anti-apoptotic protein Bcl-2 and Integrin α2. Bcl-2 and Integrin α2 are expected to act as inhibitors of photoaging.
Key words: photoaging; UVB; adipose derived stem cells; extracellular matrix; Bcl-2; Integrin α2
细胞微环境主要由结构性因素和生化因素两方面组成,结构性因素包括细胞外基质结构与力学特征,生化因素包括细胞外基质黏附因子与游离的细胞因子等[1-2]。间充质干细胞的治疗作用可因其分化和转分化为组织特异性细胞,与原位细胞融合,分泌大量旁分泌因子以刺激原位细胞的存活和功能恢复,或调节局部微环境和免疫应答等。这些机制可能是独立的,但不是互斥的。在许多情况下,这些保护机制的组合可能共同影响皮肤创伤修复功能[3]。
光老化皮肤的真皮组织特征是细胞外基质(ECM)的降解和紊乱[4]。基质金属蛋白酶(MMPs)是一种具有广泛底物特异性的含锌肽链内切酶。这些酶能够降解细胞外基质的各种成分。MMPs对ECM的改变可能导致皮肤皱褶,这是早衰皮肤老化的一个特征。在光致癌中,ECM的降解是肿瘤细胞侵袭的最初步骤,它侵袭基底膜和周围基质,其中基质主要包括纤维状胶原[5]。紫外线通过干扰TGFβ/Smad途径抑制I型胶原的合成,通过释放促炎因子/免疫抑制性细胞因子激活基质金属蛋白酶,并通过改变胶原和整合素之间的结合能力来调节细胞骨架的组织[4]。
既往对毛囊发育、生长的生理微环境(Niche)了解不多,特别是对皮肤干细胞所处微环境三维结构、ECM的组成和拓扑结构改变以及Niche的免疫微环境等认识不足,对其与毛囊发育、生长、修复和再生的关系缺乏了解。细胞微环境在调控细胞定位、细胞行为和分化等方面发挥重要作用[6]。ECM在塑造干细胞Niche中起最关键作用,与上皮干细胞接触,调节干细胞命运,其中integrins和Collagens在干细胞的调节和维持干性中发挥重要作用。皮肤干细胞Niche是皮肤组织中的一个特殊结构,主要由位于表皮基底层的滤泡间表皮干细胞群(IFE-SCs)和位于毛囊的毛囊干细胞群(HF-SCs)组成。在正常的生理条件下,皮肤干细胞Niche处于稳定平衡状态,能不断自我更新和分化为角质形成细胞,维持表皮产能的完整性、对抗外界的各种损伤。在皮肤损伤愈合过程中,这些干细胞Niche被激活,IFE-SCs增殖加速,分化為短暂扩增细胞核角质形成细胞,HF-SCs也活化增殖,并沿毛囊峡部上移至表皮中,参与组织修复。表明皮肤再生过程中,皮肤干细胞Niche的功能决定了干细胞的状态。
本研究中,笔者假设UVB照射通过改变ECM诱导皮肤光老化,并且应用脂肪干细胞(ADSCs)可以逆转光老化。现报道如下。
1 材料和方法
1.1 动物材料:动物实验方案经哈尔滨医科大学第二医院机构动物护理和使用委员会批准。所有实验均根据哈尔滨医科大学第二医院动物实验指南进行。C57BL/6J小鼠购自哈尔滨医科大学第二医院动物实验中心。将所有小鼠饲养在(24±2)℃和50%湿度的空调房间中,具有12h光/12h暗循环。允许所有小鼠自由获取水和食物。
1.2 建立光老化模型和分组:将64只雌性C57BL/6J小鼠分为三组:对照组:正常小鼠,皮下注射0.5ml PBS;UVB组:暴露于UVB下并注射0.5ml PBS;UVB+ADSCs组:暴露于UVB并注射含有5×106个 ADSC的0.5ml PBS。UVB组及UVB+ADSC组接受照射。用电动剃刀每周一次取出小鼠背部毛发,将小鼠暴露于UVB灯下(波长290~320nm,峰值波长312nm,TL20W/12;Philips,Eindhoven,荷兰)。在暴露期间,允许小鼠在盒子内自由移动,灯管和盒子底部之间距离为25cm。UVB暴露每周5次,持续8周。第1~2周:剂量为60mJ/cm2;第3周,剂量为120mJ/cm2;第4周剂量为180mJ/cm2;第5~8周剂量为240mJ/cm2,共接受6.9J/cm2 UVB照射剂量。
1.3 ADSCs培养及鉴定:从7日龄C57BL/6J小鼠的皮下获得脂肪组织。PBS洗涤组织后用0.1% I型胶原酶(Worthington,Lakewood,NJ,USA)在37℃水浴箱中持续振荡消化45min。将组织以1 200rpm离心10min,弃去上方悬浮物。获得ADSCs并置于含有10%胎牛血清(Invitrogen-Gibco,Grand Island,NY,USA)和1%抗生素/抗真菌剂(Welgene Inc,Daegu,Korea)的DMEM培养基中,于37℃,5% CO2培养箱中培养。
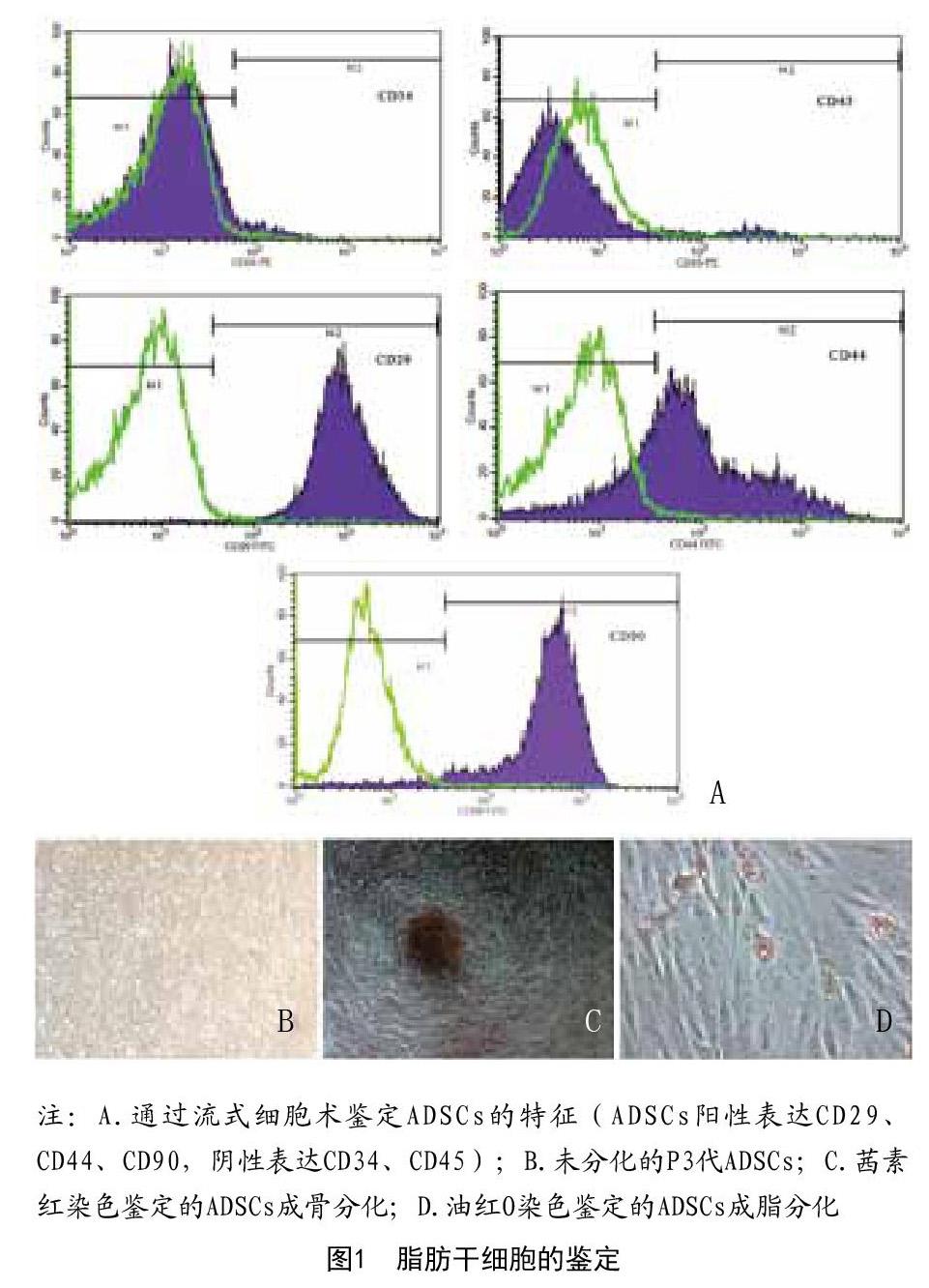
采用荧光激活细胞分选(FACS)技术检测第3代ADSCs表面标志物CD29、CD34、CD44、CD45、CD90的表达。将细胞再次悬浮在PBS中,然后与抗小鼠异硫氰酸荧光素(FITC)标记的CD29(1:200;bs-0486R-FITC;Bioss Inc.,Woburn,MA,USA),CD34(1:200;bs-2038R-FITC;Bioss Inc.),CD44(1:200;bs-2507R-FITC;Bioss Inc.),CD45(1:200;bs-10599R-FITC;Bioss Inc.),CD90(1:200;bs-0778R-FITC;Bioss Inc.)在4℃孵育30min。以FITC标记的免疫球蛋白(IgG)染色细胞作为阴性对照。使用FACScan流式细胞仪(BD Facs Vantage SE;BD Biosciences,Franklin Lakes,NJ,USA)对细胞进行分析。数据由CellQuest Pro软件(BD Biosciences)处理。
通过脂肪分化试剂盒(MesenCultTM Adipogenic Stimulatory Supplement,05503,Stem Cell Technologies,Canada)和成骨分化试剂盒(MesenCultTM Stimulatory Kit,05504,Stem Cell Technologies,Canada)评估ADSCs分化成脂肪细胞和成骨细胞的能力。分化3周后,油红O和茜素红S分别用于评估ADSCs成脂分化和成骨分化情况。
1.4 ADSCs皮下移植及获取组织样本:将5×106个ADSCs悬浮在0.5ml PBS中,用30号针头注射到UVB+ADSCs组照射区域(1cm×1cm)的小鼠背部皮肤的皮内和皮下层。通过相同的方法向对照组和UVB组注射等体积的PBS。间隔14d进行第2次注射。在最后一次ADSCs移植后2周通过过量吸入麻醉剂处死所有小鼠。从各组小鼠背部注射部位获得皮肤样品(1cm×1cm)。
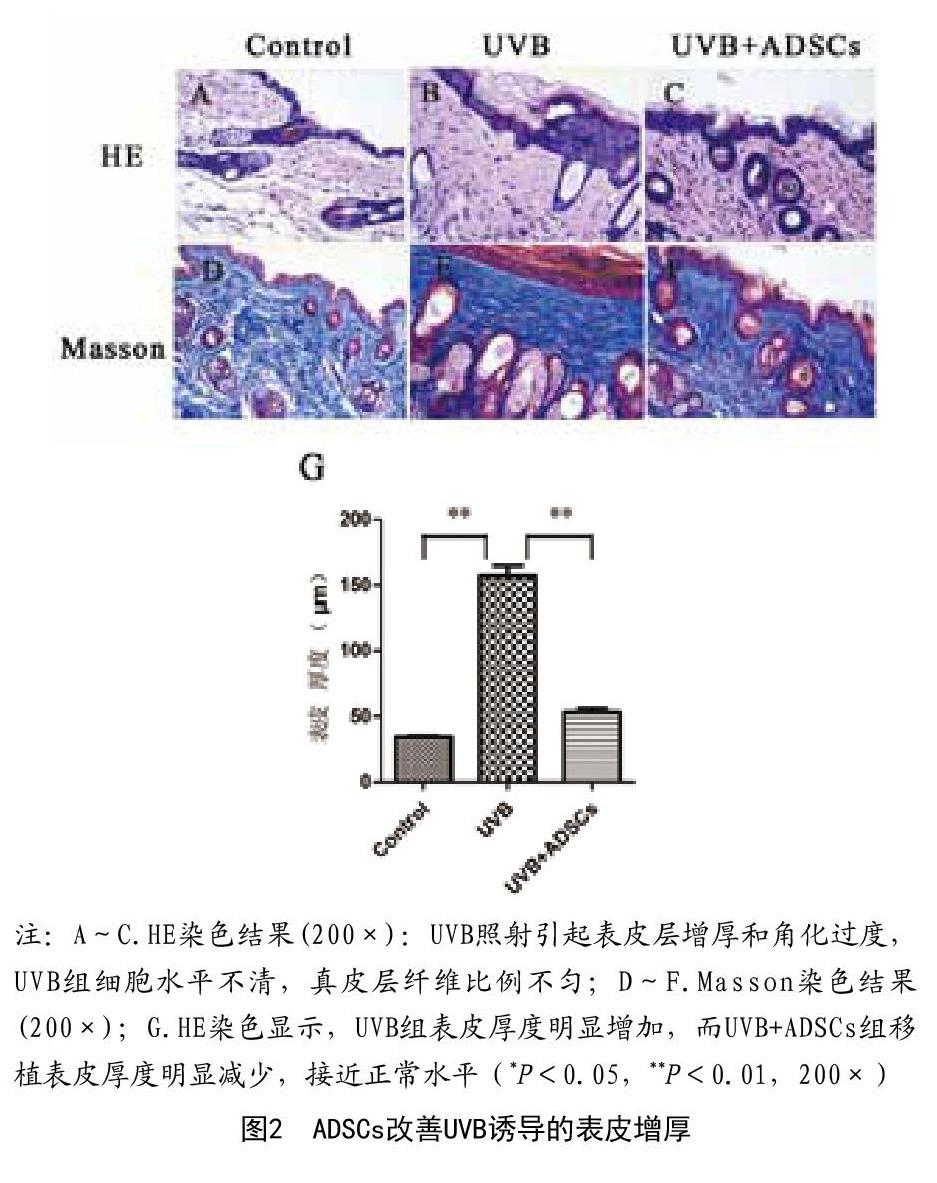
1.5 HE和Mason染色:皮肤样本经过固定和石蜡包埋后,三组皮肤切片接受HE和Masson染色。每个HE染色的切片上选择5个位置测量表皮厚度,并比较平均值。通过Masson三色染色检测各组真皮胶原密度。
1.6 免疫荧光分析:将皮肤样品切片用20%蔗糖脱水6h,然后用30%蔗糖脱水过夜。将脱水样品包埋在最佳切割温度的化合物(Sakura Finetechnical Co.,Ltd.,Tokyo,Japan)中。将嵌入的样品在-80℃冰箱中冷冻。将冷冻的皮肤样品切成6mm厚的切片。将切片在PBS中浸泡5min,用Triton X-100处理10min,用3% BSA封闭30min,然后在4℃下用适当稀释的原代兔单克隆抗体孵育过夜:胶原蛋白 Ⅲ(1:50,ab7778,Abcam),整合素α2 (1:100,ab181548,Abcam)。用PBS洗涤3次后,将皮肤样品与第二抗体DyLight 488 AffiniPure Goat Anti-Rabbit IgG(H+L)(A23220,Abbkine,China)在37℃温育1h。细胞核用DAPI(C1002,Beyotime,中国)染色并用甘油封闭。使用共聚焦显微镜分析结果。
1.7 实时聚合酶链反应(RT-PCR):使用Trizol(Roche,Switzerland)提取总RNA并用分光光度法定量。基于GAPDH水平的表达,通过RT-PCR进行相关基因Bcl-2,PCNA,MMP 2,MMP 9的表达定量(见表1)。使用PrimeScript RT试剂盒(Roche,Switzerland),将5μg总RNA在55℃下30min,并在85℃下5min进行第一链cDNA合成。在具有StepOnePlusTM(ABI,USA)的ABI PRISM 7500序列检测系统上进行实时PCR擴增。PCR程序如下:95℃10min,95℃ 15s和60℃ 60s,进行40个循环。使用2-△△Ct方法计算靶基因的相对表达水平,并确定比对照中表达的倍数增加。所有反应至少重复3次。
1.8 统计学分析:应用单因素方差分析(ANOVA)进行实验数据分析。当ANOVA显示组间差异时,使用Dunnett't进行两两比较。统计数据以(x?±s)表示。P<0.05表示差异有统计学意义。
2 结果
2.1 脂肪干细胞鉴定:流式细胞仪检测结果显示ADSCs阳性表达CD29、CD45、CD90,阴性表达CD34、CD45(见图1A)。为了评价ADSCs的分化潜能,笔者诱导ADSCs分化为油红O鉴定的成脂分化、茜素红S鉴定成骨分化(见图1B~D)。染色结果显示ADSCs具有多向分化潜能。
2.2 HE和Masson染色结果:用HE和马松三色染色法测定皮肤厚度和胶原纤维。HE染色结果:UVB照射引起表皮层增厚和角化过度,细胞水平不清楚,真皮层纤维比例不匀。与UVB组相比,UVB+ADSCs组表皮厚度明显降低,接近正常水平(P<0.05)。Masson染色结果:UVB照射后网状真皮胶原明显丢失,应用ADSCs后在真皮网状组织中胶原密度增加(见图2)。这些结果表明ADSCs可以改善UVB照射引起的表皮增厚。
2.3 ADSCs抑制UVB诱导的ECM降解:免疫荧光分析显示,UVB照射可降低胶原蛋白Ⅲ(Collagen Ⅲ)和整合素α2(Integrin α2)的表达,ADSCs增加胶原蛋白Ⅲ和整合素α2的表达(P<0.05)。见图3。
2.4 ADSCs抑制UVB诱导的基质金属蛋白酶过表达及皮肤细胞异常增殖、凋亡:RT-PCR结果显示UVB照射增加了胶原降解酶MMP 2和MMP 9的表达,ADSCs移植降低UVB诱导的MMP 2和MMP 9过表达(P<0.05)(见图4A~B)。RT-PCR结果显示UVB照射增加了增殖细胞核抗原PCNA的表达,ADSCs移植降低UVB诱导的PCNA过表达(P<0.05)(见图4C)。UVB照射可降低抗凋亡蛋白Bcl-2的表达,ADSCs增加Bcl-2的表达(P<0.05)(见图4D)。
3 讨论
再生医学是使用机体自身干细胞和生长因子进行组织修复,是一种修复受损组织的替代治疗策略,成为细胞治疗的主要候选。脂肪干细胞是具有多向分化潜能的间充质干细胞,具有类似于骨髓间充质干细胞的特性。此外,与骨髓-间充质干细胞相比,脂肪干细胞可以通过简单的外科手术大量获取。脂肪间充质干细胞在临床上已有较多应用,包括皮肤缺损及创面愈合。研究表明,ADSCs在伤口愈合过程中可刺激胶原蛋白的合成与迁移。ADSCs及其分泌因子,如血小板衍生生长因子(platelet-derived growth factor,PDGF)、β成纤维生长因子(fibroblast growth factor,β-FGF)、转化生长因子β(transforming growth factor β,TGF-β)、肝细胞生长因子(hepatocyte growth factor,HGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)等在皮肤老化治疗中具有广泛的应用前景[7]。
内源性老化的主要组织学特点是真皮和表皮交界处变平,真皮和皮下脂肪层变薄,角质形成细胞、朗汉斯细胞、肥大细胞、黑素细胞数量减少。光老化皮肤特点为表皮厚度不均,朗汉斯细胞进一步减少,而黑素细胞数量增加。光老化诱导最明显的变化是显著的真皮弹性组织变性及局部炎症浸润。紫外线(UV)辐射,特别是UVB(280~320nm),是造成皮肤损伤的主要环境灾害之一。紫外线照射可引起水肿、红斑、色素沉着、增生、老化、炎症、皮肤的DNA损伤和突变。此外,流行病学研究报告指出,长期暴露于紫外线辐射皮肤癌的风险增加[8-10]。
位于表皮及毛囊的干细胞,作用是确保成人皮膚动态更新及毛囊再生,同时参与创伤后的修复过程。中胚层来源的干细胞有助于以下组织细胞的形成,如分泌胶原蛋白的真皮成纤维细胞、为皮肤提供养分的真皮血管、附着在每个毛囊(HF)的立毛肌、皮下脂肪细胞及浸润在皮肤中的免疫细胞。神经嵴来源的干细胞有助于黑素细胞及皮肤感觉神经末梢,和真皮乳头的形成。凋亡调节基因的表达与衰老伴行的是Bcl-2[11-12]。Bcl-2蛋白家族是调控线粒体依赖性凋亡途径的蛋白家族,包括抗凋亡蛋白和促凋亡蛋白,如Bcl-2和Bax[11]。Bcl-2起着抑制凋亡的作用,在不利于抗凋亡的衰老细胞中培养,Bcl-2也不会被抑制。UVB照射后Bcl-2表达降低,应用ADSCs后Bcl-2表达增加。为了研究UVB对细胞生长的影响,测定各组样本中PCNA的表达水平[8]。PCNA过表达提示细胞增殖能力增强,表明UVB照射后表皮细胞的增殖增强。这可能说明UVB诱导皮肤干细胞异常增殖和凋亡,而ADSCs可以调节皮肤干细胞的异常增殖和凋亡。
胶原、层粘连蛋白、纤粘连蛋白、弹性蛋白和糖胺聚糖,为调节细胞-细胞或细胞-基质诱导的干细胞分泌的可溶性信号,刺激干细胞分化以及调节各种细胞反应。除生态位信号外,细胞外基质成分参与创伤愈合过程中的每一个阶段,从止血到重塑,是细胞和生长因子之间相互作用的一个动态过程。例如,细胞外基质成分(如胶原I、III、IV、层粘连蛋白和纤维连接蛋白,GAGs)和各种生长因子[如PDGF、TGF-β、表皮生长因子、成纤维细胞生长因子(FGF)、角质细胞生长因子(KGF),IGF-1,和HGF]吸收干细胞、巨噬细胞、成纤维细胞和内皮细胞到伤口部位,调节上皮化及胶原蛋白的积累和血管生成。Kim EJ等证实来自于毛囊干细胞的旁分泌信号(如TGF-β、β-FGF、VEGF)和内源性生长因子(如HGF、PDGF-BB、 EGF、IGF、VEGF)在提高创面愈合质量方面似乎具有协同作用:促进肉芽组织形成、再上皮化和新生血管生成[13]。在真皮胶原降解中,主要是基质金属蛋白酶(MMP)1,3和9。MMPs水平升高是适应紫外线照射和真皮老化过程的一个普遍现象[14]。真皮成纤维细胞与细胞外胶原纤维相互作用产生机械阻力,进而导致信号转导级联,从而调节跨膜和细胞内结构、基因表达和蛋白质合成。成纤维细胞与周围胶原之间的通讯是通过整合素跨膜受体介导的,其中Integrin α2和肌动蛋白细胞骨架,主要是α-SMA[15]。整合素是介导细胞外基质(ECM)粘附的一大类细胞受体,具有调节细胞增殖、迁移、恶性转化和侵袭的各种细胞功能。越来越多的证据表明,整合素受体可以感知肿瘤基质组成、形态和张力的变化,从而调节细胞内信号转导事件,有助于促进癌症进展[16]。在光老化皮肤中,胶原纤维的断裂和分解是由于成纤维细胞功能受损,包括MMP的上调,而α-SMA和整合素α2的表达上调成纤维细胞的收缩活性,促进胶原的晶格结构[15]。笔者发现UVB照射下调整合素α2和胶原蛋白Ⅲ的表达,应用ADSCs后其表达增加。
皮肤暴露于紫外线照射引起的几个不同的MMPs上调,实际上损害了ECM的各个组成部分。这些变化在细胞外基质是已知的,是导致皮肤皱纹及过早老化的一个主要特征。在光致癌中,ECM的降解是肿瘤细胞侵袭的第一步,侵入由胶原纤维组成的基质和基底膜[17]。此外,MMPs参与血管胶原蛋白Ⅲ的降解,促进肿瘤细胞的生长和迁移。调节MMPs的分泌是防止光损伤导致皮肤皱纹形成的策略之一。MMPs在肿瘤的发生发展、生长、血管生成和转移中起着重要的作用。这些蛋白酶有特定的角色,以确定肿瘤的侵袭能力[18-19]。真皮中,纤维形成胶原(Ⅰ型和Ⅲ型)是ECM的主要成分[20]。IV型胶原酶MMP 2和MMP 9抑制了脱毛后的毛发再生,同时伴有VEGF、IGF-1和TGF-β表达的降低。MMPs的活性是由其特异性抑制剂调节的,称为金属蛋白酶组织抑制剂(TIMPs)。TIMP-2和TIMP-1分别特异性地抑制MMP 2和MMP 9的活性,这可能是调节毛囊的关键。事实上,MMP 2和MMP 9表达水平的波动发生在整个毛发生长周期中。MMP 2和金属蛋白酶组织抑制剂2(TIMP-2)在毛囊各组织中均有表达,提示MMP 2在HF毛发生长周期中可能起重要作用[20]。笔者发现UVB照射诱导MMP 2和MMP 9过表达,应用ADSCs后MMP 2和MMP 9表达降低。
4 结论
笔者研究发现UVB照射通过改变ECM而导致典型的光老化征象,ADSCs可以逆转UVB诱导的光老化,并且UVB可抑制抗凋亡蛋白Bcl-2和整合素α2的表达。Bcl-2和整合素α2有望成为抑制光老化的作用因子。
[参考文献]
[1]Ge Y,Gomez NC,Adam RC,et al.Stem cell lineage infidelity drives wound repair and cancer[J].Cell,2017,169(4):636-650.
[2]Keyes BE,Liu S,Asare A,et al.Impaired epidermal to dendritic T cell signaling slows wound repair in aged skin[J].Cell,2016,167(5):1323-1338.
[3]Li H,Fu X.Mechanisms of action of mesenchymal stem cells in cutaneous wound repair and regeneration[J].Cell Tissue Res,2012,348(3):371-377.
[4]Nakyai W,Tissot M,Humbert P,et al.Effects of repeated UVA irradiation on human skin fibroblasts embedded in 3D tense collagen matrix[J].Photochem Photobiol,2018,94(4):715-724.
[5]Pittayapruek P,Meephansan J,Prapapan O,et al.Role of matrix metalloproteinases in photoaging and photocarcinogenesis[J].Int J Mol Sci,2016,17(6).pii:E868.
[6]Bissell MJ,Labarge MA.Context,tissue plasticity, and cancer:are tumor stem cells also regulated by the microenvironment?[J]Cancer Cell,2005,7(1):17-23.
[7]Park BS,Jang KA,Sung JH,et al.Adipose-derived stem cells and their secretory factors as a promising therapy for skin aging[J].Dermatol Surg,2008,34(10):1323-1326.
[8]Fang JY,Wang PW,Huang CH,et al.Skin aging caused by intrinsic or extrinsic processes characterized with functional proteomics[J].Proteomics,2016,16(20):2718-2731.
[9]Kim W,Kim E,Yang HJ,et al.Inhibition of hedgehog signalling attenuates UVB-induced skin photoageing[J].Exp Dermatol,2015,24(8):611-617.
[10]Huang CC,Hsu BY,Wu NL,et al.Anti-photoaging effects of soy isoflavone extract (aglycone and acetylglucoside form) from soybean cake[J].Int J Mol Sci,2010,11(12):4782-4795.
[11]Zhou F,Huang X,Pan Y,et al.Resveratrol protects HaCaT cells from ultraviolet B-induced photoaging via upregulation of HSP27 and modulation of mitochondrial caspase-dependent apoptotic pathway[J].Biochem Biophys Res Commun,2018,499(3):662-668.
[12]Haake AR,Roublevskaia I,Cooklis M.Apoptosis:a role in skin aging?[J]J Investig Dermatol Symp Proc,1998,3(1):28-35.
[13]Kim EJ,Choi JS,Kim JS,et al.Injectable and thermosensitive soluble extracellular matrix and methylcellulose hydrogels for stem cell delivery in skin wounds[J].Biomacromolecules,2016,17(1):4-11.
[14]R?ck K,Joosse SA,Müller J,et al.Chronic UVB-irradiation actuates perpetuated dermal matrix remodeling in female mice:protective role of estrogen[J].Sci Rep,2016,27(6):30482.
[15]Jokinen J,Dadu E,Nykvist P,et al.Integrin-mediated cell adhesion to type I collagen fibrils[J].J Biol Chem,2004,279(30):31956-31963.
[16]L?ffek S,Franzke CW,Helfrich I.Tension in cancer[J].Int J Mol Sci,2016,17(11):1910.
[17]Blanpain C,Fuchs E.Epidermal homeostasis:a balancing act of stem cells in the skin[J].Nat Rev Mol Cell Biol,2009,10(3):207-217.
[18]Pittayapruek P,Meephansan J,Prapapan O,et al.Role of matrix metalloproteinases in photoaging and photocarcinogenesis[J].Int J Mol Sci,2016,17(6):pii:E868.
[19]Jung H,Lee EH,Lee TH,et al.The Methoxyflavonoid isosakuranetin suppresses UV-B-induced matrix metalloproteinase-1 expression and collagen degradation relevant for skin photoaging[J].Int J Mol Sci,2016,17(9):1449.
[20]Chermnykh E,Kalabusheva E,Vorotelyak E.Extracellular matrix as a regulator of epidermal stem cell fate[J].Int J Mol Sci,2018,19(4):1003.
[收稿日期]2019-03-21
本文引用格式:馬旭,杨大平,刘国锋,等.脂肪干细胞抑制UVB诱导的细胞外基质降解的机制研究[J].中国美容医学,2019,28(6):67-72.

