MRI T1WI在子宫肌瘤高强度聚焦超声治疗前后评价中的应用
王晓玲,邬颖华,秦天鹏,黄 娟,陈淑君
(1.四川省德阳市人民医院放射科,妇科,四川 德阳 618000;2.成都中医药大学护理学院,四川 成都 610000)
高强度聚焦超声(high intensity focused ultrasound,HIFU)是新兴的肿瘤微创治疗技术。因其操作简便、快速、微创、并发症及不良反应少等,逐渐受到临床关注,成为近年多学科临床研究的重点和热点[1-2]。该技术已广泛应用于临床子宫肌瘤的治疗,在保留子宫生理功能、提高患者生活质量方面明显优于传统手术治疗。MRI具有软组织分辨力高、多参数、多方位成像的优势,已成为目前盆腔病变的最佳影像学检查方法。本研究拟利用3.0 T MRI T1WI评估子宫肌瘤HIFU治疗的疗效。
1 资料与方法
1.1 一般资料 收集2017年5—8月因子宫肌瘤于德阳市人民医院行HIFU治疗的连续患者31例(36个肌瘤),年龄 30~62 岁,平均(44.0±5.8)岁。 多无症状(20例),少数因经期延长和(或)经量增多(8例),下腹部胀痛(3例)。纳入标准:因体检或有子宫肌瘤相关临床表现而行彩色超声诊断子宫肌瘤;拟行HIFU治疗的患者;于术前、术后1~3 d内行MRI平扫及增强扫描。排除标准:合并子宫腺肌症;图像质量不能满足观察、测量者。
1.2 仪器与方法
1.2.1 检查方法 采用Philips 3.0 T超导MRI仪。术前扫描序列:TSE T1WI轴位、矢状位,T1WI压脂轴位,T2WI压脂轴位,TSE T2WI矢状位。术后序列:T1WI平扫及增强扫描。采用mDIXON-W-DYN+C动态增强扫描序列行薄层容积增强扫描。对比剂采用Gd-DTPA注射液,剂量 20 mL,流率 2 mL/s。选取T1WI压脂及T1WI增强扫描序列,测量子宫肌瘤及肌壁术前及术后消融区的信号变化;确定子宫肌瘤ROI:选肌瘤最大截面,勾画肌瘤消融区术前、术后边缘;肌壁ROI选正常肌壁区,尽量远离肌瘤,避开结合带,范围尽量大;均测量3次,取平均值。术前、术后肌瘤及肌壁ROI选取相同层面、相同面积。计算信号强度比(signal intensity ratio,SIR)=X1/X2。 X1即子宫肌瘤平均信号值,X2即肌壁平均信号值。
于矢状位平行子宫内膜方向测量肌瘤及术后无灌注区的最大长径(a),垂直于长径测量最大前后径(b),横断位测量最大左右径(c)。计算子宫肌瘤及术后无灌注区体积(non-perfused volume,NPV),体积(cm3)=πabc/6,计算消融率(消融率 =NPV/治疗前肌瘤体积×100%)。
1.2.2 HIFU治疗 采用HIFU JC200D型聚焦超声肿瘤治疗系统(重庆海扶医疗科技股份有限公司)行HIFU治疗。术中先准确定位肌瘤,根据不同层面靶区的形状,逐点逐层完成对肌瘤的适形性消融治疗,全过程镇静、镇痛。术中采用超声灰度变化及超声造影判断疗效。术后予以对症处理。
1.3 图像分析及数据采集 由2名工作经验5年以上的腹部MRI诊断医师,按统一的流程和标准盲法观察图像并测量数据。意见不一致时,经协商达成一致意见。观察子宫肌瘤的大小、形态、边界、位置及MRI信号特点等。
1.4 统计学分析 采用SPSS 17.0统计学软件,检验水准a=0.05。计量资料用±s表示。术前术后肌瘤消融区T1WI平扫、增强 SIR值比较分别采用配对t检验、Wilcoxon符号秩检验。以P<0.05为差异有统计学意义。
2 结果
31例,共36个肌瘤,最大径2.6~11.2 cm,平均(5.2±1.7)cm。
2.1 子宫肌瘤治疗前后信号及强化特点 术前T1WI:31 个肌瘤(86.1%)呈等信号(图1a,1b),4 个(11.1%)呈稍高信号,1 例(2.8%)呈稍低信号;T2WI以低信号为主(27 个,75.0%)(图1c);增强扫描:11个(30.6%)较肌壁呈相对高强化,12个(33.3%)呈等强化,13个(36.1%)呈相对低强化(图1d)。术后T1WI:肌瘤消融区信号不同程度升高(图1e);增强扫描消融区无强化(图1f)。
2.2 治疗前后肌瘤体积与SIR的变化(表1) 36个子宫肌瘤HIFU治疗均成功,术前平均体积(82.40±85.96)cm3,术后无灌注区平均体积(55.00±43.00)cm3,消融率平均达(89.11±26.16)%。术前、术后子宫肌瘤消融区T1WI平扫及增强扫描SIR值差异均有统计学意义(均 P<0.05)。
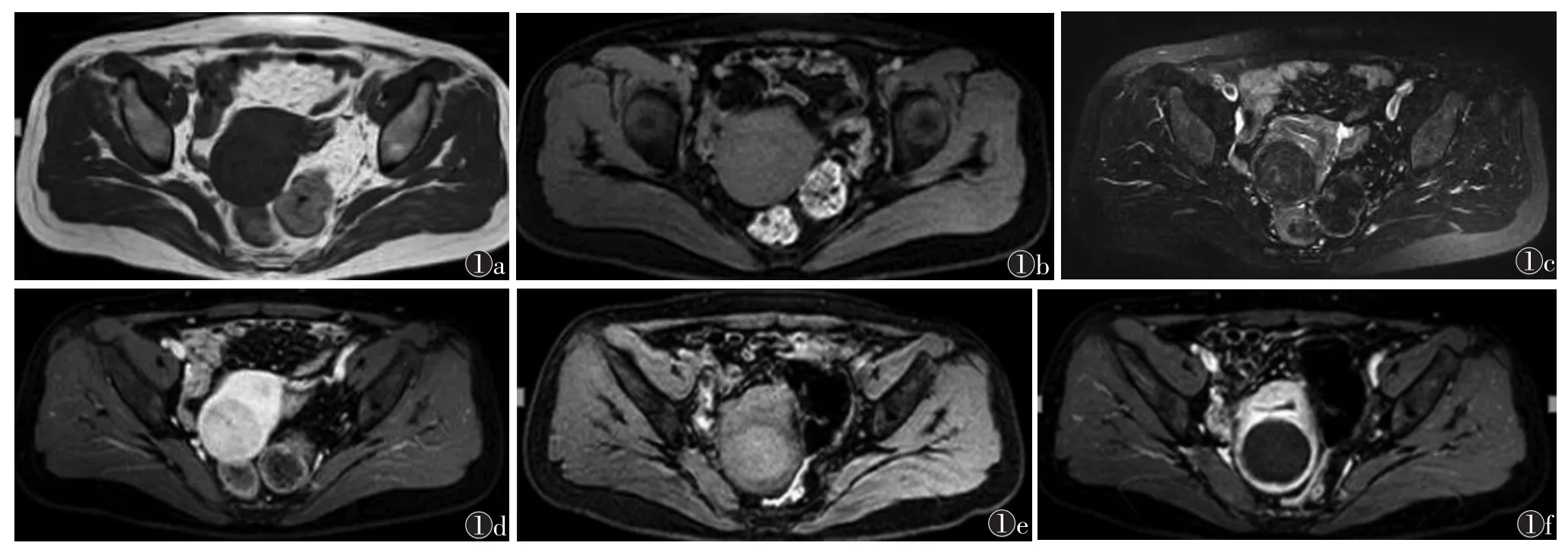
图1 女,47岁,子宫肌瘤 图1a~1d 分别为术前T1WI、T1WI压脂、T2WI压脂及T1WI增强扫描压脂图像,示高强度聚焦超声(HIFU)术前肌瘤呈T1WI等信号,T2WI不均匀低信号,增强扫描较明显强化 图1e,1f 分别为术后T1WI压脂及T1WI增强扫描压脂图像,示肌瘤HIFU术后T1WI呈高信号,增强扫描消融区无强化
3 讨论
临床多以微创治疗子宫肌瘤,以确保子宫生理功能。单纯肌瘤剥除术后复发率达50%,约1/3需再次手术,子宫切除术后会引起卵巢功能降低[3-4]。子宫动脉期栓塞术疗效确切,但目前无充分证据表明其可常规用于需保留生育功能的患者[5]。HIFU利用超声波的穿透性及聚焦性,使所选定体内靶区产生瞬间高温致蛋白质变性、组织凝固性坏死,并破坏小血管,进而局部热切除肿瘤;肿瘤邻近组织及超声波所穿过组织区因温度仅轻度上升而无明显损伤[6-7],达到微创且保留子宫的目的,且不影响患者妊娠[8]。
表1 术前术后肌瘤消融区T1WI平扫、增强扫描SIR值及比较 (±s)

表1 术前术后肌瘤消融区T1WI平扫、增强扫描SIR值及比较 (±s)
注:SIR,信号强度比。
扫描序列 术前 术后 P值T1WI平扫 1.05±0.11 1.19±0.12 0.00 T1WI增强扫描 0.98±0.13 0.33±0.07 0.00
术后疗效评估常采用彩色多普勒超声及MRI,超声易受气体及检查者主观影响。MRI软组织分辨力高,无辐射,能全面、准确、直观、敏感地显示子宫肌瘤术前、术后信号特点及变化,是评估HIFU术后疗效的有效、客观手段。术后应早期测量肌瘤无强化区,计算消融率,评估其早期疗效;随访复查无血供区的体积变化以评估其远期疗效。DWI在疗效评估方面存在争议[9]。 术后 T2WI可呈高、等、低信号,且治疗后信号变化不定,无法明确显示消融区及坏死区的边界[1,10]。 因此,本研究采用 T1WI平扫及增强扫描进行评估。由于MRI信号值易受其他因素影响,2次MRI扫描信号值差异大,故本次术前、术后比较采用SIR值。
子宫肌瘤术前、术后形态结构、组织、细胞成分的变化导致肌瘤信号及强化程度改变。本组肌瘤术前T1WI以等信号为主,术后均出现无灌注区,消融区T1WI平扫信号不同程度升高,以中心区明显,相对于肌壁呈不同程度高信号,SIR值较术前增高,差异有统计学意义(P< 0.05),与既往研究[11]一致,可能与肌瘤蛋白质变性、水分丢失、微血管破坏、微血栓形成缩短 T1弛豫时间有关[1]。 相关研究[1]表明,术后早期T1WI高信号区范围小于无强化区(可能与术后早期肌瘤未完全坏死有关),但两者有高度相关性,故认为其可反映坏死区。在术后随访中,相关研究[12]显示,T1WI高信号区与无强化区范围无明显差异。因此,T1WI平扫对HIFU术后疗效评估有重要价值,尤其是远期疗效,术后早期可准确评估坏死区范围。
本组肌瘤术后均出现消融区,其SIR值较术前明显减低,差异有统计学意义(P<0.05),术后消融区无血供。有研究者[2]于HIFU治疗后立即行MRI增强扫描,结果显示肌瘤内无强化区域与组织病理学检查所测得坏死范围基本一致,因而证明MRI增强扫描可准确评价HIFU治疗子宫肌瘤早期疗效。因此,MRI可作为评估子宫肌瘤HIFU术后早期疗效的无创性手段,早期准确判断坏死区范围,较长期随访观察更快捷、方便。
术后消融率与肌瘤的体积缩小程度、症状的改善呈正相关[6],且与肌瘤症状严重程度评分的改善呈正相关[13]。 本组肌瘤术前平均体积(82.40±85.96)cm3,术后无灌注区平均体积(55.00±43.00)cm3,消融率平均达(89.11±26.16)%,较既往部分研究[1]平均消融率稍高,但是本组资料消融率变化范围大,34%~151%,部分患者消融率低,可能与肌瘤的性质、位置及大小等有关,但症状均得到不同程度改善。
综上所述,常规MRI T1WI及增强扫描可作为评价子宫肌瘤HIFU的有效手段。术前常规MRI序列、术后T1WI平扫及增强扫描序列能满足临床及患者基本需求,较其他序列简便、快速、节约资源。但也存在一些不足,对更细微的组织、细胞结构及功能变化有待采用分子及fMRI进一步研究。

