皮肤自发荧光(SAF)与中国2型糖尿病患者周围神经病变(DPN)的相关性
张 琦 乔小娜 伊 娜 郑杭萍 刘思颖 熊 茜 张 烁 刘晓霞 李益明 鹿 斌
(复旦大学附属华山医院内分泌科-复旦大学内分泌糖尿病研究所 上海 200040)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是最常见的糖尿病慢性并发症之一[1],影响约50%的糖尿病患者[2]。DPN也是糖尿病患者发生足部溃疡甚至是下肢末端截肢的重要独立危险因素[3]。DPN的发病机制错综复杂,涉及慢性高血糖[4]、蛋白酶C激活[5]和氧化应激[6]等。晚期糖基化终末产物(advanced glycation end product,AGE)的聚集在DPN发病机制研究中越来越受到重视[7-9]。AGE是糖和蛋白质之间发生非酶反应的终末产物,其在体内的聚集可能与慢性高血糖和氧化应激有关。糖尿病控制和并发症试验(Diabetes Control and Complications Trial,DCCT)在1型糖尿患者群中通过皮肤活检发现,DPN患者中AGE含量显著高于非DPN患者[10]。而减少体内AGE聚集可在一定程度上减缓包括DPN在内的糖尿病并发症的发展[11]。
皮肤自发荧光检测仪(autofluorescence reader,AFR)可无创检测皮肤自发荧光(skin autofluorescence,SAF),并以此反映体内AGE聚集的程度[12]。研究发现,SAF与DPN显著相关,且SAF在DPN的诊断或预防中起到一定的作用[13-14]。然而在这些研究中,DPN的诊断方法各有不同且主观性较强,如Meerwaldt等[9]使用荷兰糖尿病神经病变症状量表(Dutch Diabetic Neuropathy Symptoms Scale)和荷兰糖尿病神经病变检查量表(Dutch Diabetic Neuropathy Examination Scale)诊断DPN,Chabroux等[15]仅以10 g单纤维尼龙丝检查和震动觉检查(128 Hz音叉)来诊断DPN。神经传导功能检查(nerve conduction studies,NCS)能够客观、可靠、定量地检测神经功能,是目前公认的DPN诊断的金标准,在临床上被广泛应用于DPN的确诊。鉴于中国黄种人的SAF研究较少,本研究根据NCS的检查结果诊断DPN,在中国汉族2型糖尿病患者中探讨SAF与DPN之间的关系。
资 料 和 方 法
体格检查 问卷调查以明确纳入者的年龄、性别及糖尿病病程。身高、体重、腰围和臀围由同一护理人员按标准化方法进行测量。BMI=体重/身高2(kg/m2)。血压由同一护理人员按照标准化方法使用水银式血压计测量3次并取其平均值。
生化指标检测 抽取纳入者空腹静脉血并进行75 g葡萄糖负荷试验。餐后2小时血糖(2-hour post-meal blood glucose,2hPG)和空腹血糖(fasting blood glucose,FBG)以葡萄糖氧化酶法测定(仪器:Wako pure 2756-01,日本Wako Pure Chemical Industries公司),糖化血红蛋白(glycated hemoglobin,HbA1c)以高效液相色谱法测定(仪器:HLC-723G7,日本Tosoh Corporation公司)。血清肌酐(serum creatinine,Scr)、三酰甘油(triacylglycerol,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)以酶比色法测定(仪器:Hitachi 7600-120,美国Hitachi High-Technologies公司)。尿微量白蛋白(urinary microalbumin,mAlb)以免疫比浊法测定(仪器:Tina-quant Albumin)。
SAF检查 SAF由AFR(DiagnOptics BV,美国Groningen公司)进行检测。在避光条件下,使用AFR对患者前臂掌侧光滑平整的皮肤区域(约4 cm2)照射波长为300~420 nm (峰值为370 nm)的激发光,使用分光计测量所有从皮肤发射和反射的300~600 nm激发光强度。SAF值为发射光(420~600 nm)和反射光(300~420 nm)的平均光照强度比值乘以100,并表示为任意单位(arbitrary units,AU)[12]。
神经传导功能检查 NCS由肌电图室专业医师使用肌电诱发电位仪(Keypoint®4,丹麦Skovlunde公司)完成。检测期间,患者放松平卧于安静室内,皮肤温度维持在32~33 ℃。运动神经检查包括:测量正中神经、尺神经、腓总神经和胫神经的运动神经传导速度(motor nerve conduction velocity,MNCV)、复合肌肉动作电位(compound muscle action potential,CMAP)波幅和远端潜伏期(distal latency,DL);感觉神经检查包括:测量正中神经、尺神经、腓浅神经和腓肠神经的感觉神经传导速度(sensory nerve conduction velocity,SNCV)和感觉神经动作电位(sensory nerve action potential,SNAP)波幅[17]。
诊断标准 神经传导功能检查各参数的正常值参照汤晓芙所著的《临床肌电图学》[18]。神经传导功能异常定义为:≥2个神经(其中至少包括1个下肢神经),每个神经有≥1个检查参数的异常[19]。DPN定义为:诊断为糖尿病且伴有神经传导功能异常。

结 果
患者的基本临床特征 本次研究共纳入115名2型糖尿病患者,其中男性54人,女性61人,平均年龄(68.75±7.74)岁,糖尿病病程(11.40±6.93)年,HbA1c 7.79%±1.64%,SAF值(2.42±0.46) AU。根据NCS结果将所有纳入者分为DPN组和非DPN组:DPN组39例,男性23例,年龄(69.85±8.22)岁,糖尿病病程(14.38±7.93)年,HbA1c 8.47%±1.90%;非DPN组76例,男性31例,年龄(68.25±7.61)岁,糖尿病病程(9.79±14.38)年,HbA1c 7.42%±1.39%。DPN组的糖尿病病程、身高、2hPG和HbA1c明显高于非DPN组(P<0.05),而两组患者年龄、性别、血压、血脂、血肌酐等差异无统计学意义(表1)。
SAF在DPN组和非DPN组间的比较 DPN组的SAF测量值为(2.67±0.45)AU,显著高于非DPN组的(2.28±0.41)AU(P<0.001,图1)。
表1 DPN组和非DPN组糖尿病患者的基本临床资料
Tab 1 Characteristics of type 2 diabetes patients with and without DPN
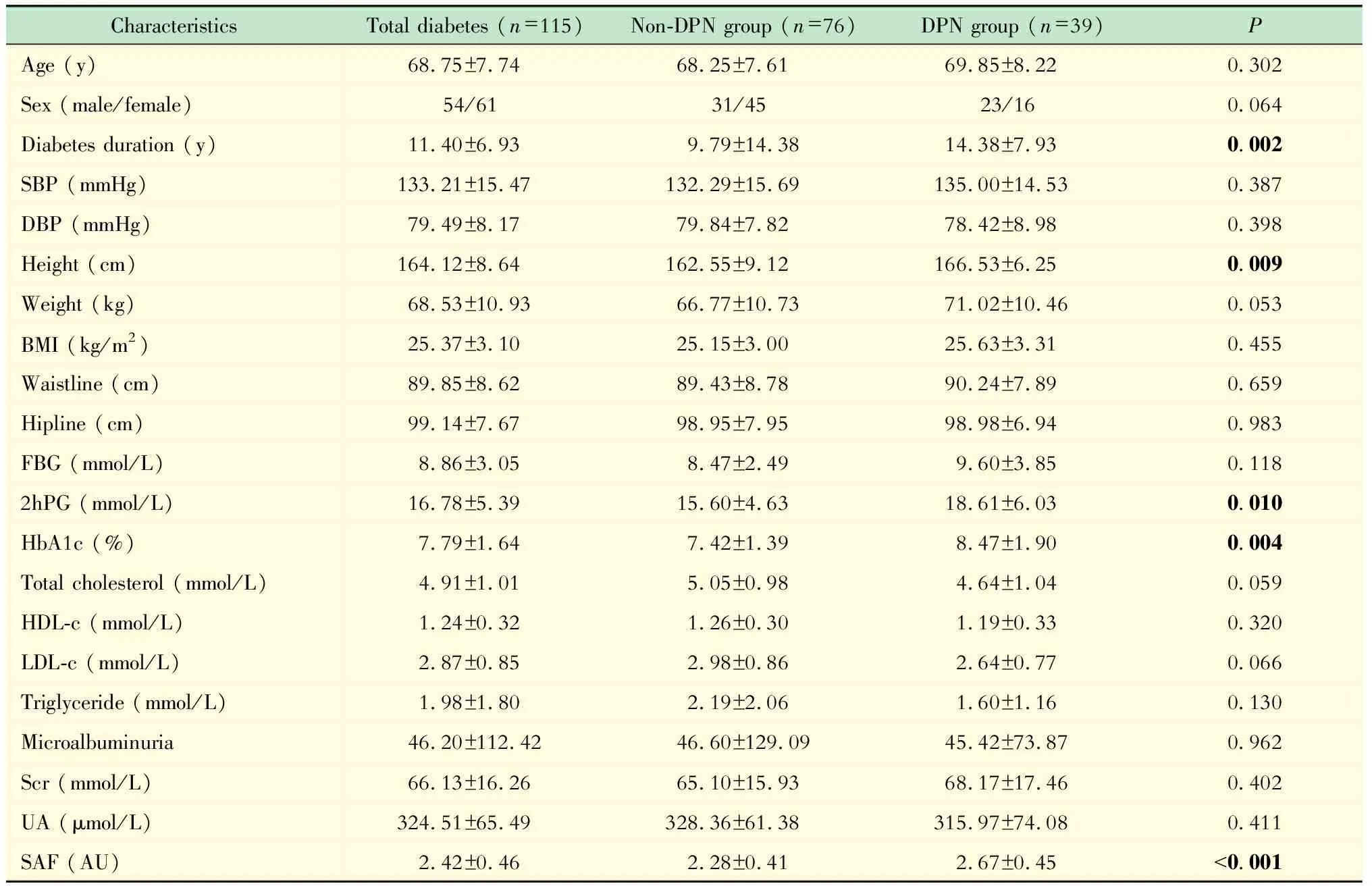
CharacteristicsTotal diabetes (n=115)Non-DPN group (n=76)DPN group (n=39)PAge (y)68.75±7.7468.25±7.6169.85±8.220.302Sex (male/female)54/6131/4523/160.064Diabetes duration (y)11.40±6.939.79±14.3814.38±7.930.002SBP (mmHg)133.21±15.47132.29±15.69135.00±14.530.387DBP (mmHg)79.49±8.1779.84±7.8278.42±8.980.398Height (cm)164.12±8.64162.55±9.12166.53±6.250.009Weight (kg)68.53±10.9366.77±10.7371.02±10.460.053BMI (kg/m2)25.37±3.1025.15±3.0025.63±3.310.455Waistline (cm)89.85±8.6289.43±8.7890.24±7.890.659Hipline (cm)99.14±7.6798.95±7.9598.98±6.940.983FBG (mmol/L)8.86±3.058.47±2.499.60±3.850.1182hPG (mmol/L)16.78±5.3915.60±4.6318.61±6.030.010HbA1c (%)7.79±1.647.42±1.398.47±1.900.004Total cholesterol (mmol/L)4.91±1.015.05±0.984.64±1.040.059HDL-c (mmol/L)1.24±0.321.26±0.301.19±0.330.320LDL-c (mmol/L)2.87±0.852.98±0.862.64±0.770.066Triglyceride (mmol/L)1.98±1.802.19±2.061.60±1.160.130Microalbuminuria46.20±112.4246.60±129.0945.42±73.870.962Scr (mmol/L)66.13±16.2665.10±15.9368.17±17.460.402UA (μmol/L)324.51±65.49328.36±61.38315.97±74.080.411SAF (AU)2.42±0.462.28±0.412.67±0.45<0.001
SBP:Systolic blood pressure;DBP:Diastolic blood pressure;BMI:Body mass index;FBG:Fasting blood glucose;2hPG:2-hour post-meal blood glucose;HbA1c:Glycated hemoglobin;HDL-c:High density lipoprotein cholesterol;LDL-c:Low density lipoprotein cholesterol;Scr:Serum creatinine;UA:Uric acid;SAF:Skin autofluorescence.1 mmHg=0.133 kPa.

图1 DPN组和非DPN组2型糖尿病患者SAF测量值比较
Fig 1 SAF values of type 2 diabetes patients with and without DPN
不同SAF水平间NCS的比较 本研究根据SAF测量值的第25百分位数和第75百分位数将所有纳入者分为低SAF组(SAF≤2.2 AU,n=41)、中SAF组(2.2 AU
DPN的Logistic回归分析 本研究以糖尿病病程、年龄、2hPG、HbA1c、LDL-c、TC和SAF为自变量(各自变量在DPN组和非DPN组的差异有统计学意义或为DPN常见的相关因素)构建DPN的Logistic回归分析模型(表3)。Logistic回归分析显示,SAF是DPN的独立危险因素(OR=8.947,95%CI:1.675~47.793,P=0.010)。
SAF检测对2型糖尿患者DPN的诊断价值 ROC分析结果显示,AUC为0.726 (95% CI:0.630~0.821,P<0.001)。当临界阈值为2.35时,约登指数最高,此时灵敏度为76.9%,特异度为57.9% (图2)。
表2 在低、中、高SAF组2型糖尿病患者间各NCS参数的比较
Tab 2 Comparison of CNS parameters according to SAF in type 2 diabetes patients

VariableLow SAF group(SAF≤2.2AU,n=41)Middle SAF group (2.2AU
MNCV:Motor nerve conduction velocity;DL:Distal latency;CMAP:Compound muscle action potential;SNCV:Sensory nerve conduction velocity;SNAP:Sensory nerve action potential;NCS:Nerve conduction studies.

表3 DPN的Logistic多因素回归分析Tab 3 Variables associated with DPN in multivariable logistic regression
Independent variables:Diabetes duration,age,2hPG,HbA1c,LDL-c,TC and SAF.
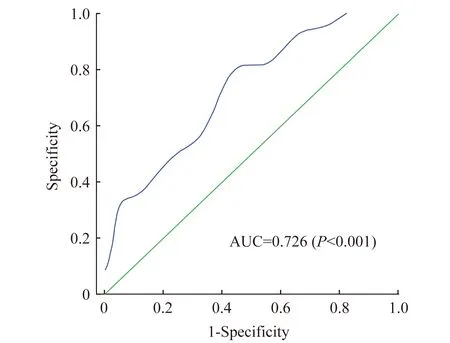
图2 SAF诊断2型糖尿病患者DPN的ROC曲线Fig 2 ROC curve of SAF for DPN diagnosis in patients with type 2 diabetes mellitus
讨 论
AGE聚集是DPN的重要发病机制之一[20],而AFR作为可快速、简便和无创检测SAF的仪器,能够反映体内AGE聚集[12]。已有研究报道,SAF在DPN的诊断和预测中起到重要作用,但仅有少量研究在汉族人群中进行[21-22],因而SAF对DPN临床诊断和筛查的价值仍需要进一步的检验。本研究以NCS的检查结果诊断DPN,在中国汉族2型糖尿病患者中研究发现,伴有DPN的糖尿病患者中SAF显著高于非DPN患者,SAF是DPN的独立危险因素且对DPN具有一定的诊断价值。NCS的检查参数(如MNCV、SNCV和SNAP波幅等)在不同SAF水平组有明显的差异。
一些研究(包括横断面研究和队列研究)报道,SAF与包括DPN在内的糖尿病微血管病变密切相关,并可以作为DPN的一个重要诊断指标甚至是预测指标[9,14]。然而,这些研究中DPN的诊断标准不统一且多数主观性较强,如10 g单纤维尼龙丝检查[23-24]、震动感觉阈值检查[25]、甚至仅以典型的神经病变症状[14]来判定有无DPN。本研究以NCS的检查结果诊断DPN,诊断结果更为客观、可靠,同样发现SAF与DPN密切相关,并进一步研究了NCS各检查参数与SAF间的关系。研究结果显示,高SAF组神经传导速度和神经传导波幅明显低于低SAF组,表明随着SAF的升高,外周神经的髓鞘和轴索功能更易受累,可能与AGE在外周神经的沉积有关[26-27]。Meerwaldt等[9]研究发现,SAF与神经传导速度和神经传导波幅呈负相关,而这种关系在无DPN的糖尿病患者和健康人群中也同样成立,提示SAF的改变可能早于临床症状的出现,或许可以用于无症状DPN患者的筛查。在本研究中,运动神经传导功能和感觉神经传导功能在高SAF组中均有所下降,表明SAF与运动神经和感觉神经损伤均相关,并可以在一定程度上反映两者的功能。Rajaoblina等[14]在随访时间为4年的队列研究中,以震动感觉阈值检查评估外周神经敏感度,以DN4评分评估神经病理性疼痛,以SUDOSCAN评估自主神经功能,以测力计评估肌肉力量,并发现这些神经相关检查在高SAF组(SAF>2.4AU)和低SAF组(SAF≤1.75 AU)间有明显差异。Araszkieicz等[28]通过皮肤活检检测表皮神经纤维密度以评估小纤维神经病变,研究发现SAF与表皮神经纤维密度呈负相关并独立于其他因素(β=-0.14,P=0.04)。上述研究表明,SAF可反映糖尿病患者的DPN病变情况,在形态上包括大纤维神经和小纤维神经,在功能上包括运动神经、感觉神经和自主神经。
AGE聚集在DPN发病机制中起到重要作用,被AGE修饰的外周神经髓鞘更容易被巨噬细胞吞噬并进一步发展为阶段性脱髓鞘,AGE修饰如微管蛋白、神经微丝蛋白和肌动蛋白等轴突骨架蛋白会导致轴突萎缩和轴突转运受损[7,29]。此外,AGE通过与AGE受体(AGER)相互作用上调NF-κB并进一步激活由NF-κB介导的促炎基因,加重神经功能紊乱[30]。本研究通过构建DPN的Logistic回归模型发现,SAF是DPN的重要危险因素(OR=8.947,95%CI:1.675~47.793,P=0.010),并独立于其他一些传统的DPN相关因素,如糖尿病病程和高血糖水平(2hPG、HbA1c)。进一步说明AGE可能在DPN的发病机制中起到一定作用。此外,有研究发现在STZ诱导的1型糖尿病大鼠模型中应用氨基胍(AGE形成抑制剂和醛糖还原酶抑制剂)可明显改善糖尿病大鼠的神经功能紊乱状况[11,31]。与本研究结果相似,Conway等[32]在1型糖尿病患者中研究发现皮肤固有免疫荧光(skin intrinsic fluorescence,SIF)与DPN明显相关,并且其与DPN的相关性要明显强于平均HbA1c(反映体内血糖累积暴露情况)。SAF可反映体内AGE的聚集,AGE可能是慢性高血糖和氧化应激长期作用的结果[33],而HbA1c则反映体内3个月的平均血糖水平。根据上述结果可以推测,相较于HbA1c,SAF能够更好的体现体内慢性高血糖的持续情况,与DPN的相关性更强。
有文献报道SAF的检测可能会受到肤色的影响,有关SAF与糖尿病并发症的研究多在白种人群中进行。Ahdi等[34]在不同肤色的2型糖尿病患者中(包括荷兰、土耳其、摩洛哥、印度和非洲)研究SAF与糖尿病并发症的关系,发现随着肤色加深SAF逐渐降低(3.06 AUvs.2.69 AU),且SAF在肤色较浅的人群中可有效评估糖尿病并发症的患病风险,但随着肤色加深,SAF与包括DPN在内的糖尿病并发症的关系也随之减弱。本研究在中国汉族人群中研究SAF与DPN的关系,糖尿病患者中SAF平均为(2.42±0.46)AU,非DPN组中SAF平均为(2.28±0.41)AU,而DPN组中SAF平均为(2.67±0.45)AU,明显高于前两者(P<0.01)。Hu等[21]研究发现糖尿病不伴足部溃疡的患者中SAF为(2.29±0.47)AU,而糖尿病伴足部溃疡患者中SAF为(2.80±0.69) AU,明显高于前者(P<0.01)。Liu等[22]在118例糖尿病伴足部溃疡患者中发现SAF为(2.8±0.2)AU,且与糖尿病血管并发症独立相关。包括本研究在内的3项在黄种人群中进行的研究显示糖尿病患者的SAF值基本相近,且均与糖尿病血管并发症相关,初步提示SAF用于黄种人群筛查的可行性。
本研究的不足之处在于:(1)横断面调查研究论证因果关系的能力较弱。(2)经过NCS检查仅发现39名DPN患者,难以进行亚组分析,以研究SAF与DPN病变程度的关系。(3) NCS虽然是DPN诊断的较为客观、可靠的检查手段,但其缺乏对小纤维神经病变的评估能力。
综上所述,SAF检查是一种可简便、快捷、无创检测体内AGE聚集状况的有效手段,与多种糖尿病慢性并发症密切相关。本研究以NCS检查结果诊断DPN,并在中国汉族2型糖尿病患者中发现SAF与DPN显著相关,是DPN的独立危险因素之一,为推广SAF在中国糖尿患者群中用于筛查DPN的患病风险提供一定的临床证据。后续仍需多中心前瞻性研究以评估SAF在DPN预测、诊断、监测和治疗中的作用。
doi:10.1002/dmrr.2832.

