肝细胞肝癌(HCC)中PDGF-A的表达及其临床意义
高琼媚 刘丹阳 周仲文 张乔安 刘国元 曾文姣△
(1复旦大学基础医学院病理学系 上海 200032; 2复旦大学附属妇产科医院病理科 上海 200011;3复旦大学附属华山医院病理科,4皮肤科 上海 200040)
肝细胞肝癌(hepatocellular carcinoma,HCC)是世界上第6位常见恶性肿瘤,占肿瘤致死率的第2位[1],同时也是我国最为常见的恶性肿瘤之一。HCC治疗方法有多种,包括手术切除、化疗、放疗、肝脏移植等,但患者治疗后存在着复发率高和耐药现象,因此有必要进一步深入研究HCC发生发展的分子机制。
血小板源性生长因子(platelet-derived growth factor,PDGF)是相对分子质量为28 000~35 000的多肽生长因子,主要促进间叶来源的细胞增殖、生存和迁移。PDGF-A是PDGF家族中重要的一员。在肿瘤的发生发展过程中,PDGF-A主要通过与其受体PDGFR-α结合,激活下游信号分子如PI3K/AKT、ERK、STAT、SHP2等,促进肿瘤细胞的增殖和侵袭[2]。最新的大数据分析显示,与相应正常组织比较,包括HCC在内的多种肿瘤(如多形性胶质母细胞瘤、前列腺腺癌、胃腺癌等)组织中PDGF-A表达升高[3]。酪氨酸激酶抑制剂Sorafenib已被批准为晚期HCC临床用药。2016年的一项HCC随机治疗试验[4]发现放疗联合Sorafenib减弱了PDGF反应,提示其主要作用机制可能是下调PDGF。临床观察发现部分手术后行干扰素α治疗的患者,中途停药后,HCC在短时间内复发;动物模型研究发现PDGF-A上调是HCC复发及干扰素α治疗失败的原因,联合给予PDGF受体抑制剂可提高再治疗的效果[5]。
虽然PDGF-A在肿瘤发生发展中的机制研究较多,但其在人HCC组织中的研究较少。少量文献报道了PDGF-A在HCC中表达及临床特点之间的关系,但仅采用免疫组化染色分析[6]。本研究在人HCC组织检测了PDGF-A基因表达,分析其与BCLC分期的关系;检测了7株肝癌细胞株PDGF-A蛋白质水平;运用免疫组化染色显示组织中PDGF-A蛋白质定位;并首次应用免疫荧光双重染色技术显示4种炎症细胞(CD4+、CD8+、CD19+、和CD68+细胞)可以表达PDGF-A。
材 料 和 方 法
组织标本 选取2010—2011年在复旦大学附属中山医院肝脏外科施行肝癌切除术的50例HCC标本,包括-80 ℃冻存的癌组织和癌旁肝组织,以及石蜡组织块,患者临床病理资料见表1。8例正常肝组织来源于该院肝血管瘤切除标本旁的非瘤正常肝组织,作为正常对照肝组织。另有5例HCC石蜡组织来源于复旦大学附属华山医院,用于免疫荧光染色。
巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期系统在临床广泛使用,根据肿瘤情况和临床表现将肝癌患者划分为5期(0、A、B、C、D期)[7]。因D期患者不进行手术治疗,所以本研究标本来自于0至C期HCC患者。0期:单个肿瘤≤2 cm、胆红素正常、无门脉高压;A期:少于3个肿瘤且均≤3 cm、Child-Pugh A-B;B期:多于3个肿瘤、Child-Pugh A-B;C期:有血管侵犯或转移、Child-Pugh A-C。
细胞株和培养基 Hep3B、SMMC-7721、MHCC97-H、BEL-7402肝肿瘤细胞株购自中国科学院上海生命科学研究院细胞资源中心,L02正常肝细胞和HepG2、Huh7、HCCLM3肝肿瘤细胞株获赠于复旦大学肝癌研究所。所有细胞株均采用Gibco高糖DMEM培养基,37 ℃、5% CO2条件下培养,取对数生长期的细胞用于实验。
定量RT-PCR检测 组织总RNA用Trizol常规抽提,经甲醇变性琼脂糖凝胶电泳,证实未有降解。逆转录采用PrimeScriPt RT试剂盒(日本Takara公司),按说明书操作。跨外显子的引物和Taqman探针购自美国Applied Biosystems公司,包括内参TBP(Hs00427620_mL)和PDGF-A(Hs00964426_mL)。每个样本做3个复孔,蒸馏水为空白对照。每个反应体系包含10 ng cDNA(1 μL),定量RT-PCR在ABI7900HT实时定量PCR仪(美国Applied Biosystems公司)上完成。用TBP基因标准化PDGF-A基因数据得到其相对表达值。
Western blot检测 收集处于对数生长期的细胞,提取总蛋白、定量、SDS-PAGE分离、转膜至PVDF膜。兔抗人PDGF-A抗体(1∶1 000稀释,ab9701,英国Abcam公司) 4 ℃孵育过夜,辣根过氧化物酶HRP-羊抗兔IgG抗体(1∶1 000稀释,SA00001-2,美国Proteintech公司)室温孵育1 h,ECL试剂曝光显色。内参选用兔抗β-tubulin抗体(1∶1 000稀释,10068-1-AP,美国Proteintech公司)。
免疫组化染色及分析 5 μm石蜡切片,脱蜡,0.3%过氧化氢甲醇溶液去内源性过氧化物酶,柠檬酸缓冲液(pH 6.0)微波修复10 min,正常羊血清封闭。随后,兔抗PDGF-A抗体(1∶50稀释,sc-128,美国Santa Cruz公司)37 ℃孵育1 h,4 ℃过夜,HRP-羊抗鼠/兔IgG抗体 (稀释比例1∶3,K5007,丹麦DAKO公司) 37 ℃孵育45 min,DAB显色,苏木精复染1 min,中性树胶封片。
对癌细胞染色阳性程度进行半定量分析。染色强度分为:0,无染色/可疑着色;1,有确切着色;2,有明显着色;3,强烈着色。阳性细胞数量分为:1,少量细胞(<30%);2,较多细胞(30%~60%);3,大量细胞(>60%)。两者的乘积为该例癌细胞PDGF-A分值,设定<1分为阴性,1~3分为阳性,>3分为强阳性。
使用多光谱切片流式细胞仪(CLS140089,美国Perkin Elmer公司)配合拍照及分析软件,对间质区域阳性细胞进行定量分析。每例选取癌和癌旁各5个×200视野拍照(Vectra 2.0.8);拆图、建立光谱数据库(Nuance 3.0.1.2);选出间质区域,计算阳性细胞占比(Inform 2.0.2)。视野的选择:癌组织中的周边部位为HCC代表(因该部位最能反映肿瘤的侵袭能力及恶性程度),同一切片上与癌组织稍远的肝组织作为对照(避开直接与肿瘤接触的区域)。
双重免疫荧光染色 5 μm石蜡组织切片贴附于多聚赖氨酸预处理载玻片,脱蜡,0.3%过氧化氢甲醇溶液去内源性过氧化物酶,柠檬酸缓冲液(pH 6.0)微波高温修复10 min,正常羊血清封闭非特异性结合,兔抗PDGF-A抗体(1∶50稀释,sc-128,美国Santa Cruz公司)室温1 h,HRP-羊抗鼠/兔IgG抗体(稀释比例1∶3,K5007,丹麦DAKO公司)室温10 min,荧光染料(OpalTM4-color试剂盒,NEL794001KT,美国Perkin Elmer公司)避光孵育10 min。随后柠檬酸缓冲液(pH 6.0)微波10 min,洗去前面结合抗体。正常羊血清封闭,分别加鼠抗CD4、CD8、CD19或CD68单克隆抗体(1∶50稀释,sc-32811、7188、69736、17832,美国Santa Cruz公司)室温1 h,HRP-羊抗鼠/兔IgG抗体室温10 min,荧光染料避光孵育10 min。DAPI室温避光孵育10 min,甘油封片。在多光谱切片流式细胞仪上观察及拍照。
统计学分析 应用SPSS 22.0软件进行统计分析,独立样本t检验比较组间差异,配对样本t检验比较肿瘤和相应瘤旁组织的差异。P<0.05为差异有统计学意义。

表1 HCC患者的临床病理特征统计数据Tab 1 The pathological features of patients with HCC (n)
结 果
PDGF-A mRNA水平及其与BCLC临床分期关系 采用定量RT-PCR方法,检测8例正常肝组织、50例HCC及相应癌旁非肿瘤肝组织中PDGF-A mRNA水平。28例HCC癌组织PDGF-A基因表达高于正常肝组织平均值,其中19例是正常肝组织均值的2倍及以上。与相应癌旁组织相比,HCC癌组织PDGF-A基因表达升高(P<0.01,图1A),其中24例HCC癌组织表达量是癌旁组织的2倍及以上。分析各BCLC分期病例,PDGF-A的mRNA在各期的癌组织均较癌旁组织高,其中0、C期的差异有统计学意义(P<0.01,图1B)。

A:PDGF-A mRNA levels in normal livers (n=8),HCC and corresponding adjacent livers (n=50).B:PDGF-A mRNA levels in normal livers (n=8),HCC with BCLC 0 stage (n=6),A stage (n=25),B stage (n=13) and C stage (n=6).NL:Normal liver tissue;Adjancent:Adjancent liver tissue;(1)P<0.01.
图1 正常肝、HCC及其相应癌旁肝组织的PDGF-A mRNA水平
Fig 1 PDGF-A mRNA levels in normal livers,HCC and corresponding adjacent liver tissues
肝肿瘤细胞株中PDGF-A蛋白质水平 运用Western blot方法检测正常肝细胞株L02和7株肝肿瘤细胞中PDGF-A蛋白质水平,结果如图2。 L02、SMMC-7721、HCCLM3、MHCC97-H细胞株中表达PDGF-A蛋白质,其水平在MHCC97-H细胞中最高,其次是SMMC-7721,然后是HCCLM3和L02。另4株细胞未检测到PDGF-A蛋白质,包括HepG2、Hep3B、Huh7和BEL-7402细胞。

PDGF-A protein is detected in L02,SMMC-7721,HCCLM3 and MHCC97-H cell lines;while HepG2,Hep3B,Huh7 and BEL-7402 have no detectable PDGF-A protein.
图2 正常肝及肝癌细胞株中PDGF-A蛋白质水平
Fig 2 PDGF-A protein levels in liver cell and hepatoma cell lines
PDGF-A在HCC组织中的分布及表达 在HCC组织石蜡切片上进行的免疫组化染色显示,PDGF-A蛋白质阳性染色存在于肝癌细胞和间质炎症细胞中(图3)。癌细胞中PDGF-A蛋白质分布有2种类型:弥漫分布于细胞质内(图3D),在细胞质/细胞膜局部聚集(图3E、F)。对癌细胞染色阳性程度进行半定量分析显示,癌细胞PDGF-A蛋白质阳性表达见于33.3% (14/42)的病例,强阳性表达见于26.2% (11/42)的病例,其余40.5% (17/42)病例无/极微弱表达。
PDGF-A在HCC组织间质炎症细胞中的表达分析 运用图像分析技术定量测定间质中PDGF-A阳性细胞百分比,HCC癌间质区域PDGF-A阳性率(67.0%)高于相应的癌旁肝(18.3%),差异有统计学意义(P<0.0001,图4A)。BCLC各期病例分析均显示,HCC癌间质区域PDGF-A阳性率高于相应的癌旁肝间质区域,差异有统计学意义(P<0.05,图4B)。
CD4+、CD8+、CD19+和CD68+炎症细胞表达PDGF-A 为明确组织间质中PDGF-A阳性细胞的类型,运用免疫荧光双染色技术,检测4种免疫细胞标志物(CD4、CD8、CD19、和CD68)与PDGF-A的共定位 。PDGF-A蛋白质与CD4、CD8、CD19、和CD68均有共表达(图5),表明CD4+、CD8+、CD19+和CD68+的炎症细胞均可以表达PDGF-A。
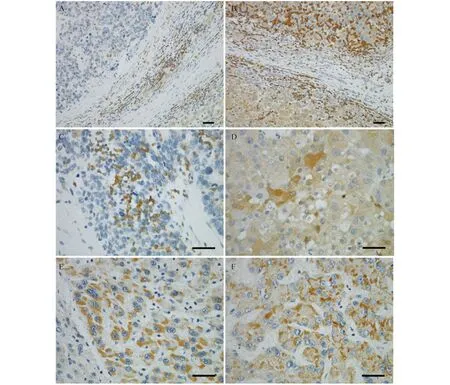
PDGF-A positive staining exists in HCC tumor cells and interstitial inflammatory cells.A and B:The junction between tumor and surrounding tissue.C:Positive staining of inflammatory cells in tumor interstitium.D:PDGF-A is diffusely distributed in the cytoplasm of tumor cells.E and F:PDGF-A aggregates in local cytoplasm and/or cell membrane (Scale bar:50 μm.Original magnification A-B 200×,C-F 400×).
图3 HCC组织中PDGF-A蛋白质的分布
Fig 3 PDGF-A protein distribution in HCC tissues
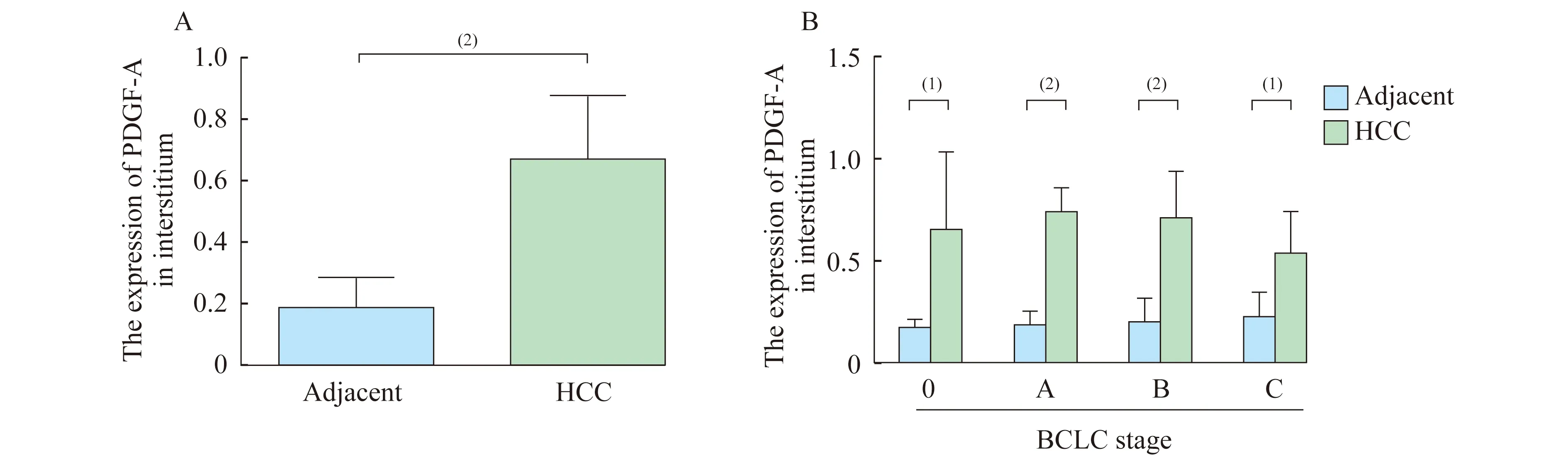
A:Percentage of PDGF-A positive cells in tumor interstitium is higher than that in corresponding adjacent liver interstitium (n=43).B:In all stages,interstitial PDGF-A positive percentages are higher in tumor than that in corresponding adjacent liver.(1)P<0.05,(2)P<0.000 1.
图4 HCC间质中PDGF-A阳性细胞比例
Fig 4 Percentage of PDGF-A positive cells in HCC interstitium

Immunofluorescence double staining shows that CD4,CD8,CD19 and CD68 positive cells (red) have PDGF-A expression (green),respectively.Scale bar:50 μm.Original magnification 400×.
图5 HCC组织中PDGF-A与CD4、CD8、CD19和CD68共表达
Fig 5 Co-expression of PDGF-A with CD4,CD8,CD19 and CD68 in HCC tissues
讨 论
PDGF-A是功能最强的生长因子之一,通过自分泌或旁分泌调节,对多种肿瘤的进展至关重要,并与患者不良预后相关[3,8-9]。本文运用定量RT-PCR检测了人HCC组织中PDGF-A的mRNA,发现其在癌组织中的表达水平高,近50%(24/50例)的癌组织PDGF-A基因表达量是癌旁组织的2倍及以上,尤其在早期和进展期(BCLC 0和C期)的HCC病例中。因本文病例较少,PDGF-A是否在HCC早期促进肿瘤的生长,在HCC晚期促进肿瘤侵袭转移,尚有待更多的实验数据验证。
虽然HCC属于PDGF及其受体基因缺陷发生率低的肿瘤[10],但有多篇文献显示PDGF-A在HCC癌组织中表达升高。运用高密度寡核苷酸阵列检测38例HCV相关HCC,发现与正常肝组织相比,癌组织PDGF-A基因表达高[11]。国内学者[6]运用免疫组化研究了44例HCC患者,发现癌组织表达PDGF-A高于相应的癌旁和正常肝组织,且低分化者高于高分化者,伴门静脉癌栓者高于无门静脉癌栓者,提示PDGF-A与肿瘤的增殖分化及浸润转移有关。对PDGF-A受体PDGFR-α的研究显示,虽然该受体基因表达整体下调,但其蛋白质水平在人HCC中显著高于癌旁肝组织,其过表达促进肿瘤进展和预示患者预后差,可作为预后指标和治疗的靶点[12]。
本文检测了培养的肝癌细胞株中PDGF-A蛋白质,发现其表达于3株肝癌细胞株(MHCC97-H、SMMC-7721、HCCLM3)以及L02肝细胞株(人胚胎肝细胞)。MHCC97-H是复旦大学附属中山医院建立的高侵袭转移肝癌细胞株,动物模型肺转移率达100%[13],之后又从该细胞系得到更高转移潜能的HCCLM3细胞系[14]。SMMC-7721来源于我国1名50岁男性原发性肝细胞肝癌,生长较迅速且较稳定,免疫缺陷小鼠体内成瘤率高[15]。4株细胞(HepG2、Hep3B、Huh7和BEL-7402)在本实验条件下未检测到PDGF-A蛋白质,其中3株细胞系属分化程度高的肝肿瘤:HepG2是从阿根廷1名15岁高加索男孩的原发性肝胚细胞瘤中分离出并建立的,低转移,在裸鼠中成瘤率较差;Hep3B分离自8岁美国黑人男童的肝癌组织,在裸鼠中能致瘤,但基本不转移;Huh-7是从1名57岁日本男性肝癌组织标本上培养而得,高度分化[16]。
本文的免疫组化结果显示HCC组织中PDGF-A有多个来源,一是癌细胞本身表达,二是肿瘤间质区域和紧邻癌组织的间质区域的炎症细胞。近60%病例的肝癌细胞表达PDGF-A,阳性染色有两种分布方式:弥漫于胞质内,在细胞质/细胞膜局部聚集。这两种分布形式在其发挥功能中是否有差异,尚需进一步研究。肿瘤间质区域和紧邻癌组织的癌旁间质区域的大量炎症细胞PDGF-A阳性,提示HCC癌细胞不仅可以接受本身PDGF-A的自分泌刺激,也可能接受来源于邻近组织间质炎细胞分泌PDGF-A的旁分泌刺激。有文献报道PDGF家族分子与肿瘤微环境中免疫细胞之间相互作用。PDGF-D可结合肿瘤微环境中活化的自然杀伤细胞,促其分泌干扰素γ、肿瘤坏死因子α等促炎因子和趋化因子,激活免疫应答,诱导促炎反应,限制癌细胞在体外和体内的生长[17]。PDGF-B可负向调节jumonji域蛋白6的表达水平,从而促进T细胞衰竭[18]。目前尚无HCC微环境中PDGF-A与免疫细胞之间关系的研究报道。
生理情况下,PDGF主要表达于血小板α颗粒内。当肝损伤发生时,PDGF可高表达于巨噬细胞、受伤的内皮细胞和激活的肝星状细胞[19]。已有文献报道人肝病组织内PDGF-A表达的细胞类型。Malizia等[20]在因多种疾病而进行肝移植患者的肝组织中,运用原位杂交技术显示PDGF-A mRNA在单个核细胞和增生小胆管细胞大量表达,也表达于血管内皮细胞和平滑肌细胞,且通过连续切片的CD68免疫组化染色,证明巨噬细胞表达PDGF-A mRNA。Pinzani等[21]研究显示,正常人肝中PDGF-A表达很少,而肝硬化组织PDGF-A表达显著增加,免疫组化显示其分布于硬化结节的血窦结构,原位杂交显示其主要位于肝细胞和增生小胆管,也出现在纤维间隔内间质细胞,偶尔出现在纤维间隔和硬化结节内浸润的炎症细胞中。目前尚无文献关注HCC组织中PDGF-A在癌细胞以外的细胞表达。本文首次应用免疫双荧光染色技术显示4种炎症细胞(CD4+、CD8+、CD19+和CD68+细胞)可以表达PDGF-A,不仅提示多种间质炎细胞能通过分泌PDGF-A影响HCC细胞,也为后续HCC免疫微环境的研究提供了线索。

