黄颡鱼Pelteobagrus fulvidraco AMH基因的克隆鉴定及表达
王乐,程磊,王秋实
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
黄颡鱼Pelteobagrusfulvidraco广泛分布在我国长江、珠江和黑龙江等各大淡水域,肉质鲜美细嫩、无肌间刺,富含多种蛋白质,是一种深受消费者喜爱的淡水名优养殖对象[1,2]。黄颡鱼生长速度较为缓慢,即使是在相同的养殖环境中,雄性的生长速度也远快于雌性[3]。黄颡鱼是研究性别分化及生长调控机理的典型鱼类。
抗缪勒氏管激素(anti-Müllerian hormone,AMH)也叫缪勒氏管抑制物(Müllerian inhibiting substance,MIS),是 β 转化生长因子(transforming growth factor-β,TGF-β)超家族中的一员[4]。由法国科学家Jost在1940年首次发现后,Picard等于1984年首次从初生牛犊的胚胎精巢中提取纯化获得AMH的蛋白,之后相继在各种哺乳动物中开展相关研究[5,6]。AMH是性别分化的重要调控因子,在哺乳动物的雄性性腺分化期可以抑制缪勒氏管形成,表明AMH可能对雄性个体的精巢发育有一定作用[7];雌性个体的AMH可阻止原卵泡的形成,降低卵泡刺激素的分泌[8],在卵巢生理中起重要调控作用[9]。早期AMH的研究主要集中在哺乳动物和鸟类中,大部分硬骨鱼没有缪勒氏管,对鱼类研究的很少。直到2002年,Miura等在日本鳗鲡Anguilla japonica中发现了一个精子诱导激素的cDNA,虽然与已获得的AMH同源性很低,但其作用模式却与哺乳动物及鸟类的AMH极为相似,功能分析验证为鱼类的AMH[10]。其特殊的表达模式在硬骨鱼性腺发育中也起重要的调控作用。本项目组测序获得了黄颡鱼的基因组数据,并在性别分化及生长调控机理的研究方面取得了一定进展[11-13]。本试验通过克隆黄颡鱼AMH基因序列,分析该基因组织表达模式,以期为黄颡鱼性别分化及生长调控机理研究提供参考。
1 材料与方法
1.1 材料
试验用1、2龄黄颡鱼各30尾,购买自淡水鱼批发市场。采用活体快速解剖的方式收集脑、鳃、肾、肝、脾、性腺、肌肉及血液组织,迅速放入液氮中保存,随后转移至-80℃冰箱中,用于提取总RNA。将尾鳍样本保存在95%酒精溶液中,用于提取DNA。
1.2 RNA提取及反转录
采用TRNzol Universal试剂(天根生化公司)提取样品总RNA。取保存于-80℃的组织样品50mg和血液300μL,加入1mLTRNzol Universal试剂,置于冰上快速匀浆完全,利用氯仿-异丙醇提取法分离纯化后溶解于RNase-Free ddH2O中,DNase I(TaKaRa)纯化,用1%的琼脂糖凝胶电泳检测其完整性,以Nanodrop8000检测RNA纯度及浓度,RNase-Free ddH2O稀释至 50ng/μL。
本试验的反转录处理包括两种:第一种反转录获得cDNA用于AMH基因开放阅读序列的扩增。该扩增利用PrimeScriptTMRT-PCR Kit(TaKaRa),按说明书采用两步法完成。第一步反应采用10μL体系,总RNA的用量为1μg,反应条件为65℃,5min;第二步反应采用相应的20μL体系,反应条件为42℃处理20min,95℃处理5min,然后进行70℃,15min的失活处理。保存于-20℃。
第二种反转录产物用于Real-Time PCR实验,利用 PrimeScriptTMRT Master Mix(Perfect Real Time)(TaKaRa)于冰上操作,按说明书指示完成,采用10μL体系,总RNA的用量为200ng。37℃反转录反应15min,85℃酶失活处理5s,-20℃保存。
1.3 DNA提取纯化
剪取少量尾鳍,利用酚-氯仿抽提法纯化总DNA。DNA溶解于RNase-Free ddH2O中,用1%的琼脂糖凝胶电泳检测其完整性。以Nanodrop 8000检测DNA的纯度和浓度后,用RNase-FreeddH2O稀释到约50ng/μL备用。
1.4 AMH基因扩增
全长序列的扩增引物设计来源于NCBI中已发布的近缘物种斑点叉尾Ictalurus punctatus的AMH 序列(XM_017477698)(表 1)。扩增反应所用模板分别为总RNA经反转录所得cDNA及提取纯化的DNA。每个PCR反应体系为50μL,包含25μL的 2×Es Taq MasterMix(Dye)(康维世纪)、10μM的上下游引物各2μL和1μL的模板,用ddH2O补足至50μL。PCR扩增条件为:94℃预变性5min;扩增35个循环,每个循环94℃变性30s、60℃退火60s、72℃延伸90s;72℃终延伸15min。PCR扩增产物经1%的琼脂糖凝胶电泳后,用Axygen胶回收试剂盒纯化。纯化产物连接至pMD19-T载体(TaKaRa),并转化至DH5α感受态细胞(TaKaRa)。挑选阳性单克隆经PCR验证后,送至金唯智生物公司测序。
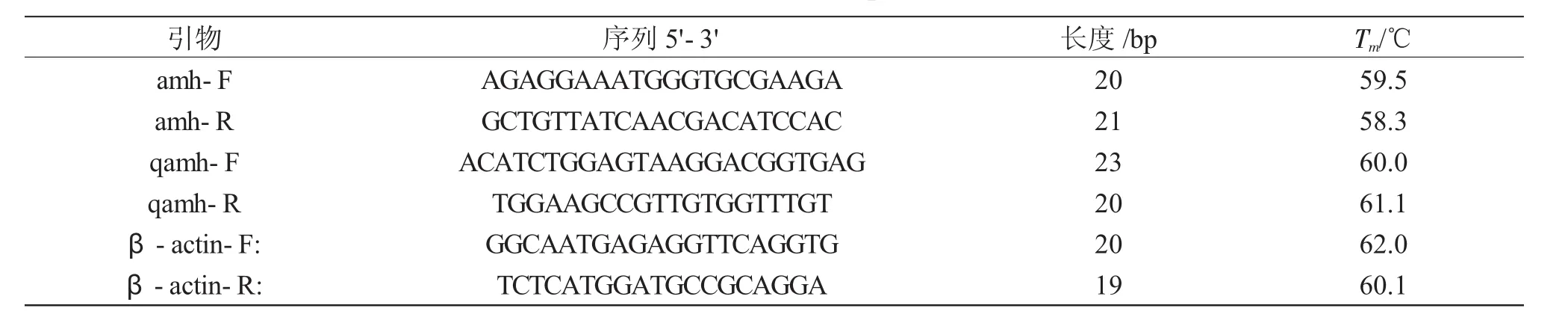
表1 本研究所用的引物信息Tab.1 Primersusedinexperiment
1.5 AMH基因序列及结构分析
使用软件BioEdit 7.0将测序所获得AMH序列信息进行拼接整理;利用Expasy的在线工具Translate(https://web.expasy.org/translate/)预测 AMH 基因的开放阅读框及氨基酸序列;利用Expasy的在线工具 ProtParam(https://web.expasy.org/protparam/)计算预测该蛋白质的理论等电点和分子量信息;用在线工 具 SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测分析信号肽序列及半胱氨酸残基;利用软件Clustalx 1.81进行黄颡鱼AMH与其他物种AMH氨基酸间多序列比对;用cluster W软件进行多重比对黄颡鱼AMH与其他物种AMH氨基酸间同源性;利用 SMART(http://smart.embl-heidelberg.de/smart/)分析蛋白结构和功能。应用MEGA4.0软件进行1 000次bootstraps值验证,构建系统发育树。
1.6 AMH基因的表达分析
以 SYBR Premix ExTaqTM(TaKaRa)操作说明为指导,使用QuantStudio 6 Flex系统(Applied Biosystems)进行Real-Time PCR反应,检测AMH基因在不同组织中的表达,Real-Time PCR的引物根据扩增产物的测序结果,在开放阅读框内设计获得。内参基因为黄颡鱼β-actin。引物合成由金唯智生物公司完成,信息如表1所示。反应体系20μL,包括SYBR Premix Ex TaqTM(2×)10μL、正向引物及反向引物(10μm)各 0.4μL、ROX Reference DyeⅡ0.4mL和模板cDNA 1μL,用ddH2O补足至20μL。反应条件为标准的两步法程序:95℃预变性10s;扩增40个循环,每个循环95℃变性5s、60℃退火34s。反应结束后,溶解曲线的反应条件为:95℃持续15s,60℃持续1min,95℃持续15s。每个样品重复3次取均值,应用2-ΔΔCT法计算AMH基因的表达量[14]。用SPSS17.0软件进行数据统计分析和显著性检验,P<0.05时为显著性差异。
2 结果与分析
2.1 黄颡鱼AMH基因序列分析
以黄颡鱼总RNA反转录所得cDNA为模板,经克隆扩增获得AMH基因的开放阅读框序列,而以黄颡鱼DNA为模板,经克隆扩增获得AMH的基因组序列。将两测序结果比对分析,确定其外显子及内含子的组成及序列信息,获得GenBank检索号MK310106。
黄颡鱼AMH全长3 588bp,其开放阅读序列为1 653bp,由7段外显子组成,可编码550个氨基酸序列,非编码序列包括959bp的5’-非编码区序列(5’-UTR)、6段内含子序列及 119bp的 3’-非编码区序列(3’-UTR)组成(图1A)。SMART分析表明,编码的氨基酸序列包含20个信号肽序列及9个半胱氨酸残基,含有 AMH-N区域(87~440)及TGF-β 结构域(458~550)(图 1B)。预测所得蛋白分子量为61.40 ku,理论pI为5.94,不稳定系数为49.66,该蛋白为不稳定蛋白。脂肪系数为85.25,亲水性系数为-0.331,表明其为亲水性蛋白。
2.2 AMH基因同源性分析
用Cluster W软件进行的氨基酸序列同源性比较表明(图2):不同物种间的AMH氨基酸序列差异很大。本研究获得的AMH基因序列与已发表的基因序列进行比对发现,其与黄颡鱼Tachysurus fulvidraco的相似性最高,达99.6%,与低眼无齿Pangasianodon hypophthalmus及斑点叉尾的相似性也很高,分别达75.8%与74.8%,而与狮尾狒、黑猩猩等高等哺乳动物相似性最低。氨基酸序列的多重比对结果也进一步验证了这种同源性分析结论(图3)。这表明AMH在不同物种中的保守性并不高。

图1 黄颡鱼AMH的DNA全长序列及氨基酸序列Fig.1 The full-length DNA and deduced amino acid sequences of AMH in yellow catfish
进一步直观研究AMH的进化特征,利用Mega4.0软件中的NJ法绘制AMH基因的系统进化树(图4),所有的AMH序列都来源于硬骨鱼、哺乳动物等脊椎动物,GenBank检索信息如下:黄颡鱼(MK310106)、黄颡鱼 Tachysurus fulvidraco(XP_027 007942)、低眼无齿(XP_026803092)、斑点叉尾(XP_017333187)、墨西哥脂鲤Astyanax mexicanus(XP_022525495)、纳氏臀点脂鲤Pygocentrus natterer(iXP_017572294)、电鳗Electrophorus electricus(XP_026873942)、安水金线鲃 Sinocyclocheilus anshuiensis (XP_016327204)、 鲤Cyprinuscarpio(XP_018920046)、斑马鱼Danio rerio(XP_009294509)、犀角金线鲃 Sinocyclocheilus rhinocerous(XP_016395808)、滇池金钱鲃 Sinocyclocheilus grahami(XP_016138462)、四川裂腹鱼Schizothorax kozlovi(ASU44862)、 北 极 红 点 鲑Salvelinus alpinus(XP_023855208)、鲫 Carassius auratus(AHL68989)、核雅罗鱼 Squalius pyrenaicus(ABX55992)、黑鲫 Carassius gibelio(AKP99417)、虹鳟 Oncorhynchus mykiss(XP_021459508)、浪白鱼Anabarilius graham(iROL40795)、大鳞大麻哈鱼Oncorhynchus tshawytscha(XP_024277327)、大西洋鲑Salmo salar(ADJ38820)、Seriolalalandi dorsalis(XP_023263819)、人 Homo sapiens(EAW69397)、黑猩猩 Pan troglodytes(XP_016790129)、狮尾狒Theropithecus gelada(XP_025222375)。分析结果如图4所示,除一种Seriola lalandi dorsalis进化地位比较特殊外,所有的AMH均可为两个大分支:哺乳动物为一支,其他鱼类为另一支。黄颡鱼AMH先与斑点叉尾、低眼无齿等鲶形目物种聚集成簇,再与电鳗、纳氏臀点脂鲤等聚类。

图2 黄颡鱼AMH同其他脊椎动物AMH氨基酸同源性比较Fig.2 Comparative homology of the amino acid sequences of yellow catfish AMH with other vertebrate AMH
2.3 黄颡鱼AMH基因的mRNA表达
Real-Time PCR检测AMH基因在不同生长阶段黄颡鱼的脑、鳃、肾、肝、脾、性腺、肌肉及血液中的表达情况(图5)。结果表明,AMH基因的mRNA在不同组织中的表达水平差异很大。1龄雄鱼各组织的表达量显著高于1龄雌鱼,尤其是性腺、肝、肾中,雄性表达量远远高于雌性,只有在脾中,雄性表达量略低于雌性;2龄鱼中,AMH基因的表达量仅雄性的性腺、脾中显著高于雌性,而在雄性脑和血液中表达量又明显低于雌性,在其他的组织中的表达基本相似。
3 讨论
Miura等(2002)在日本鳗鲡中发现了第一个鱼类的AMH基因,随后在大西洋鲑Salmo salar、日本青鲽 Paralichthys olivaceus、斑马鱼 Danio rerio、青Oryzias latipes、奥利亚罗非鱼Oreochromis aurea等鱼类中相继开展了AMH的克隆研究工作[10]。
本研究首次扩增获得了黄颡鱼的AMH基因,全长3 588bp,其开放阅读序列为1 653bp,可编码550个氨基酸序列。测序结果经比对分析,与本项目组前期测序获得的黄颡鱼基因组上部分信息完全一致。BLAST分析将本研究扩增获得的AMH基因定位于基因组序列2号染色体chr2的19371164~19374761区间。SMART分析表明,黄颡鱼AMH基因编码蛋白含有典型的AMH-N区域及TGF-β结构域。AMH-N结构域上的糖基化位点及TGF-β结构域上含有的特异性裂解位点,可有助于AMH形成蛋白二聚体,同时含有9个保守的半胖氨酸残基,这与之前的研究结论相一致,经验证该蛋白属于TGF-β超家族[15]。

图3 预测的黄颡鱼AMH氨基酸序列及与其他鱼类AMH氨基酸序列的比较。Fig.3 Predicted amino acid sequence of yellow catfish AMH and alignment with other teleost
起初关于AMH表达的研究主要集中在性腺组本研究初步对黄颡鱼的AMH进行了克隆分离与鉴定析,但其对性别分化及发育的调控作用还有待进一步研究。织,这是因为AMH在性别分化及发育中起重要的调控作用。后来的研究表明,AMH在斑马鱼的脑、肌肉、眼、皮肤、肾、肝和心等组织中都有表达[16]。本研究中黄颡鱼AMH的mRNA在脑、肌肉、肝等所检测的组织中均有表达且存在着极大的差异性。这与Rodríguez-Marí等(2005)对斑马鱼中 AMH 的表达结果相类似[17]。1龄雄鱼性腺中的表达量显著高于2龄雄鱼,这是因为黄颡鱼精巢分化大致始于孵出后55d。在性腺分化时期,与性别分化相关的基因处于较活跃状态,促进了AMH的表达。而在性成熟时期,精母细胞和雄性激素的协同作用又有效抑制了AMH表达[18]。该检测结果表明:AMH极可能在黄颡鱼的性别分化及生长发育过程中都发挥重要作用。
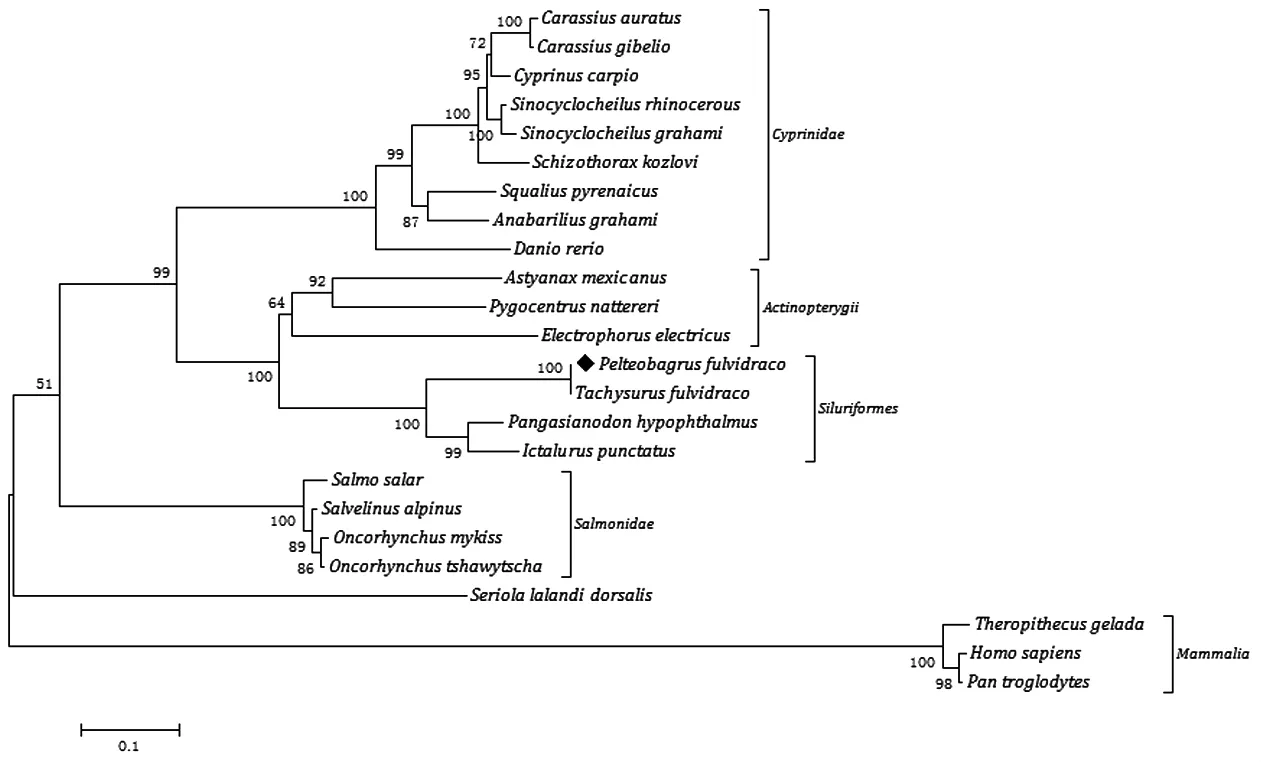
图4 NJ法构建黄颡鱼AMH与其他脊椎动物AMH系统树Fig.4 Phylogenetic tree of yellow catfish AMH and other species AMH based on the Neighbor-joining method
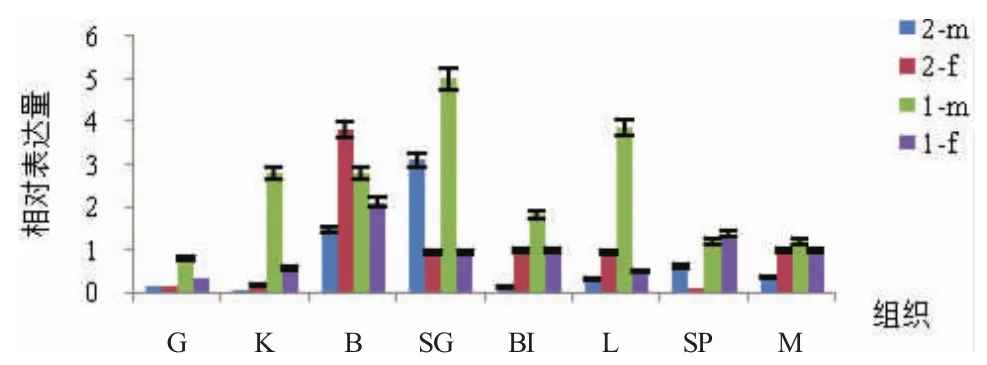
图5 AMH基因mRNA在黄颡鱼各组织中的表达水平Fig.5 mRNA expression level of AMH gene in different tissues of yellow catfish

