哺乳动物细胞瞬时转染技术研究进展
孙静静,李桂林,周雷鸣,周伟伟,赵巧辉
目前全球越来越多的重组抗原及重组抗体用于医疗,尤其针对肿瘤、自身免疫病等难治病症,以及体外诊断试剂。越来越多的高校和企业开始重视重组蛋白新药的开发,这就要求能够快速生产足够候选蛋白用于临床前研究,因此能够快速生产毫克到克级别的重组蛋白瞬时表达体系开始得到广泛应用[1]。
重组蛋白的生产方法主要可分为两种,一种是稳定转染(stable gene expression,SGE),另一种是瞬时转染(transient gene expression,TGE)。稳定转染,是指外源 DNA 转入宿主细胞后将外源目的基因整合到宿主染色体中进行表达。稳定转染需要使用线性 DNA,线性 DNA 虽然较超螺旋 DNA 转入量低,但整合率高。稳定转染过程中,外源 DNA 整合到宿主细胞染色体中概率很小,只有大约 1%,且通常需要通过一些选择性标记反复筛选,才能得到稳定转染的同源细胞系。瞬时转染,是指外源 DNA/RNA 转入宿主细胞后不整合到宿主染色体中进行外源目的基因的表达。因此一个宿主细胞中可存在多个拷贝数,产生高水平的表达,但通常只持续几天,多用于启动子和其他调控元件的分析。一般来说,超螺旋质粒 DNA 转染效率较高。在转染后 24~72 h(依赖于不同的构建)分析结果时,常常用到一些报告系统如荧光蛋白、β 半乳糖苷酶等来帮助检测。瞬时转染现已广泛应用于重组蛋白生产,不同的瞬时表达系统用于多种重组蛋白的制备。
规模化的瞬时转染表达工艺从前期质粒 DNA 的制备、细胞的扩增到瞬时基因转染,所需时间不到一个月,即可获得毫克到克级的蛋白产物,而且瞬时转染技术的应用规模越来越大,最大已达到百升的水平[2]。与稳定基因表达相比,瞬时转染有三方面优势:第一,大大缩短了获得重组蛋白的时间[3];第二,技术门槛较低,几乎可以在每一个细胞培养相关的实验室展开,无需特殊设备;第三,通量高,灵活性高,可以运用到多种不同重组蛋白的表达,甚至包括对宿主细胞有毒性的蛋白,而且可同时进行多种不同蛋白的表达。由于其灵活性高,瞬时转染非常适用于提供数量少但是种类繁多的蛋白小规模生产供应,或者是创新药物蛋白早期的表达筛选[4-5]。当然瞬时转染技术的表达量相对较低、放大时较大量的质粒和转染试剂会限制放大工艺的进行等问题,行业也非常关注。本文对瞬时转染技术的细胞系及构建载体、转染试剂、工艺优化及培养放大现状进行综述。
1 表达系统
1.1 HEK293 表达系统
自 1977年Graham 等[6]建立人类胚胎肾(human embryonic kidney cell,HEK)293 细胞系以来,其已成为世界上最常用的瞬时转染细胞株之一。HEK293 细胞具有稳定性好、转染效率高等优点,适于进行瞬时转染放大生产。近几十年来,瞬时转染用的 HEK293 细胞已形成复杂的系统,经过遗传修饰或单克隆筛选形成了商业用或者科研用细胞,有些细胞已经被淘汰不再使用,也有一些细胞需被授权才能使用。
早期 HEK293 贴壁培养时主要使用 DMEM 添加 10% 胎牛血清,倍增时间为 24~36 h,主要适用于小规模培养。随着技术发展,进行大规模悬浮培养时,需使用无 血清、无蛋白、化学成分限定的培养基,在不进行补料情 况下,通常 HEK293 细胞悬浮培养最大细胞密度可达 8 × 106个/ml。一般小量悬浮培养时使用三角瓶,体积 100~300 ml 不等,大量悬浮培养时需使用生物反应器,体积几升到几百升不等[7]。
HEK293 家族有多种不同的细胞系,不同的蛋白在同一细胞系中的表达情况不同,同一蛋白在不同的细胞系中表达情况也不同。如果一个蛋白在一种宿主细胞系中表达水平较差,可尝试其他宿主细胞系进行表达。Geisse[8]总结了 6 种不同的 HEK293 细胞系的特点以及小量表达 14 种不同的蛋白的表达量,均为悬浮培养,6 孔板转染,每孔 2 ml,包括 7 μl 转染试剂、2 μg 质粒、1 × 106个细胞。结果显示,14 种蛋白在不同 HEK293 系统中的表达水平在 1~40 mg/L 之间,比较同一蛋白在 6 种 HEK293 细胞中的表达量差异,HEK293-6E(NRC)的表达量较高。常见的瞬时表达用 HEK293 细胞的特性如表1所示。
1.2 CHO 表达系统
最早的 CHO 细胞是 1956年由 Theodore Puck 从来源于一个部分同系交配的中国仓鼠的卵巢细胞分离获得的一个自发永生化的成纤维细胞群[9]。CHO 细胞为上皮贴壁型细胞,具有不死性,可以传代百代以上,是生物工程上广泛使用的细胞。另外,CHO 属于成纤维细胞,是一种非分泌型细胞,它本身很少分泌 CHO 内源蛋白,因此对目标蛋白分离纯化工作十分有利。哺乳动物细胞表达可形成有活性的二聚体,具有糖基化的功能,是表达复杂生物大分子的 理想宿主。目前,重组蛋白生产上通常使用的 CHO 细胞系有 3 种:①从 1957年得到的 CHO 细胞群通过单细胞克隆得到的 CHO-K1(即野生型 CHO 细胞),CHO-S 为 CHO-K1 驯化后的悬浮细胞;②敲除 CHO-K1 的二氢叶酸还原酶(DHFR)等位基因得到的CHO-DXB11;③通过电离辐射 CHO 细胞群得到两个 DHFR 等位基因都被敲除的CHO-DG44。虽然 CHO 细胞还有很多其他的衍生细胞系,但是目前进行 CHO 细胞系的改造,多以这 3 种为初始细胞。目前市面上商品化的 CHO 细胞图谱如图1所示,常见的瞬时表达用 CHO 细胞的特性如表2所示。
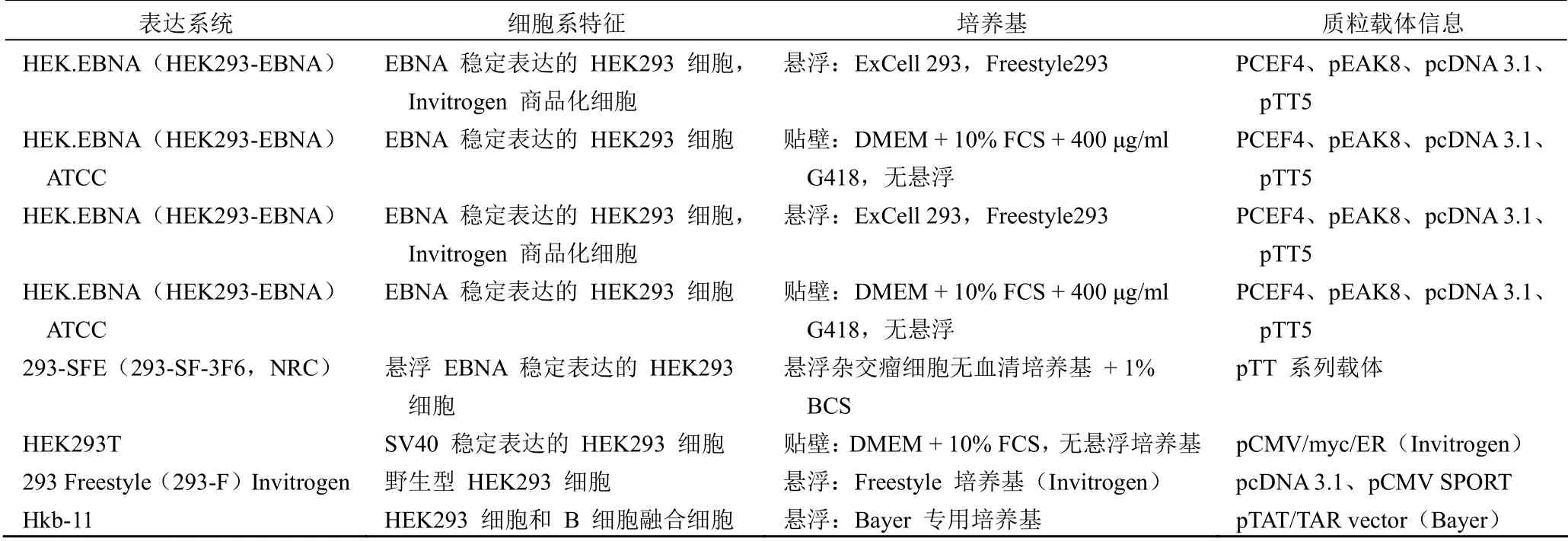
表1 瞬时表达用 HEK293 细胞系和表达系统汇总[8]
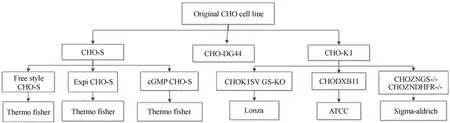
图1 商品化 CHO 细胞系图谱

表2 瞬时表达用 CHO 细胞系和表达系统汇总[10]
2 转染试剂
目前,将外源 DNA 导入哺乳动物细胞的方法大致可分为两大类,即生物方法和物理化学方法。生物方法主要以病毒作为载体,通过病毒感染的方式将外源 DNA 导入到细胞中,其中以逆转录病毒及腺病毒转染系统最为常用。物理化学方法中常用的有磷酸钙法、脂质体介导的转染、显微注射、电穿孔,以及最近出现的以高分子聚合物为载体的基因传递技术。其中最常用的是化学方法,磷酸钙、聚乙烯亚胺(PEI)、脂质体等化学试剂较为常用。
2.1 磷酸钙
磷酸钙是使用超过 30年的哺乳动物细胞转染试剂[11],可用于 HEK293 细胞转染。此方法操作简单,主要包括 2 个步骤:① DNA 质粒和氯化钙溶液混合;②加入磷酸盐缓冲液形成 CaPi-DNA 复合物。Coonrod 等[12]发现,转染后 1 h,质粒 DNA 已经到达细胞核周围区域,当进行有丝分裂细胞核膜溶解时,质粒进入细胞核。Batard 等[13]使用叠氮溴乙锭和荧光肽核酸标签标记质粒,发现每个细胞可以转进约 1 000 000 个质粒,加入培养体系的质粒,只有 5% 可转进细胞核内。
磷酸钙转染,CaPi-DNA 复合物的形成是动态可逆的过程,转染的过程需要注意多个参数,如细胞密度、磷酸盐缓冲液的 pH、质粒浓度、氯化钙浓度、磷酸盐浓度等。尽管磷酸钙转染已可以放大到 100 L 的规模,但是也存在着较 大的缺点:一是需要添加血清和白蛋白以降低 CaPi 的毒性,二是需要换液,所以目前此方法应用并不广泛。
2.2 PEI
2.2.1 作用原理 目前使用最广泛的阳离子聚合物转染试剂是 PEI。PEI 制备简单,价格便宜,有线状和枝状两种商业试剂可选,是瞬时转染放大转染试剂的不二选择。自 19世纪70年代发现 PEI 可以结合 DNA 质粒,直到 20年后,PEI 才真正用于哺乳动物细胞转染,成为非常有潜力的非病毒质粒载体试剂。由于 PEI 带正电荷,与带负电荷的 DNA 结合形成带正电荷的 PEI-DNA 复合物,可以与带负电荷的细胞表面结合。PEI-DNA 复合物通过胞吞作用进入细胞内部形成内涵体,之后一部分从内涵体中逃逸进入细胞核内,未逃逸的进入溶酶体被降解,无法入核的 DNA 会在 100 min 内被胞浆中的 DNA 酶降解(图2)[14-15]。每毫升转染试剂和质粒混合物形成约 1 × 1010个 DNA/PEI 复合物,大小为 300 nm 左右。经过 15 min 孵育,转染时每个细胞进入约 250 个 DNA/PEI 复合物[16-17]。
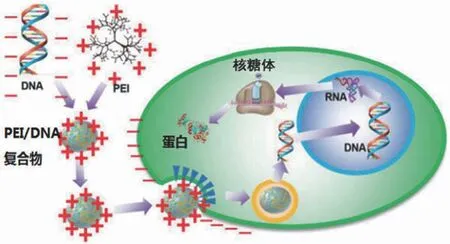
图2 PEI 转染机制
2.2.2 不同 PEI 的比较 枝状的 800 kD PEI 是首次报道的可用于多种细胞转染的试剂,枝状的 25 kD PEI(25B)用于 HEK293 细胞大规模瞬时转染,其转染效率较枝状 2 kD、600 kD、800 kD 或线状 22 kD PEI(22L)的高[18]。之后比较了枝状 70 kD、50~100 kD、25 kD PEI 和线状 25 kD PEI(25L),结果表明 25B 和 25L 的转染效率较高,适合于哺乳动物细胞转染,但是 25L 比 25B 更适用于悬浮哺乳动物细胞 HEK293 和 CHO 转染。Delafosse 等[19]比较了 3 种商品化的 PEI 转染试剂 25 kD LPEI、40 kD PEI-Max、PEI pro,转染 HEK293 和 CHO 细胞,PEI pro 的转染效率低于 25 kD LPEI、40 kD PEI-Max,PEI pro 的毒性最强。经过优化,PEI-Max 的表达量优于 25 kD LPEI。
在 HEK293 细胞,无论是使用摇瓶转染还是大规模的 Wave 波浪生物反应器转染,PEI 介导的转染效率均在 60% 左右。在 CHO 细胞,PEI 介导的转染相对数据较少,转染效率在 40%~60% 之间。
PEI 介导的瞬时转染中 DNA 和 PEI 比例一般为 1:2~1:3(W/W),提高转染试剂比例会提高转染效率,但是随之细胞毒性也会增加。另外转染时的细胞密度、DNA-PEI 聚合物的大小、培养基的组成等都会影响转染效果[11]。
2.3 脂质体
阳离子脂质体易穿透细胞膜,转染效率要明显高于其他转染试剂,因而也广泛用于瞬时转染,但因其化学合成不易,商业化常用的脂质体如 Lipofectamine 价格较高,远贵于其他化学转染试剂,因此只适合于小量瞬时转染。目前最常用的脂质体转染体系是将阳离子脂质体与 DNA 溶液混合,以形成 DNA 夹在脂质双分子层之间的结构。
HEK293 细胞是非常适合进行瞬时转染的细胞,很容易接收外来 DNA,在合适的转染条件下,脂质体转染效率可达 80% 以上,使用商品化罗氏的 FuGene HD 或者 Invitrogen 的 Lipofectamine2000 的转染效率甚至可达 90% 以上。但是传统的 CHO 细胞的转染效率相对较低,只有 40%~60%。近年来 Thermo Fisher 公司新开发的 Expi293F 和 ExpiCHO 瞬时转染系统的转染效率和表达量有了较大的提升,但是商品化的转染试剂盒培养基价格较贵,不太适用于产业化放大,Jain 等[20]比较了用 Expi293F 和 ExpiCHO 表达系统表达 14 种不同蛋白的表达水平,结 果表明 ExpiCHO 表达系统的表达量优于 Expi293F,不同类型的蛋白,表达量差异比较大,但即使是同一亚型的抗 体,表达量也有较大差异,ExpiCHO 表达 4 个 IgG 的 表达量在 84~3271 mg/L,表达 3 个双特异性抗体的表达量在 75~398 mg/L,表达 5 个融合蛋白的表达量在 68~894 mg/L。
3 瞬时转染优化
3.1 DOE 实验
瞬时转染优化首先考虑的就是影响瞬时表达的因素,主要包括转染试剂的类型和浓度、DNA 的浓度、孵育时间、细胞类型、培养基类型、细胞代次、转染时细胞密度等。这些因素必须综合考虑,才能达到最佳的转染条件。最常用的优化瞬时转染表达体系的方法是 DOE 实验,可以在减少实验次数的情况下,应用生物学统计学方法得到较好的结果。Vink 等[21]建立了一种稳定高效瞬时转染系统表达抗体,利用 Freestyle 293-F 表达人重组抗体 IgG 和 Fab,通过 Design-Expert 软件进行 DOE 设计,优化质粒比例,使表达量从平均的 30 mg/L 提升到 400 mg/L。
3.2 降温
降温也是常用的提升 CHO 表达系统蛋白产量的方法,从常规的 37 ℃ 培养,到转染后降低至 30~32 ℃。降低温度可以使细胞停留在 G1 期,降低代谢速率,同时提高蛋白产量[22-23]。由于生物反应器具有精确的温度控制系统,因此很容易进行放大。据报道,已经成功放大至 50~100 L[24]。
3.3 添加化学复合物
加入化学复合物是一种常用的提高转染效率的方法。最常用的是组蛋白去乙酰化酶(histone deacetylase,HDCA)抑制剂,通过解除转录抑制来提高重组蛋白表达量。一般在转染后 4 h 加入,此时 DNA 已进入细胞核内,转录刚刚 开始。最常用的 HDCA 抑制剂是丙戊酸和丁酸钠[25]。也有一些试剂可以提高细胞膜的通透性,进而提高转染效率,如 DMSO 和乙酸钾,一般在转染前添加[26]。
3.4 共表达调节蛋白
共表达调节蛋白也是一种常用的提高表达量的方 法[27]。在 HEK293 转染表达目的蛋白时,共转染 3 个调节蛋白 P18、P21、αFGF,使活细胞密度和抗体分泌提升。Zustiak 等[28]共转染了抗细胞凋亡基因 bcl-xL,以降低细胞凋亡,提升蛋白表达。Zhang 等[29]通过共表达凋亡基因 Bcl-xL 和 Mcl-1,提高了 PD-1 抗体在 CHO 细胞中的 表达。
4 瞬时转染的放大
关于瞬时转染的放大报道较少,原因可能是瞬时转染技术目前还停留在科研阶段,生产企业采用的较少。瞬时转染的放大主要采用三角瓶、Wave 波浪生物反应器和搅拌式生物反应器。某些制药公司也开始尝试进行瞬时转染的放大,从 0.1 L 开始,转染体积甚至到 80~100 L 规模[30-31]。瞬时转染的表达水平与蛋白的结构有很大关系,很难进行直 接对比。一般情况下,使用转染试剂 PEI,无论是 HEK293 细胞还是 CHO 细胞,表达水平均在 1~80 mg/L。重组 抗体 IgG 表达时,使用 3~150 L 不同体积的反应器,不论是批式培养或者流加补料培养,抗体表达水平均在 2~80 mg/L[26]。也有表达量较高的报道,HEK293 瞬时转染达到 1~2 g/L,ExpiCHO 瞬时转染表达量达到 2 g/L[32-33]。在瞬时基因表达工艺的放大中,需确保工艺放大前后细胞的活性、目的蛋白的产量与质量等保持不变[34-35]。不同的培养规模下,温度、pH、流加策略一般不改变,但搅拌速度和通气速率等因素受体积影响,需要遵循一定的变化准则。转染结束后,在蛋白表达过程中添加营养物质以延长蛋白的表达过程,提高重组蛋白表达量,如加入水解蛋白、进行分批补料等。工艺放大(缩小)通常采用相同单位体积 功率 P/V、传质系数 kLa 等作为准则。Gutiérrez-Granados 等[36]对使用 PEI 进行 HEK293 和 CHO 细胞瞬时转染放大的工艺进行了总结,包括生物反应器放大时的参数控制,转速、pH、DO 等物理参数以及转染前细胞密度、质粒量和质粒与转染试剂的比例等,从而实现放大的产能增加,质粒与转染试剂的最优比从 1:1.5~1:4.5 不等,表达量从 1 mg/L~1 g/L 不等。
5 展望
瞬时转染表达技术主要用于快速获得毫克级别到克级别的蛋白。尽管现在稳定细胞株的构建筛选已经非常成熟,且表达量较高,但是对于一些特殊的应用,仍需要瞬时转染技术,如基因治疗、体外诊断试剂、个性化药物、VLP 蛋白、疫苗等的生产[37-41],甚至还用来大量表达膜蛋白[42]。影响瞬时转染表达的因素主要有以下几个方面:细胞系的选 择、表达载体的选择、质粒 DNA 的质量、转染试剂、培养基和补料方法[43],需要同时进行多个方面的优化,才能实现瞬时转染的高表达。经过多年的技术发展,瞬时转染关键参数的优化取得了一定的成绩,如细胞系、表达载体、转染试剂、培养基等,且由于表达载体和培养基方面的研究 进展,目前 CHO 重组蛋白的瞬时表达水平已经达到1~2 g/L,虽与稳定转染表达的 3~10 g/L 仍有一定差距,但瞬时转染技术的自身优势也在促使其不断的发展。

