关于我国细胞治疗产业发展现况和监管思路的浅见(上)
高建超
近年来,国内外创新性生物治疗技术进展迅速,包括细胞治疗方法在内的新技术、新应用、新成果不断涌现,在恶性肿瘤、炎症、自身免疫性疾病、代谢性疾病、再生医学等多个领域显示出巨大的应用潜力,世界主要发达国家均将细胞和基因治疗作为医药领域重点支持和发展的方向,我国也制定了一系列加快生物医药产业发展的方针和政策,以满足广大患者对新技术、新疗法的迫切需求。随着我国科研投入和技术实力的不断加强,国内开展的细胞和基因治疗临床研究逐年增加,对于相关产品产业化和临床应用的呼声也越来越高。但另一方面,行业内对细胞治疗的医疗技术或药品属性如何认定、新产品如何转化为临床应用等也存在较大争论,在一定程度上阻碍了行业的持续健康发展,也限制了产业投资的热情和积极性。
1 细胞治疗的分类和风险特点
细胞治疗的分类方式非常多样,作用原理包括细胞免疫、再生医学等;根据供体来源分为自体细胞、同种异体细胞和异种细胞等;根据细胞来源和分化潜能分为干细胞、前体细胞和成熟体细胞等;体外操作方法包括常规培养、定向诱导分化、基因编辑、遗传修饰等[1]。目前最常见的体细胞治疗是肿瘤免疫细胞治疗,主要包括树突状细胞/细胞因子诱导的杀伤细胞(DC-CIK)[2]和过继性细胞治疗(adoptive cell therapy,ACT)等,其中 ACT 包括细胞因子诱导的自然杀伤细胞(CIK)、肿瘤浸润淋巴细胞(TIL)、嵌合抗原受体 T 细胞(CAR-T)以及 T 细胞受体嵌合 T 细胞(TCR-T)等[3];干细胞治疗包括胚胎干细胞(ESC)、组织特异性前体干细胞(TSPSC)、间充质干细胞(MSC)、脐带干细胞(UCSC)、骨髓干细胞(BMSC)和诱导多潜能干细胞(iPSC)等[4]。
不同类型细胞制备工艺的复杂程度、体内生物学特性存在显著差异,在临床应用中的安全性风险也有明显不同。非同源性异体或异种使用、外源基因片段的导入、体外诱导分化、全身性作用、高分化潜能等因素均可能影响细胞回输后的生物学特性。此外,复杂的体外操作、培养过程使用多种外源因子或试剂等均可能增加细胞质量控制的难度,进而提高临床应用的安全性风险。例如,DC-CIK 是目前国际上研究和应用最广泛的细胞疗法之一,制备工艺和外源性干预相对简单,在部分临床研究中取得了较好的疗效,且安全性总体良好[5-6]。相较之下,CAR-T 细胞表达了外源性基因片段,体外操作的复杂性远高于 DC-CIK,在明显增强 T 细胞体内杀伤特异性和活力的同时,细胞因子风暴(CRS)、神经毒性(CRES)等严重不良反应的发生频率也显著提高[7-8]。
干细胞研究和临床应用方面,除造血干细胞移植的临床应用已经成熟外,其他类型的干细胞疗法多处于研究阶段,需要开展严格设计的临床试验证明其临床优势[9]。干细胞疗法的安全性问题主要来源于回输后未按预期分化或发挥作用导致靶器官功能恶化或破坏[10],以及其自我复制和多向分化能力所导致的致瘤性风险[11-12]。
2 国际上细胞治疗研究的现状
2.1 干细胞
目前,国际上绝大多数细胞治疗临床研究是利用各种类型的干细胞或前体细胞开展的,适应证涵盖了糖尿病、脑血管病、心衰肝硬化、器官或骨髓移植、脊髓损伤、帕金森症、骨关节炎、自身免疫性疾病、遗传代谢病等多种类型的疾病。全世界在“clinicaltrials.gov”和世界卫生组织临床试验登记平台(ICTRP)上登记的干细胞临床研究已经超过 6000 项,临床试验主要分布在北美、西欧、东亚和中亚等地区。全球干细胞临床研究呈现出明显的“一超多强”格局:截至 2019年2月底,美国 开展的临床研究超过 2800 项,临床研究的数量远超过其他国家和地区,欧盟和中国大陆仅次于美国,分别登记超过1300 项和 500 项研究,加拿大、韩国、日本等国家的临床研究也比较活跃(图1)。近年来,国际上每年新增的干细胞临床研究数量稳定在 400 项左右,其中我国每年临床研究数量稳步增加,占全球干细胞临床研究的比例不断提高(图2)。

图1 世界主要国家和地区干细胞临床研究数量
近七成临床研究中使用的干细胞是来源于骨髓、外周血和脐带的造血干细胞及间充质干细胞。细胞最常见的体外操作方法是培养扩增,占四成左右,其他较复杂的体外操作包括细胞纯化、药物处理或基因修饰等[13]。尽管不同类型的干细胞在骨髓移植、眼部烧伤[14]、膝骨关节炎[15-16]、心衰[17]、神 经系统疾病[18]等少数疾病领域展示了不同程度的治疗潜力,但总体上,大多数干细胞治疗临床试验仍处于早期概念验证阶段,尚未通过设计严格的临床试验证实其临床疗效[9,19],不同组织来源干细胞、不同给药途径的优势和不足,临床使用禁忌等也需要进一步研究[20]。
2.2 体细胞
虽然体细胞治疗的研究历史相对于干细胞治疗更加悠久[21],然而,无论是全球的研究数量还是不同国家和地区的研究活跃程度,体细胞治疗长期以来都远不及干细胞。近十年来,随着 CAR-T、TCR-T 代表的免疫细胞治疗的兴起,免疫细胞临床研究数量迅速增加,特别是 CAR-T 细胞临床研究以接近 40% 的平均年增长率呈爆发式增加(图3)。以 CAR-T、TCR-T、TIL 和 CIK 等最常见的免疫细胞疗法为例,目前全球在 clinicaltrials 上登记的临床研究数量已经超过 900 项,其中美国(41%)和中国(36%)的临床研究规模远超过其他国家,全球免疫细胞临床研究呈现出“两强相争”的格局。中美两国开展的免疫细胞临床研究都以 CAR-T 细胞为主,靶点的选择也较为类似,特别是在淋巴和造血系统恶性肿瘤领域[22]。在其他类型的免疫细胞研究方面,美国开展的 TIL 和 TCR-T 等肿瘤过继性细胞免疫疗法的临床研究非常活跃,而我国主要集中在 CIK 等细胞的临床研究(图4)。
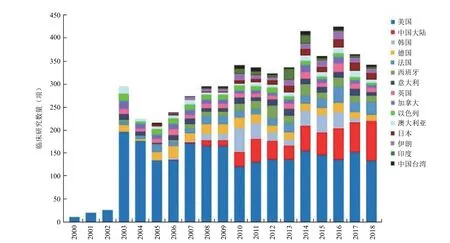
图2 部分国家或地区干细胞临床研究数量的变化情况

图3 全球免疫细胞临床研究数量的变化情况
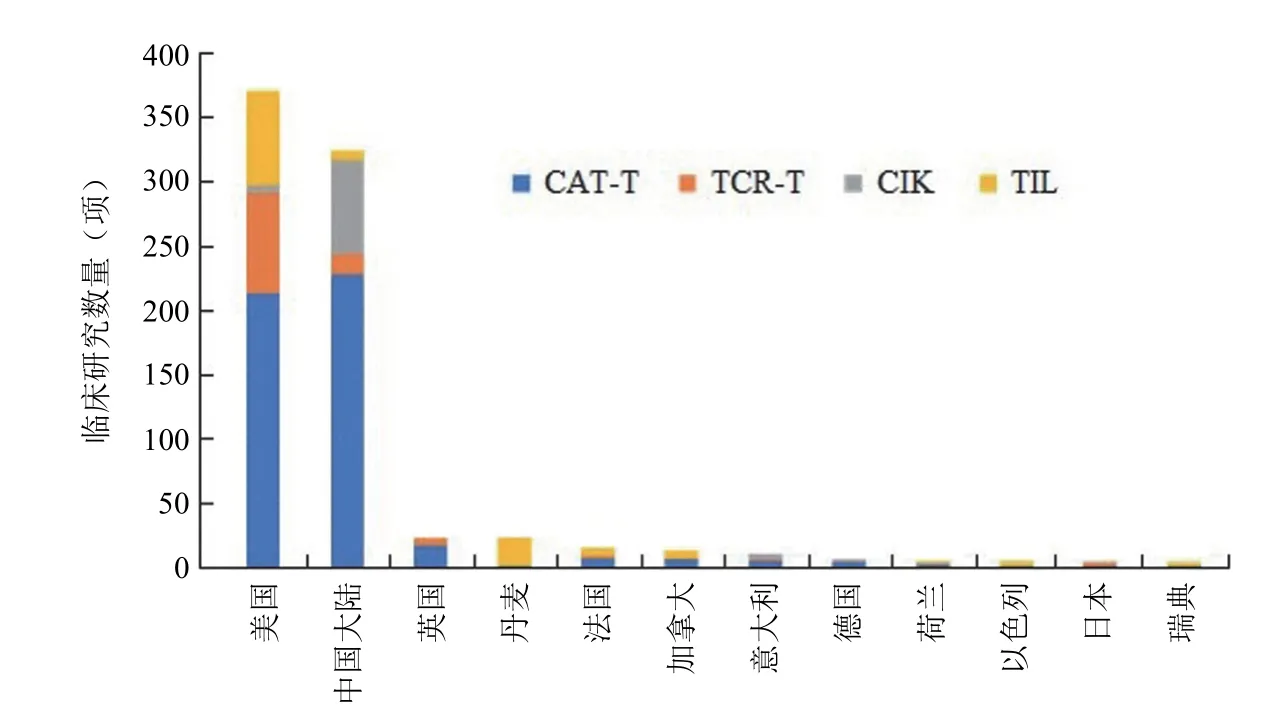
图4 部分国家或地区的免疫细胞临床研究情况
免疫细胞治疗的适应证集中在恶性肿瘤领域,尽管临床研究规模不及干细胞,但疗效方面取得的进展非常显著,特别是在淋巴和造血系统恶性肿瘤方面,CAR-T 细胞在复发难治性 B 细胞白血 病[23]、淋巴瘤[24]或骨髓瘤[25]患者中均取得了明显优于现有治疗的临床疗效。美国研发团队在该领域的成功实践带动了全球的临床研究,同时主导了欧洲、日本等地区在该领域的临床研究。我国 CAR-T 细胞临床研究数量已经超过美国,成为世界上开展 CAR-T 细胞临床研究数量最多的国家。
3 我国细胞治疗临床研究的监管情况
1999年国家药监局发布《新生物制品审批办法》,将体细胞治疗纳入监管范围。2002年、2005年和 2007年国家药监局对《药品注册管理办法》历次修订中,均将基因治疗、体细胞治疗及其制品纳入监管范围。2009年以前,我国批准了骨髓间充质干细胞等 7 个干细胞产品的临床试验[26]。
2009年,卫生部发布了《医疗技术临床应用管理办法》,将自体干细胞和免疫细胞列入第三类医疗技术,允许通过能力审核的医疗机构开展第三类医疗技术的临床应用。但直到 2015年国家卫生计生委取消第三类医疗技术的准入审批[27],没有任何医疗机构获准开展自体干细胞或免疫细胞的临床应用。
2015年8月,国家卫生计生委和食药总局共同组织制定了《干细胞临床研究管理办法(试行)》,规定医疗机构开展干细胞临床研究前需向国家卫生计生委及食药总局备案,并可将已获得的临床研究结果作为技术性申报资料提交并用于药品评价。截至 2018年底,通过卫健委备案开展干细胞临床研究的医疗机构有 110 余家,27 个干细胞临床研究项目按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48 号)的规定完成了备案。
按照药品监管要求开展的临床研究方面,2017年底,国家食药总局药审中心发布了《细胞治疗产品研究与评价技术指导原则(试行)》,再次明确了包括干细胞、体细胞在内的细胞治疗产品可以按照药品途径进行转化应用。此后,我国批准了多个细胞治疗产品的临床试验,细胞类型包括间充质干细 胞、扩增活化淋巴细胞、CAR-T、TCR-T、多抗原自体免疫细胞等。其中值得关注的是,异体脂肪来源间充质祖细胞作为首批在卫健委完成备案的干细胞临床研究项目,在药品注册申报过程中利用和参考了前期临床研究的数据,并获准直接开展 II 期临床试验,为加强干细胞临床研究备案管理与干细胞产品注册申报的衔接进行了有效探索。
近年来我国干细胞和免疫细胞等临床研究数量和规模不断增加,但其中绝大多数是由研究者发起的临床研究,通过卫健委备案的干细胞临床研究、或者国家药监局批准开展的干细胞或体细胞临床试验数量较少。
4 我国细胞治疗产业的主要矛盾和存在的问题
目前,我国干细胞和免疫细胞临床研究的规模、每年新增研究数量仅次于美国,已成为世界上细胞治疗临床研究最活跃的地区之一,并在部分疾病领域取得了一定的研究成果,但总体上,患者的临床获益及产业发展状况与国际先进水平仍有明显差距。我国现阶段细胞治疗产业发展的主要矛盾是患者对新疗法的迫切临床需求与质量稳定、安全可控、疗效确切的细胞产品的供给不足之间的矛盾,主要表现在以下几个方面:
4.1 细胞治疗监管体系建设滞后于产业发展速度
4.1.1 转化应用路径多次变化,影响产业投入的决心 近十余年来,我国细胞治疗的监管思路几经变化,体细胞和自体干细胞疗法在很长时间内同时存在“药品”和“医疗技术”两种监管归口的争议。除了极少数始终按药品注册相关要求开展研究的细胞疗法外,绝大多数细胞疗法通过医疗技术的形式开展研究和临床应用,由于缺乏明确的行业约束和技术评价标准,在临床转化应用过程中产生了较大的混乱,阻碍了产业的规范健康发展。此外,干细胞治疗相关技术不再按第三类医疗技术进行管理后[28],由于缺少转化应用的路径,也在一定程度上影响了产业投入和转化研究的热情。2017年食药总局发布《细胞治疗产品研究与评价技术指导原则》并再次明确了细胞治疗产品可以按照药品上市,增强了产业界对细胞治疗转化应用的信心和 决心。
4.1.2 缺少研究指南等规范性文件,技术评价体系尚不完善 由于细胞产品的组织来源、分化潜能、体内作用等较为复杂,研发团队对细胞生产工 艺、质量研究、药理毒理等的研究水平、设计和开展临床试验的能力、安全性风险控制能力等都会对细胞产品的临床疗效产生重要影响。我国既往发布的细胞治疗相关技术指南和评价原则较少,大多数临床前及临床研究的设计和实施水平主要依赖于研究团队的科学素养和自我约束。由于行业发展缺少规范,转化应用的技术评价体系尚不完善,研究水平良莠不齐,阻碍了产业的健康发展和技术能力的提高。近年来,国家药监局发布了《细胞治疗产品研究与评价技术指导原则》,CDE 也针对审评中发现的问题适时地发表了若干观点或考虑,对细胞治疗产品的研究和申报发挥了积极的引导作用。
4.1.3 细胞来源的伦理审查对监管提出全新的挑战 随着生物治疗技术的进步,异体细胞产品在细胞治疗中的地位越来越重要,异体细胞的来源包括供者捐献的骨髓、外周血、脐带、脂肪甚至胚胎组织等多种人体组织器官,涉及复杂的伦理和法律问题。如何在确保捐献人知情且获得其自愿同意的前提下筛选合格的供者来源,并严格阻断产业化过程中可能出现的人体组织器官买卖和变相买卖的发生,对监管提出了全新的挑战。目前,绝大多数细胞治疗产品是利用成熟体细胞或成体干细胞制备的,为规范产业有序健康发展,我国亟待制定成体细胞研究与产业化应用相关的伦理准则。
4.2 临床研究的规范性有待提高,转化研究缺少突破性进展
我国干细胞基础研究的论文量和专利数都已经位居世界前列[29],为干细胞治疗积累了丰富的人才和技术资源,临床转化应用的潜力巨大。近年来我国干细胞临床研究增长迅速,但发展一度较为混乱,以投机逐利为目的的临床研究数量较大,研究的规范性和严谨性不高,曾严重影响了干细胞临床研究和转化的有序开展[30-31],导致干细胞基础研究与有效的临床转化应用之间存在一定的落差。我国干细胞治疗已在视网膜黄斑变性[32]、移植物抗宿主病、急性心肌梗死[33]等疾病取得了一定的进展,但总体上,转化研究能力与美国、欧盟等有明显差距。
在免疫细胞治疗方面,我国存在比较突出的靶向 CD19 CAR-T 研究扎堆的情况,已发表的 CAR-T 治疗淋巴造血系统恶性肿瘤研究结果中的最佳缓解率与美国接近,但存在研究人群规模较小、患者既往治疗和肿瘤负荷不明、中位剂量分散、缺少高质量同行审议研究等问题[22]。对于判断恶性肿瘤患者的临床获益,持续缓解与短期疗效相比更 加重要,但我国的临床研究在长期随访方面的数据普遍缺失,缓解后短时间内复发的情况比较普遍,因此,国内临床上倾向于将 CAR-T 细胞定位为造血干细胞移植前的桥接治疗[34-35]。美国 FDA 已经批准的两个 CAR-T 细胞治疗产品,诺华的 Kymriah 和 Kite 公司的 Yescarta 分别在复发难治性 B 细胞白血病和淋巴瘤患者中取得了令人振奋的长期疗效[36-37],展示了 CAR-T 细胞治愈淋巴造血恶性肿瘤的可能。此外,CAR-T 作为安全性风险很高的细胞疗法,对于研究者的安全性风险意识和临床处置经验都有较高要求,我国部分临床研究在知情同意、不良反应处置等环节不够规范,甚至已经有 CAR-T 研究过程中患者死亡导致法律诉讼的案例报道。
4.3 产业链存在较多薄弱环节
国内通常将细胞治疗产业链分为上游的细胞来源和生产原材料;中游的细胞生产技术研发以及下游的临床治疗。尽管近年来我国细胞治疗产业发展较快,但产业链上、中、下游环节均存在较多的薄弱环节。
上游细胞来源和生产原材料方面,除了造血干细胞,干细胞治疗产品的组织来源还包括脐带、脂肪、流产胚胎组织等,国内缺少上述组织采集、运输和保存的机构,组织捐献的知情同意和伦理审查要求也有待明确。在基因修饰细胞方面,使用的关键原材料除细胞外还包括质粒、病毒载体等,美国细胞治疗企业使用的病毒载体多由专门的合同研发生产服务商(CDMO)提供,而国内临床研究用的病毒载体主要来自于实验室内小规模包装,病毒载体的均一性、滴度、纯度、感染效率等质量水平与美国存在较大差距,在较大程度上影响了基因编辑效率和细胞终产品的疗效和安全性。此外,很多细胞培养过程中需使用人 AB 血清,国内人 AB 血清仅限于医疗机构内采集和使用,缺少商业化供应途径。
中游的细胞生产方面,国内很多临床研究中使用的细胞是在医院或研究机构的实验室内生产,符合 GMP 生产条件的较少,操作人员 GMP 意识普遍比较薄弱,在原材料供应商审计、细胞工艺开发、质量研究、放行检验等环节均存在较多不足,导致我国细胞治疗产品的质量和工艺稳定性与国际先进水平有明显差距。
下游的临床研究方面,虽然我国每年新增细胞临床研究数量不断增长,但在卫健委备案的干细胞临床研究项目仅百余项,大多数临床研究项目未经过监管机构的审查,在研究方案的科学性、合格受试者筛选、治疗过程的规范性等方面均存在不足。此外,我国的 CAR-T 细胞临床试验相对于美国有增速快、数量大的特点,同时存在研究人群规模小、试验设计较为激进、安全性风险暴露不足等问题[38],上述因素均影响对细胞治疗产品疗效和安全性的评价。
注:本文仅代表作者个人观点,不代表供职单位立场

