猪繁殖与呼吸综合征病毒、圆环病毒2型和衣原体混合感染引起母猪流产的诊断与防治
康新华,张 辉,张维新,滚双宝,郭慧琳,韩庆彦
(1.甘肃省动物疫病预防控制中心,甘肃兰州 730046;2.通渭县什川镇畜牧兽医站,甘肃通渭 743308;3.甘肃农业大学,甘肃兰州 730070)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)俗称蓝耳病,是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV) 引 起的,以母猪繁殖障碍和仔猪肺炎为主要特征的疾病。PRRSV具有高变异性和免疫抑制性,给养猪业带来巨大困扰。猪圆环病毒 2型(porcine circovirus type 2,PCV2)在我国流行广泛,可造成猪的多种病变和综合征,临床上常与其他病原形成混合感染。
衣原体病(chlamydiosis)是由衣原体(Chlamydia)引起的一种接触性人兽共患传染病。猪衣原体有2个属4个种,只感染猪。猪感染衣原体后多发生结膜炎、肺炎、脑炎、多发性关节炎等症状,母猪感染后主要表现流产,且多发于初产母猪,而经产母猪孕初期无异常,后期多发生流产、早产,产死胎、木乃伊胎和弱仔,所产弱仔一般在出生数天后死亡。衣原体能以原生小体的形式在环境中存活很长时间,并能够抵御干燥。在猪场内活动的啮齿类动物、鸟类以及禽类等都可能成为本病的自然散毒者。猪衣原体感染病猪的部分临床症状与猪瘟、乙型脑炎、伪狂犬病等疫病相似[1]。
本研究就甘肃省某规模场一起PRRSV、PCV2和猪衣原体混合感染引起的母猪流产进行了诊断,并简述了多种疫病混合感染的防治。
1 发病情况
2018年10月1日起,甘肃省某存栏900头母猪的规模场,每天有1~2头母猪流产,5—8日,每天的流产数量增至3~4头,直至11月初流产才停止,生产恢复正常。不同胎次、不同妊期母猪主要表现为流产,临产母猪表现为产死胎、畸形胎、木乃伊胎(表1),断奶仔猪主要表现关节肿大、肺脏坏死、绒毛心、肾脏出血等症状。流产前母猪表现厌食、体温升高等症状,流产后逐渐恢复采食。自流产发生后,乳猪和断奶仔猪死淘率明显增高,其中平均“死木弱畸”(死胎、木乃伊胎、弱胎和畸形胎)出现率达26.92%(365/1 356),乳猪死淘率达16.55%(164/991),详见表2。

表1 不同胎次和妊娠期母猪流产情况统计
2 病料采集
采样木乃伊胎(正常产期)、死胎(正常产期)、流产胎儿(2头)、自然死亡弱仔(7日龄)共5头的脑、脾脏、淋巴结、肺脏和肾脏等组织病料,根据各自症状及病变进行了猪乙型脑炎病毒(JEV)、PRRSV、伪狂犬病病毒(PRV)、猪细小病病毒(PPIV)、猪瘟病毒(CSFV)、PCV2和衣原体核酸检测。
3 实验室检测
采用RT-PCR或PCR方法进行上述7种病原的核酸检测。各项检测均使用世纪元亨生产的成品试剂盒。检测结果显示,5头猪的PRRSV、PCV2核酸检测均为阳性,4头猪的衣原体核酸检测为阳性,5头猪的JEV、PRV、PPIV、CSFV核酸检测均为阴性(图1)。
4 临床处置
疫情发生后,采取了无害化处理病死猪以及清洁环境、消毒、隔离等措施;对不稳定猪群,在饲料中添加“清瘟败毒散”“扶正解毒散”,同时先后添加替米考星和土霉素;对母猪群,在饲料中增添人工盐,强化接种PCV2和PRRSV疫苗;对仔猪群,将PCV2和PRRSV疫苗由14日龄接种临时改为7日龄半量、28日龄全量接种,同时接种链球菌疫苗和副猪嗜血杆菌疫苗。采取上述措施后40 d,疫情得到有效控制。
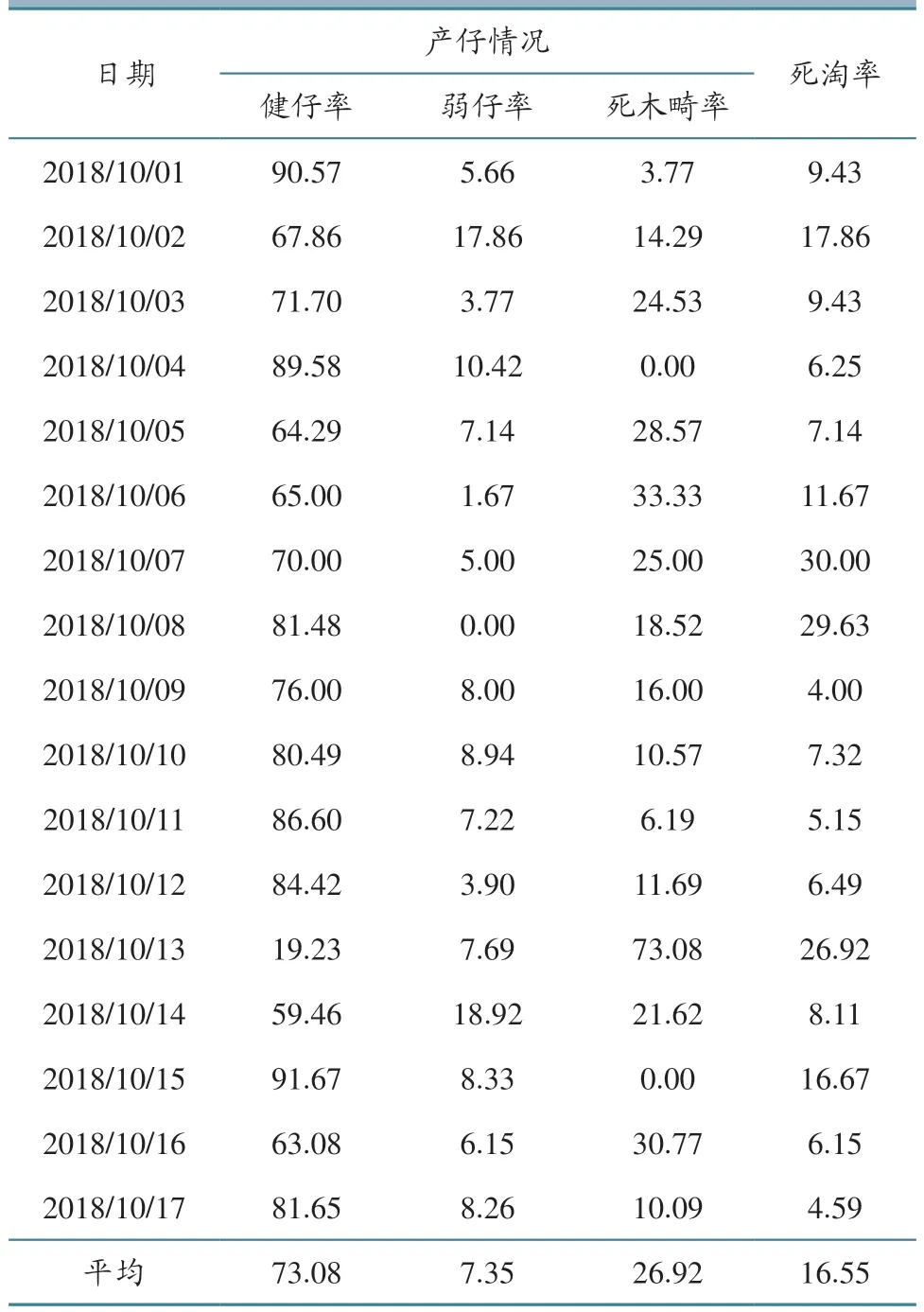
表2 流产期间全场日产仔和健康仔猪死淘情况统计 单位:%
5 讨论
通过临床症状及实验室检测,确定该规模场母猪流产的主要原因可能是PRRSV、PCV2和衣原体造成混合感染。
5.1 关于猪衣原体感染
近年来,猪衣原体病已经成为仅次于猪瘟、PRRS等高危性繁殖障碍性疾病的常见病种之一。1996年有研究发现,育肥猪衣原体肠道感染率高达99%[2-3]。邱昌庆等[4]调查研究发现,1986—2002年我国17个省份中,猪衣原体抗体阳性率在40% 以上的有7个,其中甘肃省最高,为42.2%。
衣原体对外界环境的抵抗力较强,一旦感染猪群,就很难被彻底净化。猪群可通过吸入或者摄入受污染的饲料感染衣原体,感染发生在子宫内时,还可通过配种发生垂直传播。衣原体对包含氧化剂的广谱消毒剂、酚类、氯制剂、季铵盐化合物以及一些清洁剂较敏感[6]。

图1 JEV、PRRSV、PRV、PPIV、CSFV、PCV2和衣原体核酸检测结果
5.2 关于免疫抑制病感染
PRRSV和PCV2是制约养猪业持续健康发展的主要病原。临床上,二者混合感染现象普遍存在,PRRSV和PCV2都属于免疫抑制性病毒,控制难度大,已成为世界养猪业的一大难题,其混合感染会导致猪群免疫力下降,从而导致对其他疫病的易感性增高[7]。
这两种病毒可通过相互作用加重病情。张盼等[8]研究表明,PCV2主要通过侵害机体单核细胞及巨噬细胞等免疫细胞,造成机体免疫抑制,使动物机体免疫应答能力下降,从而无法产生高水平抗体,而PRRSV感染则可使猪只的免疫调节紊乱。王天户等[9]研究表明,PRRSV和PCV2混合感染早期会引发比单独感染更严重、持续时间更长的细胞凋亡,后期主要表现为坏死性病变,导致更严重的免疫抑制。
此外,PRRSV对PCV2的复制有增强作用,并可增加组织样品中PCV2的抗原水平[10],导致更严重的PCV2联合损伤[11-12]。PRRSV与PCV2混合感染更加严重抑制了宿主的免疫反应,增强了猪只对其他病原的易感性。PCV2还可诱导淋巴系统中B细胞凋亡,严重侵害猪只免疫系统,造成感染猪免疫功能降低,易感性增加[13]。因此,为保证养猪业健康持续发展,疫病的综合防控尤为重要。
5.3 混合感染防控
5.3.1 衣原体防控 怀疑猪场发生衣原体感染时,对于表现出临床症状的猪要进行隔离,对其他未感染的健康猪应避免接触感染猪、其他哺乳类动物以及鸟类的粪便和分泌物等。一般来说,要完全消除或抑制潜伏感染,应通过药敏试验,选择敏感药物。对整个猪场要加强消毒,对于流产排出的胎儿及分娩物要采取合理的无害化处理措施,防止新生仔猪感染[14]。规模场可以制定衣原体免疫程序,发病时采用灭活苗紧急免疫接种[15]。
5.3.2 免疫抑制病防控 要加强生物安全,减少免疫应激,做好防疫管理与疫病监测等综合防控措施,这些都能有效控制免疫抑制性疫病发生[16]。PRRS和PCV2疫苗之间也存在相互作用。研究表明:PCV2疫苗不仅不影响PRRSV疫苗的免疫反应,还可以诱导免疫应答,从而减少PCV2引发的毒血症以及组织损伤等;而PRRSV疫苗不但不能诱导免疫应答,减少由PRRSV引发的毒血症和组织损伤,还会增强PCV2的毒血症和组织损伤。因此,在PRRSV与PCV2混合感染猪中,PRRSV疫苗可能会诱导PCV2复制增强,而PCV2复制的增强会损害免疫系统。鉴于这两种疫苗之间的相互作用,在日常生产中,制定合理的免疫程序是防治混合感染的关键。规模猪场在免疫PRRSV疫苗时,应先检查猪只的PCV2感染状况,只有这样才能有效控制PRRS[17]。此外,免疫抑制性疫病还可以影响其他疫病抗体的产生。杨苗等[18]研究表明,PRRSV和PCV2混合感染会对CSFV抗体产生负面影响,从而影响免疫效果。因此,日常生产中,消除免疫抑制至关重要。

