原发免疫性血小板减少症患者外周血中Th9/Th17的水平及意义
(川省阆中市人民医院血液内科,四川 阆中 637400)
免疫性血小板减少症(primary immune thrombocytopenia,ITP)是一种自身免疫性疾病,其病理基础为以抗血小板自身抗体介导的自身免疫反应为靶点,加快血小板损伤或对血小板生成造成阻碍,使患者出血风险升高[1]。ITP的病理生理较为复杂,涉及因素较多。此前大量研究报道,ITP发病是由于FC受体介导的巨噬细胞遭到破坏[2-3]。近来,较多研究指出,T细胞也参与了ITP的发病,在T细胞中,T辅助细胞(T helper,Th)在免疫调节中发挥重要作用,特别在适应性免疫系统中,可能通过分泌T细胞相关的细胞因子参与此过程[4]。免疫调节过程中,Th17/Th9也被证明参与了ITP[5],但关于其在ITP过程中发挥的作用国内未见报道。因此本研究通过检测ITP患者血浆Th17/Th9的含量,探讨其影响ITP的机制,以期为临床研究提供新的治疗ITP的靶点。
1 资料与方法
1.1 一般资料
选取2016年3月至2018年3月本院血液科收治的105例原发免疫性血小板减少症(Primary immunogenic thrombocytopenia,ITP)患者为研究对象,ITP诊断符合《成人原发免疫性血小板减少症诊断与治疗中国专家共识(2016年版)》[6]中标准。根据血小板计数分为活动性ITP组(n=62)和缓解期ITP组(n=43),血小板计数低于30×109/L患者为活动性ITP。活动性ITP组62例,男性29例,女性33例,年龄20~76岁,平均年龄46.83(34.81,54.77)岁,血小板计数为(17.23±3.15)×109/L;缓解期ITP组43例,男性20例,女性23例,年龄19~80岁,平均年龄45.16(37.32,58.05)岁,血小板计数为(132.84±33.76)×109/L;选取同期健康查体者30例作为对照组,男性15例,女性15例,年龄23~72岁,平均年龄44.16(32.11,51.93)岁,血小板计数为(238.64±44.83)×109/L。三组患者年龄(Mann-Whitney U=1.163,P=0.316)、性别(χ2=0.105,P=0.949)比较差异无统计学意义,具有可比性。本研究获得本院医学伦理委员会批准同意。此次研究中所有参与者均知情同意,并签署知情同意书。
1.2 Th9/Th17检测
采集患者外周静脉血4 mL,3 500 r/min离心5 min,分离得血浆,将血浆置于-80 ℃冰箱待测。采用梯度离心法在FIXOLPAQUE PLUS淋巴细胞分离液(美国GE公司)中分离外周血单核细胞(peripheral blood mononuclear cells,PBMC);将PBMC在RPMI-1640培养基中重新悬浮,后接种到24孔板中,每孔1×109/mL,细胞培养用PMA(终浓度50 ng/mL)(英国,Abcam公司),离子霉素(750 ng/mL)(上海源叶生物科技有限公司)和BFA(10 μg/mL)(美国Invitrogen公司),然后将24孔板细胞转移至含5% CO2的培养箱中培养4 h。结束后,将细胞转移至无菌离心管中,离心5 min。细胞悬浮液转至试管中,分别加入抗人IL-9及抗人IL-17抗体(均购自美国Pepro Tech公司),染色30 min,进行分析。以同型抗体作为对照,CD4+IL-9+为Th9细胞,CD4+IL-17+细胞为Th17细胞。
1.3 实时定量荧光PCR法(RT-PCR)测定转录因子PU.1、IRF4、BATF及RORγt水平
加入Trizol溶液提取总RNA。应用核酸蛋白仪和琼脂糖电泳对提取的RNA进行分析。取总RNA 4 μL,82 ℃水浴5 min加入反转录反应液,44 ℃孵育60 min终止,留取产物待用。扩增参数,95 ℃ 10 min,60 ℃ 15 s,72 ℃延伸15 s,72 ℃最终延伸10 min,10 ℃最终保存。基因表达分析采用2-△Ct法测定相对含量,将GADPH设为内参,取Ct值。计算公式为△Ct= Ct(目的基因)- Ct(GADPH)。引物序列见表1。

表1 引物序列
1.4 统计学分析
采用SPSS19.0统计学软件进行统计学分析,血清Th9/IL -9、Th17/IL-17采用均数±标准差表示,多组间比较采用单因素方差分析,组间比较采用Newman-Keuls检验,患者治疗前后血清Th9/IL -9、Th17/IL-17水平采用配对t检验,患者年龄资料以【M(Q1,Q3)】表示,组间比较采用Mann-Whitney U秩和检验;例数资料用n(%)表示,采用卡方检验;采用Pearson卡方进行相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 流式细胞仪检测Th9/Th17在三组中的表达
活动性ITP组、缓解期ITP组及对照组Th9分别为(0.72±0.17)、(0.27±0.09)、(0.32±0.06),三组Th9表达比较差异有统计学意义(F=180.442,P=0.000),活动期ITP组Th9表达明显高于缓解期ITP组及对照组(q=24.797、19.669,均P<0.05),缓解期ITP组与对照组Th9比较差异无统计学意义(q=2.298,P>0.05)。活动性ITP组、缓解期ITP组及对照组Th17分别为(1.21±0.13)、(0.73±0.11)、(0.86±0.09),三组Th17表达比较差异有统计学意义(F=210.054,P=0.000),活动性ITP组Th17明显高于缓解期ITP组及对照组(q=26.338、20.891,均P<0.05),缓解期ITP组与对照组比较差异无统计学意义(q=2.441,P>0.05)。Th9/Th17在活动性ITP患者中异常表达,在缓解期患者中Th9/Th17细胞恢复至正常水平。
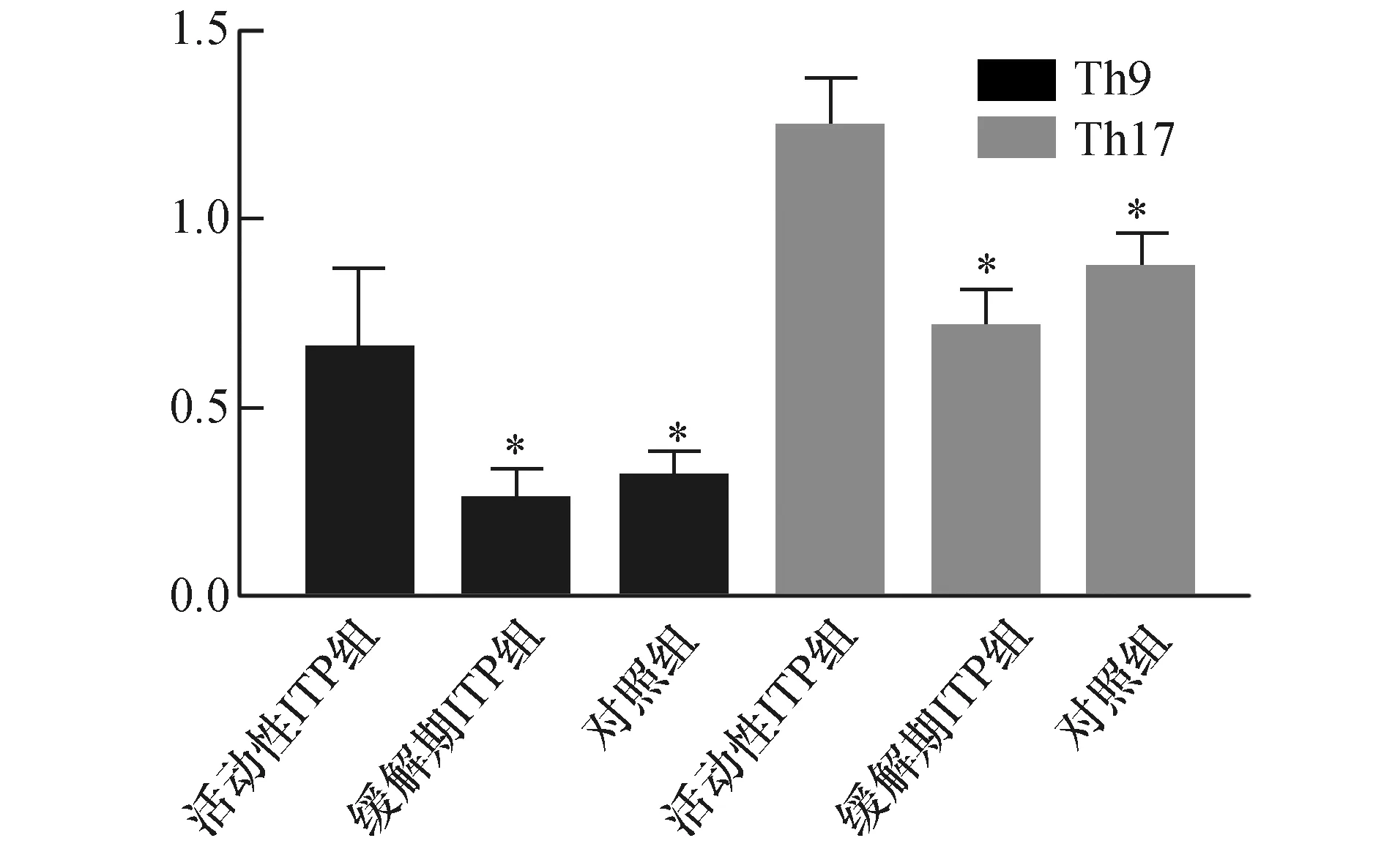
图1 三组Th9/Th17表达水平比较与活动期ZTP组比较;*P<0.05
2.2 Th9转录因子在三组的表达
活动性ITP组、缓解期ITP组及对照组PU.1分别为(1.83±0.24)、(1.06±0.12)、(0.98±0.10),PU.1在三组中表达差异有统计学意义(F=325.241,P=0.000),活动性ITP组PU.1表达明显高于缓解期ITP组及对照组(q=30.025、29.576,均P<0.05),缓解期PU.1表达与对照组比较差异无统计学意义(q=2.603,P<0.05)。活动性ITP组、缓解期ITP组及对照组IRF4分别为(2.06±0.23)、(1.21±0.24)、(0.88±0.15),IRF4在三组中表达差异有统计学意义(F=288.402,P=0.000),活动性ITP组患者IRF4表达明显高于缓解期ITP及对照组患者(q=28.294、27.830,均P<0.05),缓解期ITP组与对照组比较差异无统计学意义(q=2.414,P>0.05)。活动性ITP组、缓解期ITP组及对照组BATF分别为(1.81±0.21)、(1.10±0.15)、(0.79±0.11),三组患者BATF表达比较差异有统计学意义(F=342.103,P=0.000),活动性ITP组患者BATF表达明显高于缓解期(q=30.756、30.372,均P<0.05),缓解期ITP患者BATF表达与对照组比较差异无统计学意义(q=2.737,P>0.05)。结果提示,转录因子表达升高可能为造成Th9表达升高的原因。见图2。
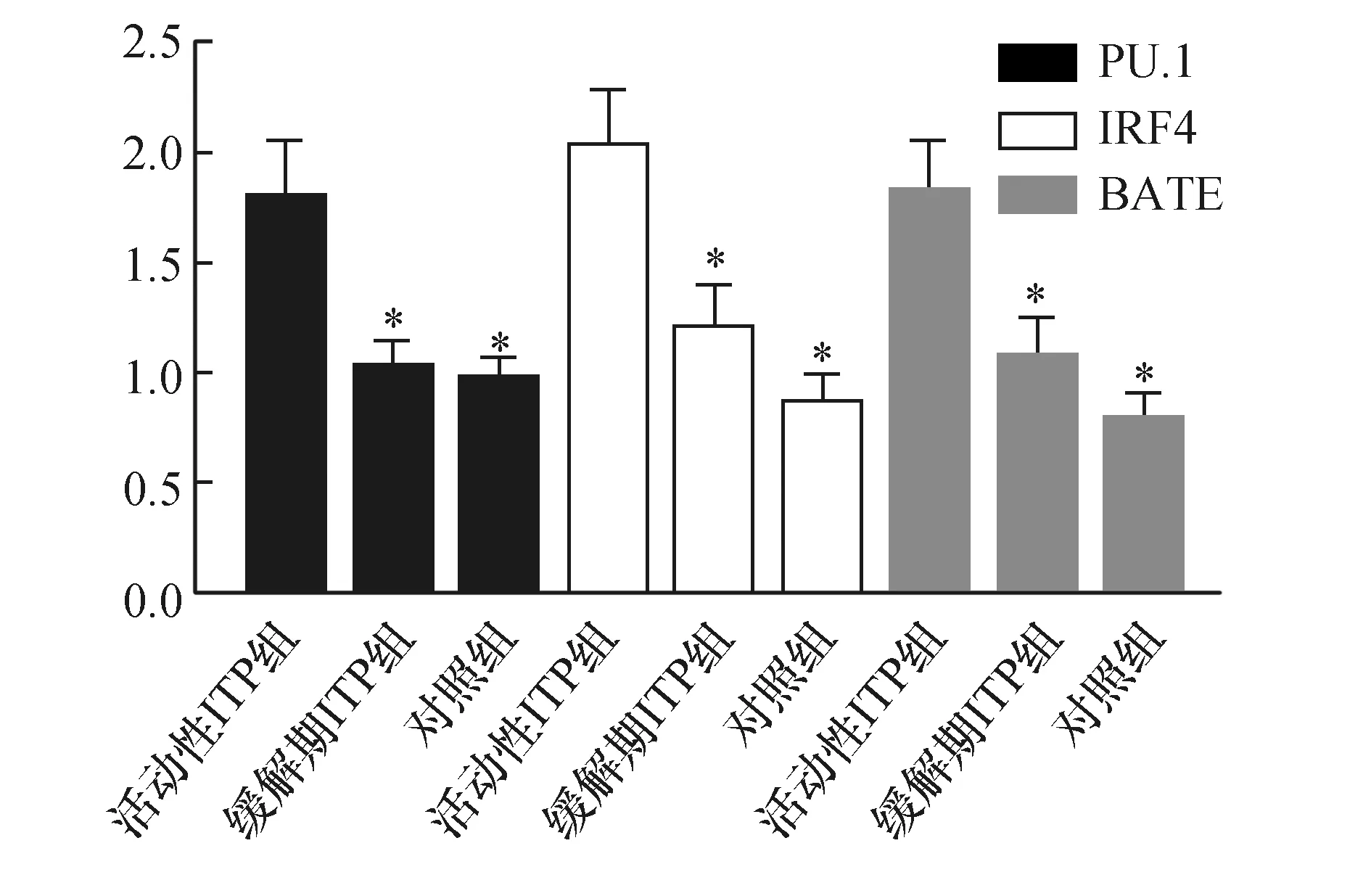
图2 PU.1、IRF4及BATF在三组受试者中表达比较与活动期ZTP组比较;*P<0.05
2.3 Th17转录因子RORγt在三组中的表达
活动性ITP组、缓解期ITP组及对照组RORγt表达分别为(1.85±0.24)、(0.46±0.11)、(0.98±0.13);三组间比较差异有统计学意义(F=476.871,P=0.000),活动性ITP组患者RORγt表达明显高于缓解期ITP组及对照组(q=39.302、32.093,均P<0.05),缓解期ITP患者RORγt表达与对照组比较差异无统计学意义(q=2.784,P>0.05)。提示,RORγt表达可能为引起ITP患者Th17表达升高的原因。
2.4 IL-9/IL-17在三组中的表达水平
活动性ITP组、缓解期ITP组及对照组IL-9表达分别为(18.38±1.20)、(14.62±0.95)、(9.64±0.52)ng/L,三组患者血清IL-9水平比较差异有统计学意义(F=775.000,P=0.000),活动期ITP患者血清IL-9水平明显高于缓解期ITP患者及对照组患者(q=26.635、55.245,均P<0.05),缓解期ITP患者血清IL-9水平明显高于对照组患者(q=29.430,P>0.05)。活动性ITP组、缓解期ITP组及对照组IL-17表达分别为(5.26±0.27)、(4.13±0.30)、(2.26±0.18)ng/L,三组受试者血清IL-17水平比较差异有统计学意义(F=1162.452,P=0.000),活动性ITP组患者血清IL-17水平明显高于缓解期ITP患者及对照组患者(q=33.261、67.565,均P<0.05),缓解期ITP组患者血清IL-17水平明显高于对照组患者(q=35.419,P<0.05)。见图3。
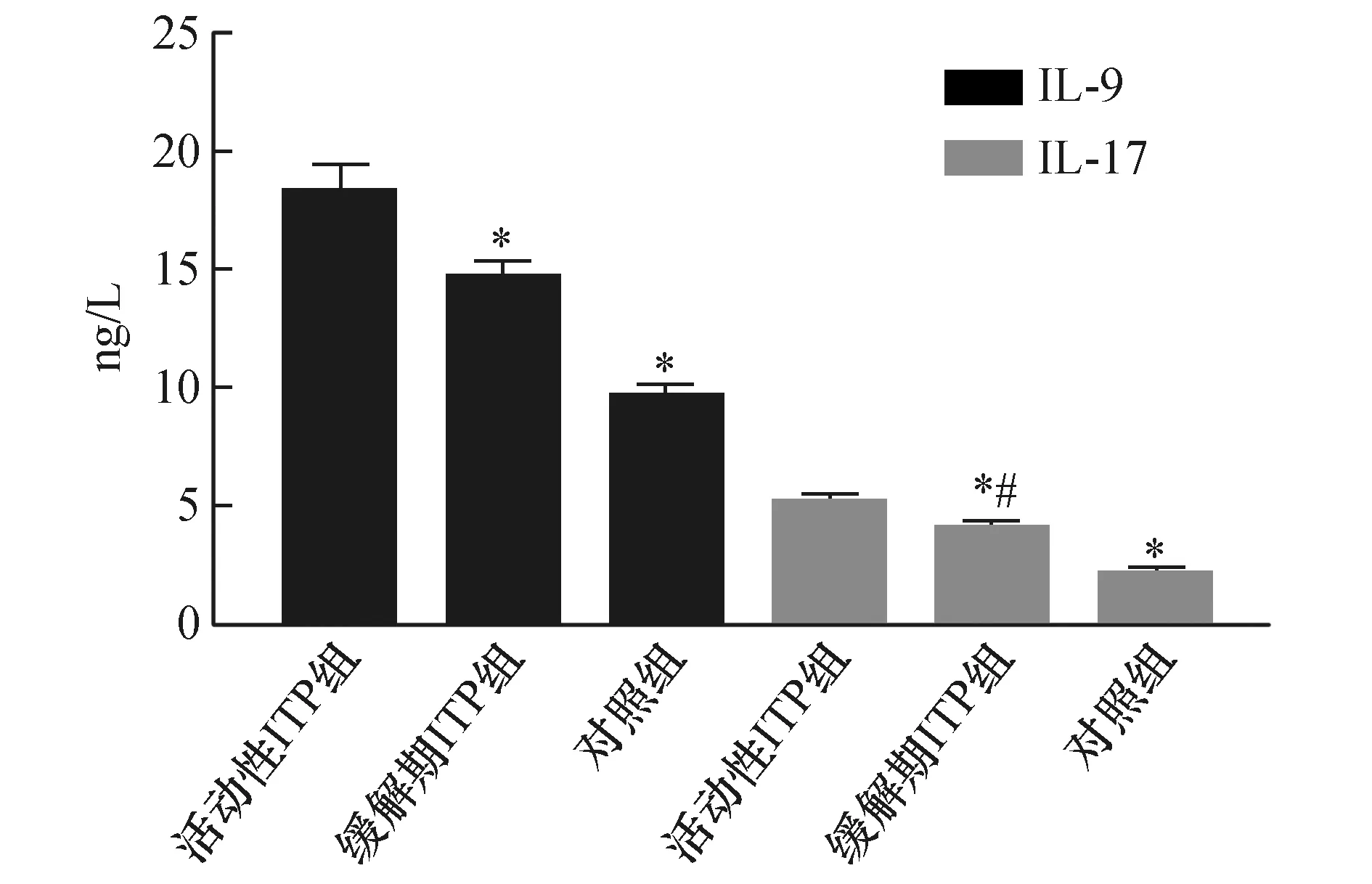
图3 IL-9/IL-17在三组中的表达水平比较与活动期ZTP组比较;*P<0.05;与对照组比较;#P<0.05
2.5 Th9/Th17及IL-9/IL-17诊断活动性ITP的效能
Th9诊断活动性ITP的最大约等指数为0.694,对应最佳截断点为0.65;Th17诊断活动性ITP的最大约等指数为0.708,对应的最佳截断点为1.17;IL-9诊断活动性ITP的最大约登指数为0.443,对应的最佳截断点为15.86 ng/L;IL-17诊断活动性ITP的最大约等指数为0.419,对应的最佳截断点为4.60 ng/L。AUCTh17>AUCIL-17,AUCTh17>AUCIL-9,AUCTh17>AUCTh9,(Z分别为4.886、4.718、1.696,P=0.000、0.000、0.090)。见图4、表2。
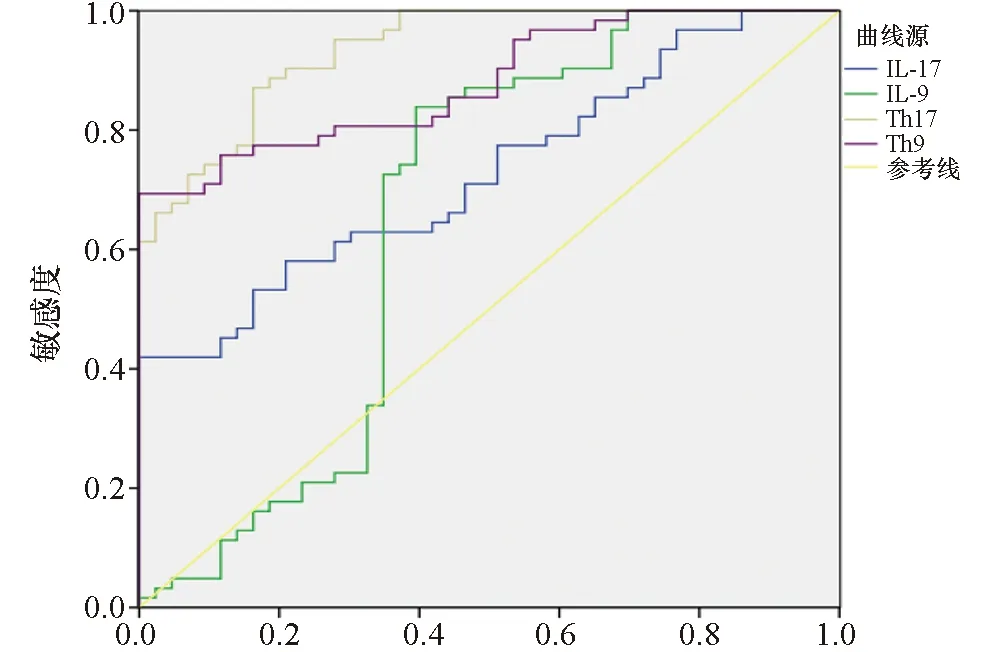
图4 Th9/Th17及IL-9/IL-17诊断活动性ITP的ROC曲线
表2 Th9/Th17及IL-9/IL-17诊断活动性ITP的统计学结果
2.6 Th9与Th17及IL-9与IL-17的相关性分析
活动性ITP组Th9与 Th17呈正相关(r=0.568,P=0.000),IL-9与IL-17呈正相关(r=0.885,P=0.000);缓解期ITP患者Th9与 Th17呈正相关(r=0.776,P=0.000),IL-9与IL-17呈正相关(r=0.811,P=0.000)。见图5。
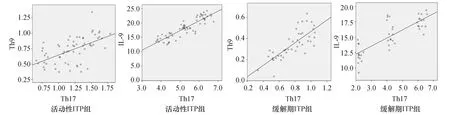
图5 Th9与Th17及IL-9与IL-17的相关性分析
3 讨 论
ITP为自身免疫性疾病,特征为对血小板的破坏及阻碍其生成,造成出血。ITP为器官特异性疾病,T细胞及B细胞介导的免疫耐受及攻击间的失衡在ITP的发生发展过程中具有重要作用[7]。研究报道,除Th1/Th2外,Th17/Th9为新的Th亚型,其特征在于能够分泌IL-17及IL-9,鉴于IL-17/IL-9的多效性,Th17/Th9细胞已被证明参与机体的炎性反应及自身免疫性疾病[8-9]。然而,对于Th17/Th9是否参与ITP的发病及其机制的报道鲜有报道。本研究通过测量ITP患者Th17/IL-17、Th9/IL-9的含量,明确其与ITP的关系。
研究表明Th细胞为调节免疫应答的关键,其特征在于其特异的转录因子表达[10]。Th17/Th9细胞为新发现的Th细胞效应物,越来越多证据表明Th17及Th9与许多自身免疫性疾病相关,如动物实验表明Th9细胞可在转移性结肠炎模型中诱发炎症[11-12]。本研究中,活动性ITP组患者Th17及Th9细胞的表达明显升高,并在缓解期恢复至正常水平,提示其可能与ITP的发生相关。近年来,通过对Th17及Th9基因表达的分析,发现BATF为Th9细胞富集的基因[13]。其作用与Th9细胞分化为转录因子的作用相同,本研究中观察到活动性ITP患者PU.1、IRF4及BATF的表达明显升高,可能与Th9细胞分化增强相关,提示三者可能共同参与诱导Th9细胞的转录,介导ITP的发生;RORγt为Th17细胞发育所需的主转录因子,本研究中结果显示,Th17细胞在活动性ITP患者中数量明显增多,在缓解期恢复至正常水平,RORγt与其变化趋势相同,结果与先前的研究相符。最近研究[14]发现Th9细胞可合成分泌IL-9,其能通过结合其特异性受体,增加IL-4介导的IgE及IgG的产生,其作用途径与ITP在免疫调节中途径相同[15]。Th-9能够诱导CD4+T细胞向Th17细胞的分化,而且Th-9对Th17分泌的细胞因子IL-17具有促进发育的作用[16]。IL-17能够作用于相应的靶细胞,参与体内的炎症反应,也能引发自身免疫性疾病,进而导致ITP患者机体免疫功能紊乱并影响疾病的发生发展。本研究中活动性ITP患者Th17/IL-17含量均明显升高,与此前研究相一致,提示Th17/IL-17主要通过引起炎症反应参与ITP的发展。本研究中观察到ITP患者Th9细胞与Th17细胞及IL-17与IL-9均呈现正相关,提示Th9/IL-9及Th17/IL-17可能协同参与ITP的发病。本研究中同时利用Th17/IL-17及Th9/IL-9对ITP进行诊断,结果发现四者均对ITP具有一定诊断价值,当患者Th9高于0.65、Th17高于1.17、IL-9高于15.86 ng/L、IL-17高于4.60 ng/L应警惕患者发生ITP的可能。有研究指出Th17/IL-17及Th9/IL-9对ITP的预后存在关联[17],本研究下一步将延长观察时间对ITP患者预后进行分析,并将加大样本量对本研究结果进行进一步确认。
综上所述,本次研究表明,Th17/IL-17及Th9/IL-9在活动性ITP患者中过表达增加,其影响ITP发病的机制可能与增加转录因子表达相关,还发现Th17/IL-17及Th9/IL-9呈正相关,提示Th17/IL-17可能与Th9/IL-9协同参与ITP的发病,并发现四者对ITP均具有一定诊断价值,为临床预防治疗ITP提供了新的靶点。

