云南甜龙竹组培及组培苗移栽技术研究
钟永莉 陈玟旭 谭宏超
(云南师范大学生命科学学院 昆明 650500)
甜龙竹(Dendrocalamusspp.)俗称甜竹,包括云南甜龙竹(DendrocalamusbrandissKurz)、版纳甜龙竹(DendrocalamushamiltoniiNees et Arn.ex Munro)和马来甜龙竹 [Dendrocalamusasper(J.A.et J.H.Schult.)Backer ex Heyhe]3 个种,属竹亚科牡竹属大型丛生竹类[1]。其中,云南甜龙竹直径10~16 cm,竹高 15~25 m,自然笋期 6—11月(在热量足、冬春季节进行浇水覆盖条件下,全年都可出竹笋),是极好的笋用竹。其笋味脆甜可口,可作为刺生、水果、沙拉食材鲜食,也可炒、炖、煮、煎等多种烹饪方法食用。竹笋生长过程中几乎没有病虫害,无需使用农药;开始产笋后若只施有机肥,笋味更美,是天然绿色健康食材[2]。
组织培养技术是快速获得良种种苗的重要途径。1968年Alexander 等[3]首次报道了利用竹子的成熟种胚离体培养而获得完整植株。利用版纳甜龙竹的腋芽作为外植体,通过不同浓度的激素诱导也获得了再生植株[4-5]。目前,竹子组织培养技术已成为竹苗繁育、竹子生物技术、种质遗传改良等研究得以实现的重要技术基础,受到越来越多的关注[6]。本文通过云南甜龙竹组培及移栽试验,试图找到适合其组培繁殖的各项条件,以降低育种成本,对于增加云南甜龙竹资源,提升其利用价值具有重要的现实意义。
1 试验地概况
组织培养试验在云南师范大学呈贡校区生命科学学院进行,这里拥有丰富的云南甜龙竹资源及先进的研究设施,可满足组织培养所需要的条件。甜龙竹组培苗的移栽试验选择在云南省昆明市嵩明县云南珍竹农业科技有限公司林地,该公司拥有温室大棚等先进设施,技术人员充裕,适合开展各类林业研究。
2 材料与方法
2.1 组织培养试验
2.1.1 外植体选取
外植体宜选取芽分化程度较低的部位为好,且性状优良。试验设置6 种类型的外植体:种子、1年生种子苗茎段、2年生种子苗茎段、3年生种子苗茎段、扦插苗节芽、成年竹丛枝芽。每种外植体各取30 个样本进行试验。将外植体经无菌处理移入盛有MS+6-BA 2.0 mg/L 的培养基瓶内,连续观察30 d。记录每种外植体开始生芽、褐化、发霉的时间,并计算外植体的芽诱导率。
2.1.2 外植体消毒
外植体消毒前先用水冲洗除去外部污染物,然后剥除外层表皮或组织。对外植体进行消毒,在实验室的无菌操作台上进行。将外植体用自来水冲洗6~8 h 后,用 70%的酒精浸泡 30 s,再用一定浓度的升汞消毒一定时间,最后用无菌水冲洗5 次。将种子放到置有两层无菌滤纸的培养皿中,于显微镜下切取种胚并接种到诱导培养基中;其他类型外植体直接植入诱导培养基中[8]。
选择培养基MS+6-BA2.0 mg/L,试验设置了4种质量百分比浓度的升汞进行消毒:0.05%、0.10%、0.15%、0.20%;并依据经验用 0.1%升汞设置 4 种消毒时间:3、6、9、12 min。接种 30 d 后分别记录外植体的芽诱导率。
2.1.3 适宜诱导培养基的选取
试验设置4 种外植体诱导培养基:MS、1/2MS、3/4MS、1.5MS,试验培养基对6 种外植体的组培效果,记录每种外植体的发芽率。诱导培养基均添加20 g/L 白糖、5 g/L 琼脂,pH 值为 5.8。培养温度25~28 ℃,诱导和增殖培养时光照度 500 Lx,生根培养时前期光照度为500 Lx,20 d 后光照度为1 500 Lx,光照时间为 12 h/d[9]。
2.1.4 培养基中6-BA 浓度的选取
外植体经充分消毒后分别接种在添加不同浓度的6-BA 的MS 培养基中,30 d 后记录外植体的芽诱导率。6-BA 设置 5 种浓度水平:0.5、1.0、1.5、2.0、2.5 mg/L。
2.1.5 丛芽诱导、丛芽继代、生根培养
利用6-BA、KT、激素混合配比的培养基 MA+6-BA 2.0 mg/L+KT 0.5 mg/L 对其进行丛芽诱导培养。待幼芽发育到一定阶段,将竹苗从培养基中取出,移至新的培养基中,新培养基的激素配比为MS+6-BA 1.5 mg/L,用于促进芽的生长。当芽增殖到一定数量后,转入生根培养基中(1/2MS+NAA1.0 mg/L),进行生根培养。
2.2 组培苗移栽
用以1年生种子苗茎段为外植体培育的1年生组培苗进行移栽试验。试验设置6 种育苗基质(珍珠岩、红土、黑土、植物碎末、泥炭、蛭石)和 4种育苗环境(小弓棚、大棚、大棚套小棚、遮阳网)。3 个月后观察幼苗生长情况,调查指标有移栽成活率、每丛株数、苗木平均地径和平均高。
3 结果与分析
3.1 不同外植体的组培效果
不同外植体组培效果的调查结果见表1。从表1中可以看出:1年生种子苗茎段接种后最先生芽,为接种后第3 d,而出现褐化和发霉的时间最晚,分别为接种后第18 d 和第19 d,芽诱导率最高,为97.2%;其次是2年生种子苗茎段和3年生种子苗茎段,出现生芽的时间分别为接种后第4 d 和第6 d,出现褐化的时间分别为第15 d 和第10 d,出现发霉时间分别为第16 d 和第14 d 天,芽诱导率分别为95.1%和91.7%;扦插苗节芽和成年竹从枝芽的生芽时间要晚于种子外植体,且发霉时间要早于种子,但芽诱导率比种子外植体高。可见,云南甜龙竹组培宜选择1年生种子苗茎段作为外植体。
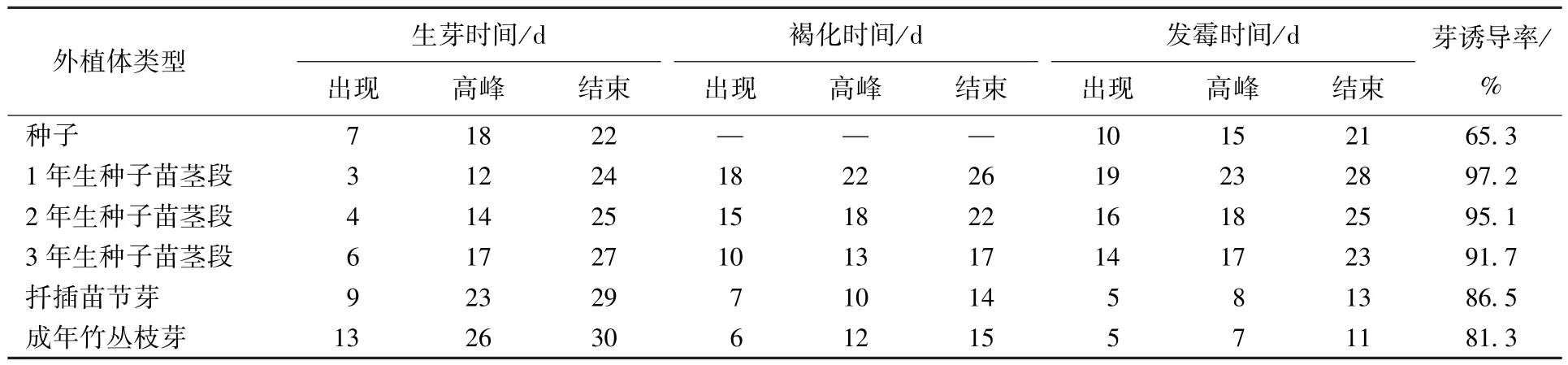
表1 云南甜龙竹不同外植体接种后的变化
3.2 消毒剂浓度和消毒时间对外植体组培效果的影响
表2 为4 种质量百分比浓度的升汞对外植体进行消毒,其组培效果的统计结果。可以看出,各类型外植体均在升汞质量百分比浓度为0.10% ~0.15%时芽诱导率较高;而用较低或较高浓度的升汞消毒,其外植体的芽诱导率均较低。
用0.1%升汞对外植体消毒不同时间,外植体的生芽情况见表3。可以看出,消毒时间在6 和9 min时外植体的芽诱导率较高,消毒时间不足3 min 或是超过9 min 后外植体芽诱导率均降低;同时,随外植体木质化程度增加,所要求的消毒时间也延长。
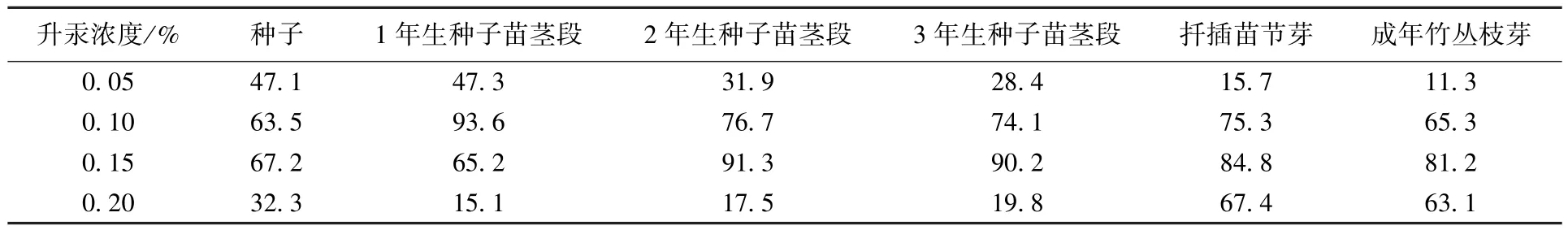
表2 不同浓度的升汞处理外植体的芽诱导率 %
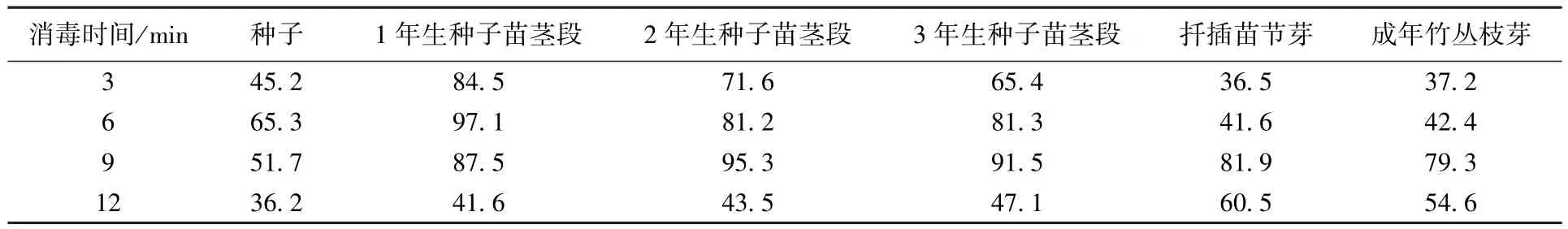
表3 升汞不同处理时间外植体的芽诱导率 %
3.3 不同培养基对外植体组培效果的影响
表4 为外植体接种在4 种不同培养基中的生芽情况。可以发现,MS 培养基中的外植体芽诱导率最高,说明MS 培养基最适合云南甜龙竹的组织培养。
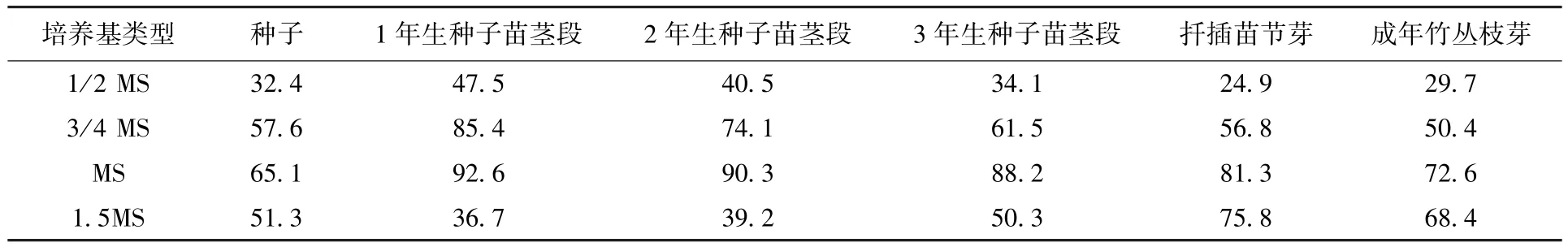
表4 在不同培养基中外植体的芽诱导率 %
3.4 培养基中6-BA浓度对外植体组培效果的影响
在MS 培养基中添加不同浓度的6-BA,外植体接种后的生芽情况见表5。可以看出,在添加1.5 ~2.0 mg/L 6-BA 的 MS 培养基中,6 种外植体的芽诱导率均较高。6-BA 为细胞分裂素,适当浓度的6-BA 有利于外植体细胞组织的分裂分化。
3.5 育苗基质对组培苗生长的影响
将用1年生种子苗茎段经培育生根后的组培苗移栽至6 种基质中,3 个月后幼苗的生长情况见表6。可以看出,不同基质对组培苗的生长有较大的影响,其中以植物碎末为基质的幼苗成活率最高,每丛株数最多,幼苗地径和苗高度最大;其次为蛭石基质,幼苗生长也较好。
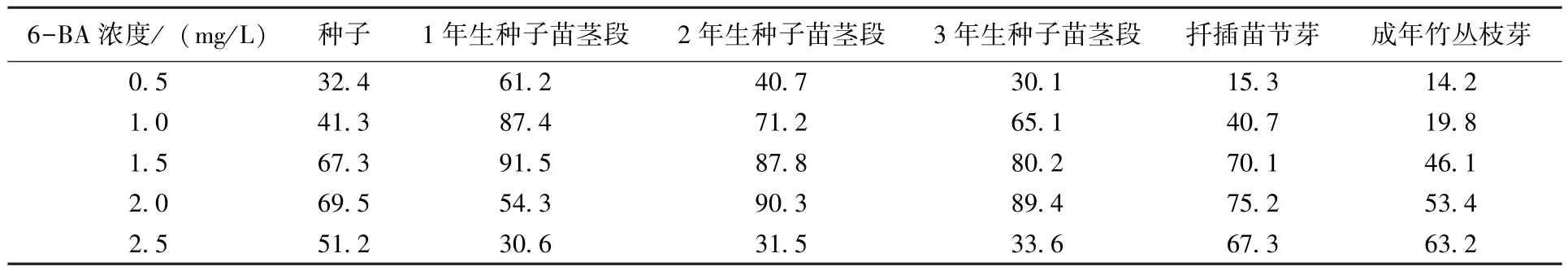
表5 培养基中6-BA 不同浓度处理的外植体芽诱导率 %
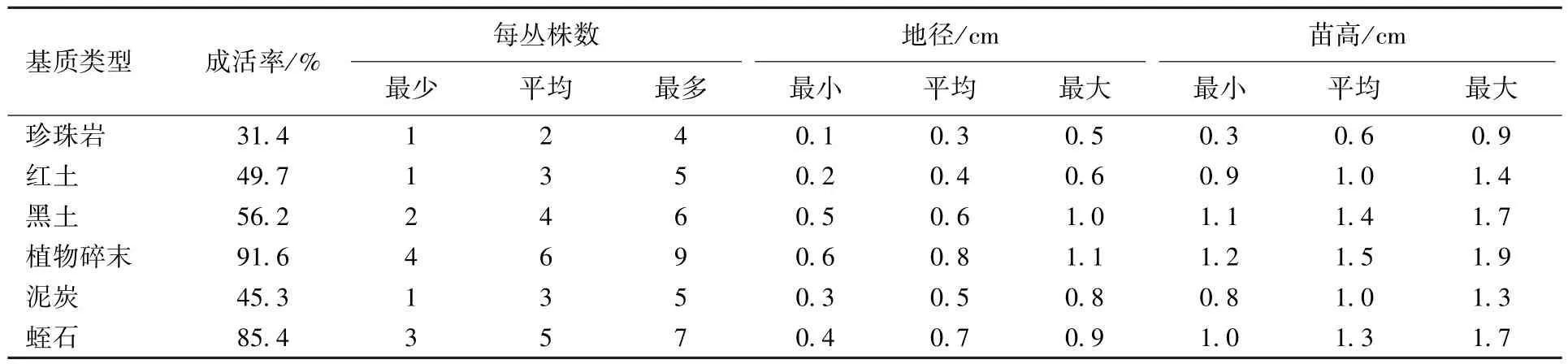
表6 不同育苗基质中组培苗的生长情况
3.6 不同环境对组培苗生长的影响
以植物碎末为育苗基质,将生根后的组培苗在4 种小环境下培育,3 个月后幼苗的生长情况见表7。可以看出,在大棚套小棚的环境下,幼苗生长表现最好,移栽成活率可达91.6%,平均每丛株数为 12 株,地径达 1.2 cm,苗高达 1.9 cm。对幼苗生长有利的其他环境条件依次为大棚、小弓棚、遮阳网。

表7 不同环境中组培苗的生长情况
4 结论
试验结果显示,云南甜龙竹组培繁育以1年生种子苗茎段作为外植体,用0.10%~0.15%的升汞消毒6~9 min,使用标准 MS 培养基,添加浓度为1.5~2.0 g/mL 的6-BA,能够获得较高的芽诱导率。在1年生组培苗移栽时,采用大棚套小棚的移栽环境,以植物碎沫作为栽培基质,苗木成活率较高,幼苗生长较好。


