蓖麻镶嵌系与雌性系间的生理差异研究
何晓琳,施玉珍,殷学贵,杨 婷,陆建农
(1.广东海洋大学农学院,广东 湛江 524088;2.广东海洋大学化学与环境学院,广东 湛江 524088)
【研究意义】蓖麻(Ricinus communis L.)属大戟科蓖麻属,正常情况下蓖麻为雌雄同株异花的常异花授粉作物,为世界十大油料作物之一。蓖麻油及其衍生物在医药、染织、机械、化工、航空等多个领域都有应用[1-2]。随着工业的发展,蓖麻油的需求量逐年增多,但由于蓖麻单产不高,远远无法满足市场需求。而采用蓖麻雌性系培育杂交种是蓖麻高产育种的重要手段,但当前还存在对蓖麻性别表达的生理及遗传机制了解不深、制种过程中种子纯度不高、蓖麻雌性系繁种困难等诸多问题。【前人研究进展】蓖麻花序分为两性花序(花序轴上部着生雌花、下部着生雄花)、单雌花序(只着生雌花)、镶嵌花序(单雌花序上镶嵌着生少量雄花)[3]。蓖麻的性别分化受基因控制,同时,激素、温度、植株营养状况等同时影响花序的性别分化[4]。关于蓖麻单雌性状的遗传研究,已报道的有细胞质基因控制[5]、核显性单基因控制[6]、核隐性单基因控制[7]、核隐性多基因控制[8]。Shifriss[4,6]认为蓖麻镶嵌雄花由雌性基因与镶嵌基因(id)共同决定。同时提出部分id基因为环境敏感基因。Zimmerman等[9]推断环境敏感型蓖麻镶嵌雄花由多基因控制。William等[10]认为蓖麻镶嵌雄花的表达量取决于id基因的剂量,id1/id1、id2/id2表现型为高度镶嵌。Lavanya[11]认为蓖麻高度镶嵌类型后代会出现10%~12%镶嵌株,低、中度镶嵌型后代则趋向于雌性系。Lu等[12]提出蓖麻单雌性状是由一系列隐性基因、至少1对显性上位基因和多基因共同控制,当显性上位基因不存在时单雌可能转变为镶嵌,同时,单雌基因和镶嵌基因间的相对优势也影响镶嵌性状表达,且镶嵌基因也由主基因和多基因共同控制。Tan等[13]以1对相同遗传背景的两性系和雌性系蓖麻为研究材料,通过转录组测序获得了大量与激素反应及生物合成相关的差异表达基因,包括激素反应调控相关基因,DNA转录相关基因,信号转导、性别分化、花粉、细胞程序性死亡、生殖发育、组蛋白甲基化/脱甲基相关基因等8大类共31个差异基因。在不同性别花序内源激素研究中,汪磊等[14]发现蓖麻单雌花序中生长素、脱落酸含量高于两性花序,而两性花序中雄花脱落酸含量显著高于雌花。文淡悠[15]发现蓖麻雌性系与蓖麻两性系间内源乙烯释放量在六叶期前无差异,而在现蕾期差异显著,在开花期达到极显著水平,且均表现为两性系高于雌性系,由此表明乙烯是蓖麻性型决定的关键因素之一。在外源激素对蓖麻性别分化研究中,Shifriss[16]认为喷施赤霉素能增加两性株蓖麻花序的雌花分化。谭美莲等[17]报道指出,100 mg/L赤霉素处理有利于蓖麻雌花分化,而250 mg/L赤霉素则有利于雄花形成。代梦媛等[18]认为喷施赤霉素合成抑制剂-多效唑有促雄作用。赤霉素和硝酸银均能诱导单雌蓖麻出现镶嵌雄花[19]。NAA、6-BA和激动素处理均能增加促雌[17,20]。有研究认为喷施乙烯利能减少蓖麻镶嵌雄花的数目[21-22],但也有研究认为高浓度的乙烯利能促进蓖麻雄花。【本研究切入点】目前蓖麻性别决定的遗传和生理机制尚不完全清楚,蓖麻雌性系与蓖麻镶嵌系间的生理差异比较尚未见报道。【拟解决的关键问题】本研究以高度纯合、遗传背景相同的蓖麻镶嵌系和雌性系为材料,在主穗现蕾期、盛花期分别对光合效率、营养物质含量及内源激素进行分析,旨在为蓖麻性别分化形成机理研究提供参考。
1 材料与方法
1.1 试验材料
蓖麻镶嵌系和雌性系分别为9408 ISF、9408 P,由山东家祥蓖麻研究所提供,经连续多代自交后用于试验。两者除性别差异外,其他表型完全相同。蓖麻雌性系植株主穗及一级分枝为单雌花序,无雄花出现,蓖麻镶嵌系植株主穗花序上一级小花为雌花,少量二、三级小花会分化为雄花(图1)。蓖麻用桶栽,桶内基质由花生壳、沙子、椰糠、化肥均匀混合而成,2017年11月种植于广东海洋大学蓖麻育种基地温室大棚,栽培管理水平一致。

图1 蓖麻的花序Fig. 1 Inflorescence of Ricinus communis L.
1.2 试验方法
在蓖麻主穗现蕾期、盛花期用主茎倒三叶分别测定叶绿素相对含量、光合速率、可溶性糖、可溶性蛋白、可溶性淀粉含量和内源激素等指标,3次重复。叶绿素相对含量采用便携式叶绿素计(SPAD-502Plus)测定,LI-6400XT光合仪测定植物叶片净光合速率,可溶性糖、可溶性蛋白、可溶性淀粉含量测定参考王学奎等[24]的方法,内源激素采用酶联免疫吸附测定法(ELISA)测定(试剂盒由江苏酶标生物科技有限公司提供)。
试验数据统计分析采用Excel、SPSS软件。
2 结果与分析
2.1 蓖麻镶嵌系、雌性系叶绿素相对含量及净光合速率变化
从图2A可以看出,在现蕾期,蓖麻镶嵌系与雌性系之间叶绿素相对含量无显著差异。在盛花期,镶嵌系蓖麻叶绿素相对含量比雌性系上升15.2%,差异达显著水平;从现蕾期到盛花期,雌性系叶片内叶绿素相对含量变化不显著,而镶嵌系却显著上升,在盛花期上升了19.4%。净光合速率变化趋势与叶绿素相同(图2B),即现蕾期两者之间无显著差异,盛花期镶嵌系比雌性系高23.3%,从现蕾期到盛花期,雌性系净光合速率无显著变化,但镶嵌系净光合速率上升幅度达到30.5%。镶嵌花的形成伴随着叶绿素相对含量和净光合速率的上升。
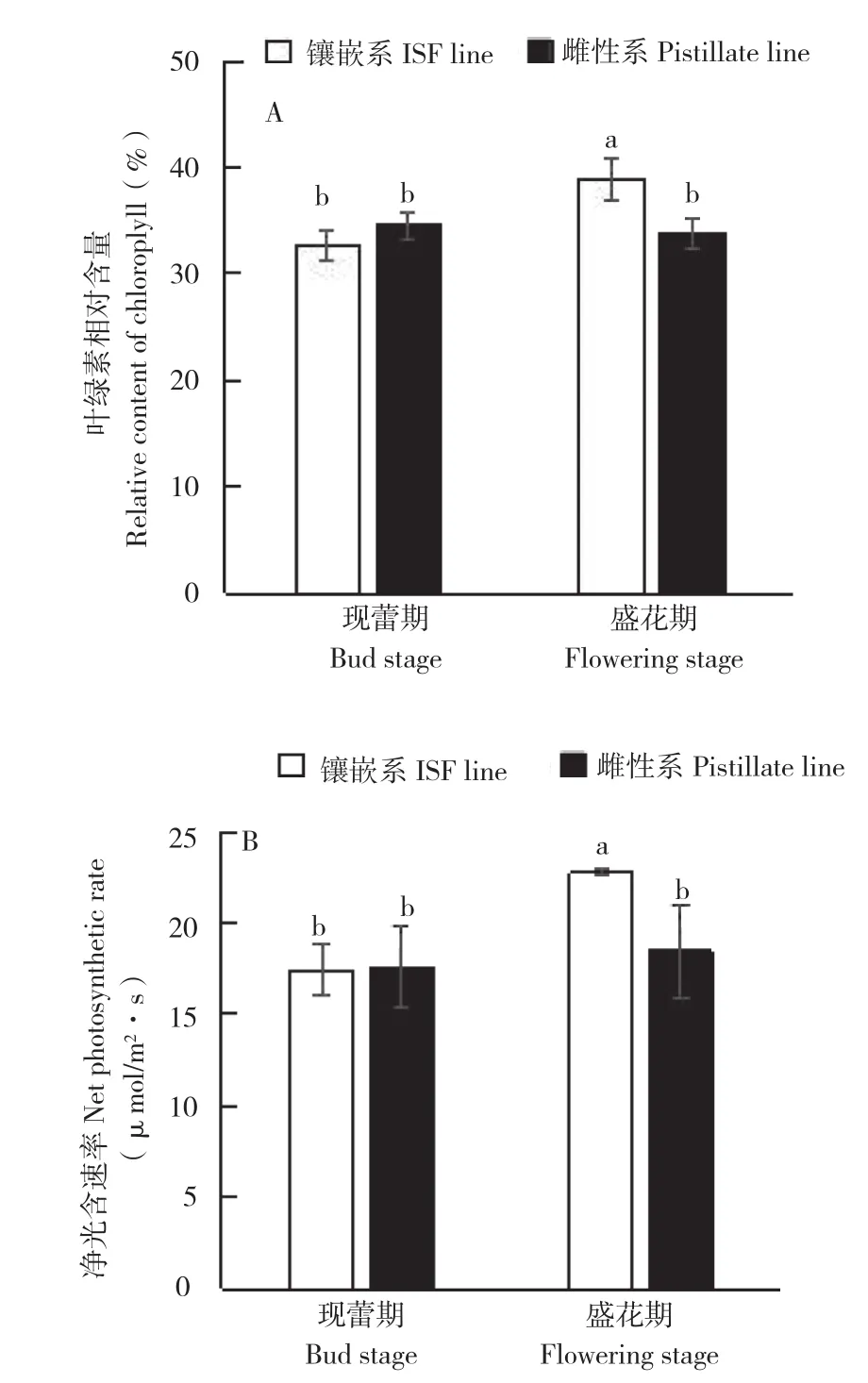
图2 蓖麻镶嵌系、雌性系叶绿素相对含量及净光合速率变化Fig. 2 Change of chlorophyll relative content and net photosynthetic rate in ISF line and pistillate line
2.2 蓖麻镶嵌系、雌性系营养物质含量变化
现蕾期蓖麻镶嵌系叶片可溶性糖含量高于雌性系36.9%,但盛花期镶嵌系比雌性系显著下降38.0%,差异达到显著水平(图3A);从现蕾期到盛花期,雌性系叶片内可溶性糖含量无显著下降,镶嵌系呈显著下降,降幅达62.3%。无论现蕾期还是盛花期,雌性系和镶嵌系间可溶性蛋白含量均无显著差异,但雌性系、镶嵌系自身可溶性蛋白含量均显著下降,降幅分别为19.3%、31.8%(图3B)。在现蕾期和盛花期,镶嵌系可溶性淀粉含量与雌性系相比有所下降,但在现蕾期差异不显著,盛花期达显著水平,降幅达54.9%(图3C)。从现蕾期到盛花期,雌性系与镶嵌系可溶性淀粉含量均大幅上升,但未达到显著水平。镶嵌花形成过程中,可溶性糖、可溶性蛋白和可溶性淀粉含量总体呈下降趋势。

图3 蓖麻镶嵌系、雌性系营养物质含量变化Fig. 3 Change of soluble nutrients content in ISF line and pistillate line
2.3 蓖麻镶嵌系、雌性系内源激素含量变化
现蕾期镶嵌系蓖麻叶片赤霉素含量较雌性系低25.6%(图4A),但盛花期镶嵌系较雌性系高13.8%,差异均达到显著水平。从现蕾期到盛花期,雌性系的赤霉素含量无显著变化(图4B),而镶嵌系盛花期较现蕾期显著上升了51.7%。现蕾期蓖麻镶嵌系细胞分裂素含量较雌性系高61.5%,盛花期差异不显著。镶嵌系盛花期细胞分裂素含量较现蕾期下降33.0%,雌性系差异不显著。盛花期生长素含量为镶嵌系高于蓖麻雌性系,高达33.5%,达到显著水平(图4C);而现蕾期差异不显著。雌性系盛花期生长素含量比现蕾期下降24.3%,镶嵌系不显著。盛花期脱落酸含量较现蕾期均显著上升,雌性系上升了39.0%,镶嵌系上升了10.1%(图4D)。而现蕾期雌性系与镶嵌系间脱落酸含量无显著差异,盛花期镶嵌系脱落酸含量比雌性系降低14.8%,差异达显著水平。乙烯含量在现蕾期差异不明显(图4E);盛花期,镶嵌系较雌性系高73.8%。雌性系盛花期乙烯含量比现蕾期下降31.2%,而镶嵌系蓖麻上升20.0%。表明蓖麻镶嵌雄花的分化需要较高浓度的赤霉素、乙烯,较低浓度的脱落酸。
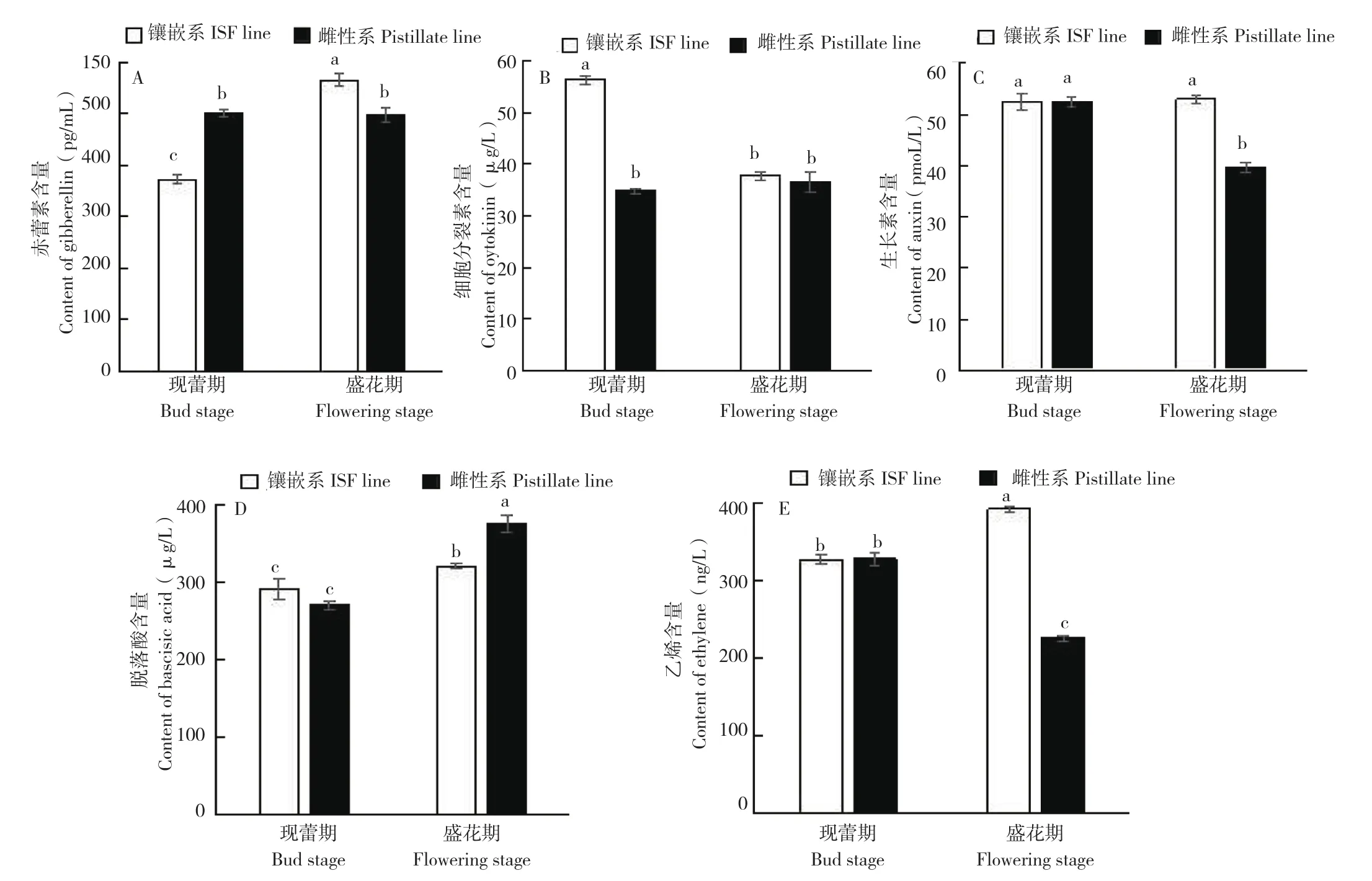
图4 蓖麻镶嵌系、雌性系内源激素含量变化Fig. 4 Change of endogenous hormones content in ISF line and pistillate line
3 讨论
性别分化与植株营养物质及内源激素之间的关系一直广受关注[14-15,25-27]。以往对蓖麻性别分化研究主要集中于雌性系与两性系间内源激素含量与性别的关系及不同外源激素处理对性别分化的影响。本研究主要分析蓖麻镶嵌系与雌性系间的叶绿素相对含量、净光合速率、营养物质及内源激素的差异。
在蓖麻镶嵌雄花形成前,镶嵌系与雌性系表型是完全相同的。伴随着蓖麻镶嵌雄花的形成,二者在表型和生理上出现显著差异。无论蓖麻镶嵌系还是雌性系,从现蕾期到盛花期可溶性营养物质的变化趋势相同,均是可溶性糖和可溶性蛋白含量下降、可溶性淀粉含量上升,但二者之间有明显差异。在现蕾期,蓖麻镶嵌系可溶性糖、细胞分裂素含量显著高于雌性系,赤霉素含量显著低于雌性系。可溶性糖是植物整个生长发育过程的主要能量物质来源,蓖麻镶嵌雄花的形成较雌性系需要储备更多的的物质能量。蓖麻镶嵌雄花的形成前期主要以细胞数目增加为主,因而需要较高的细胞分裂素含量。因此可溶性糖与细胞分裂素的增加是镶嵌雄花形成的前期生理基础。蓖麻镶嵌系赤霉素含量显著低于雌性系是细胞分裂素对赤霉素的拮抗作用所致,因细胞分裂素能阻碍赤霉素的合成且促进赤霉素的降解[28]。
盛花期蓖麻镶嵌系可溶性糖含量显著低于雌性系,表明镶嵌雄花的形成需要消耗大量的可溶性糖。从现蕾期到盛花期可溶性淀粉含量增加,这是可溶性糖转化的结果,但由于蓖麻镶嵌系可溶性糖消耗较多,所以积累水平一直低于雌性系。叶绿素相对含量与叶绿素含量呈极显著正相关[29],因而与植物光合速率紧密相关。在现蕾期,蓖麻镶嵌系叶绿素相对含量和净光合速率与蓖麻雌性系无显著差异,但盛花期显著高于蓖麻雌性系,以满足镶嵌雄花形成对营养物质的需求。银杏雄株叶绿素含量高于雌株[30],核桃雄花分化需要消耗大量的糖[31],均与本研究结果一致。蛋白质是花器官形态建成的物质基础,从现蕾期到盛花期蓖麻花器官逐渐分化成形,可溶性蛋白含量均呈下降趋势。
赤霉素和生长素能促进植物细胞伸长和体积增大,从而促进植物器官的形态建成。蓖麻镶嵌系盛花期赤霉素含量显著高于蓖麻雌性系,因此高浓度赤霉素有利于镶嵌雄花分化。Lakshmamma等[19]报道喷施浓度为100 mg/kg的赤霉素能促进蓖麻镶嵌雄花分化,谭美莲等[17]报道喷施低浓度赤霉素诱导蓖麻雌花分化、高浓度诱导雄花分化,与本研究结果一致。但Shifriss[16]认为赤霉素能促进蓖麻雌花分化。赤霉素对其他作物性别分化的研究结果不一致,对甜瓜[32]有利于雌花分化,对钝叶柃[33]有利于雄蕊发育,这可能与不同植物性别分化对赤霉素的敏感性及所需浓度阈值有关。
生长素在黄瓜[34]、大麻[26]中能促进植株雌性分化。与汪磊等[14]单雌花序生长素含量高于两性花序的结论相反,本试验发现盛花期蓖麻镶嵌系生长素含量高于雌性系,造成这种现象的原因可能是为了满足盛花期的花器官细胞伸长与体积增大的需要,也可能是脱落酸含量的显著上升而抑制了生长素合成,影响其分布[35]。
芦笋雌性器官发育与低水平脱落酸相关,而较高水平脱落酸则与雄性器官发育有关[36],脱落酸有利于华中五味子雌株的分化[37],而对黄瓜性别分化的影响较小[34],可见脱落酸在不同植物性别分化过程中作用不同。本试验中盛花期蓖麻雌性系脱落酸含量显著高于蓖麻镶嵌系,认为高浓度脱落酸能抑制镶嵌雄花的产生,与汪磊等[14]报道单雌花序中脱落酸含量高于两性系的结论吻合。
在以往报道中,乙烯的作用多是促进雌花分化的。如谭美莲等[17]认为在蓖麻6~7叶期喷一定浓度乙烯利能促进蓖麻雄花分化,而Vema[38]则认为一定浓度的乙烯利可抑制蓖麻镶嵌雄花的分化。本试验中盛花期蓖麻镶嵌系乙烯含量显著高于雌性系,可见,高浓度的乙烯诱导了蓖麻镶嵌雄花的形成,与文淡悠等[15,39]两性系蓖麻内源乙烯释放率显著高于雌性系且乙烯合成相关基因RcACS5与雄花的生长发育相关的观点一致。
4 结论
蓖麻镶嵌雄花的形成是雌性花序上正常雌花形成后的又一生理变化过程。这一过程初期是可溶性糖的增加和细胞分裂素水平的上升,之后叶片叶绿素含量与净光合速率明显上升,可溶性营养物质消耗增加,生长素、赤霉素、乙烯含量增加以及脱落酸水平降低。在蓖麻种植过程中可喷施一定浓度叶面肥及生长调节剂诱导蓖麻性别转化。

