不同浓度赤霉素处理对杜仲种子萌发的影响
李佳 周素华 贾娜 刘扬 孙晓东
摘要[目的]杜仲种子由于有胶质果翅包裹,不易出芽,为了解除杜仲种子的休眠、提高发芽能力,利用不同浓度的赤霉素对杜仲种子进行处理,为其繁殖培育和开发利用提供参考依据。 [方法]观察不同浓度赤霉素处理后,培养皿培养和土壤培养下杜仲种子的发芽情况,并对种子的发芽率、发芽势、丙二醛含量、呼吸强度、浸泡液电导率进行测定。[结果]随着赤霉素浓度的上升,杜仲种子的发芽势、发芽率呈现先上升后下降的趋势,在赤霉素浓度为400 mg/L时,发芽率和发芽势最高。培养皿培养的发芽势、发芽率均低于土壤培养,其中,土壤培养种子发芽率最高达76.7%,而培养皿最高仅50%。此外,随着赤霉素浓度的上升,丙二醛含量逐渐增加,浸泡液的电导率逐渐下降,种子呼吸强度逐渐减弱。[结论]赤霉素能在一定范围内打破杜仲种子的休眠,从而促进种子发芽,并且用土壤培養的方法更适合杜仲种子生长。
关键词杜仲;赤霉素;种子萌发;土壤培养
中图分类号S567.1+9文献标识码A
文章编号0517-6611(2019)03-0144-03
doi:10.3969/j.issn.0517-6611.2019.03.046
杜仲(Eucommia ulmoides),又称胶木,属杜仲科杜仲属[1]。杜仲生长在阳光充足、温暖湿润的地方,大多分布在我国陕西南边、四川、云南、贵州等省区[2]。杜仲在经济和药用方面的价值都很高[3],杜仲皮可入药,其味甘,性温[4],可用于治疗肝肾不足、腰膝酸痛、筋骨无力、头晕目眩等,是古代著名药典的佳品[5]。此外,杜仲叶片提取物也可以入药[6]。杜仲在生产中一般用种子繁殖,但种子外部的果翅含有杜仲胶[7],因此,需要满足一定的条件才会发芽。
赤霉素是植物生长中常用的一种激素,它能调节植物生长、影响植物各阶段发育过程,包括促进枝条的生长;打破种子的休眠,促进种子发芽;使植物提前开花,抑制叶和果实的老化等[8]。在促进种子发芽方面,对于不同植物,赤霉素的最适浓度不尽相同。对于同一种植物,即使同一赤霉素浓度,使用方法不同,其促进种子发芽的效果也不一样。赤霉素浓度不够或超过适宜浓度,种子感受性低或遭受逆境,都会使种子不能发芽。该研究试图通过不同浓度的赤霉素对杜仲种子进行浸种处理,探究赤霉素促进杜仲种子发芽的最适浓度及其对杜仲种子发芽的影响。
目前,已有诸多学者对赤霉素促进杜仲种子发芽的最适浓度以及最适温度进行了研究,也有去除杜仲种子胶质果翅后进行培养,来提高杜仲种子的发芽率,但其在去除果翅后,都使用培养皿培养。考虑到杜仲本身适合生长于山地,且实际生产应用中都是通过大面积土壤培养进行生产。因此该研究通过使用不同浓度赤霉素处理杜仲种子,并将其分别置于培养皿和土壤中进行培养,统计不同浓度下杜仲种子的发芽势、发芽率,测定丙二醛含量、浸泡液电导率、种子呼吸强度,研究不同浓度赤霉素处理对杜仲种子发芽的影响,探讨保持和提高杜仲种子活力适宜的赤霉素浓度,为杜仲种子播种苗提供理论依据。
1材料与方法
1.1试验材料
杜仲种子于2017年11月采集于陕西省略阳县,采集后置于冰箱冷藏室保存。
1.2试验方法
1.2.1种子前处理。采用温水浸种催芽,即选取颗粒饱满、新鲜且有光泽的杜仲种子,用温水清洗,于恒温培养箱内40 ℃浸种48 h,期间换水1次。种子吸水膨胀后,捞出上浮种子,剩余种子用蒸馏水冲洗干净。
1.2.2消毒处理。
将清洗干净的杜仲种子放入0.02%的高锰酸钾溶液中,浸泡30 min进行灭菌,捞出后用蒸馏水冲洗2次。
1.2.3不同浓度赤霉素处理杜仲种子。
采用去胚乳发芽法[9],即将杜仲种子先剥除果翅后,再用镊子轻轻捣毁种子的一端果翅约1 mm。以蒸馏水浸种催芽作为对照,将去除果翅后的杜仲种子分别置于100、200、300、400、500、600 mg/L的赤霉素溶液中,在常温下浸种24 h后,取出杜仲种子用蒸馏水清洗3次,分别置于培养皿培养和土壤培养。
1.2.4种子发芽势、发芽率的测定。
每个赤霉素浓度下选取30粒种子,重复3次,于光照恒温培养箱25 ℃进行培养。视情况适宜定量喷洒蒸馏水,保持芽床和种子湿润,每天观察不同芽床的发芽情况(当芽长足种子长度的2/3时视为发芽)。6 d后统计各浓度处理下不同芽床发芽种子数量,计算发芽势;12 d后统计各浓度处理下发芽种子数量,计算发芽率。
发芽势=第6天发芽种子数/种子总数×100%;
发芽率=第12天发芽种子数/种子总数×100%。
1.2.5种子浸泡液电导率、丙二醛含量、呼吸强度的测定。
丙二醛含量的测定用硫代巴比妥酸法[10]。选取经过赤霉素处理后的种子,倒入研磨缸充分研磨,加入5 mL 5%的三氯乙酸,取等量的研磨液进行离心,离心后取上清液2 mL,放入试管中,再加入2 mL 0.6%硫代巴比妥酸于试管中,于100 ℃下的恒温水浴锅中反应,然后迅速放入常温水中冷却,使反应终止,取2 mL放入比色皿,分别在450、523、600 nm处测定吸光度,吸光度的测定用722N可见分光光度计。
电导率的测定:将不同浓度赤霉素浸泡杜仲种子24、36 h的浸泡液过滤到200 mL烧杯中,用ST3100C电导率仪测定电导率。种子呼吸强度的测定用小篮子法[11]。
2结果与分析
2.1赤霉素浸种对杜仲种子萌发的影响
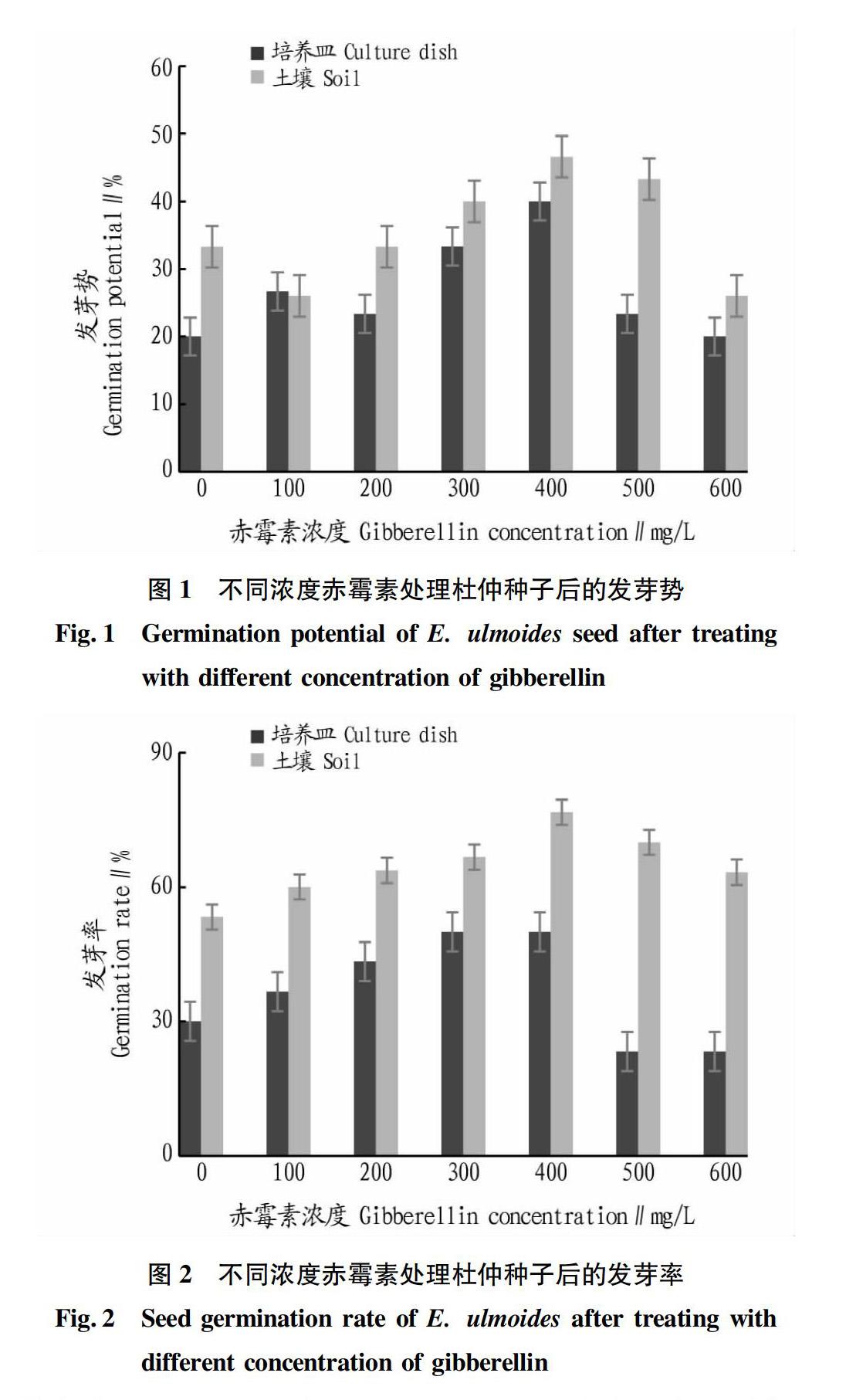
观察不同浓度赤霉素处理对杜仲种子发芽势的影响,其结果如图1所示。于培养皿中培养的杜仲种子,赤霉素浓度在0~400 mg/L时,发芽势逐渐上升;在400~600 mg/L,随赤霉素浓度升高,发芽势下降明显,浓度为400 mg/L时,发芽势最高,达40.0%。土壤培养基本上与培养皿培养呈现相同的趋势,即在赤霉素浓度为0~400 mg/L时,随着赤霉素浓度升高,发芽势逐渐上升,大于400 mg/L时,随赤霉素浓度升高,发芽势逐渐下降。该研究结果显示,经土壤培养的杜仲种子发芽势基本高于培养皿培养,说明杜仲种子更适合于土壤培养。
不同浓度赤霉素处理杜仲种子的发芽率如图2所示。培养皿培养的杜仲种子,在0~400 mg/L时,随着赤霉素浓度升高,发芽率逐渐上升,浓度在300、400 mg/L时,种子发芽率相同且最高,均为50%;在400~600 mg/L时,随着赤霉素浓度升高,发芽率明显下降。土壤培养与培养皿培养呈现了相同的趋势。土壤培养中,当赤霉素浓度为400 mg/L时,此时杜仲种子的发芽率最高,为76.7%。培养皿培养与土壤培养2种方法均支持400 mg/L的赤霉素浸种最能促进杜仲种子发芽。而且,在各个赤霉素浓度下,土壤培养发芽率均高于培养皿培养,表明土壤培养法更适宜促进杜仲种子发芽。
2.2赤霉素浸种对杜仲种子丙二醛含量的影响
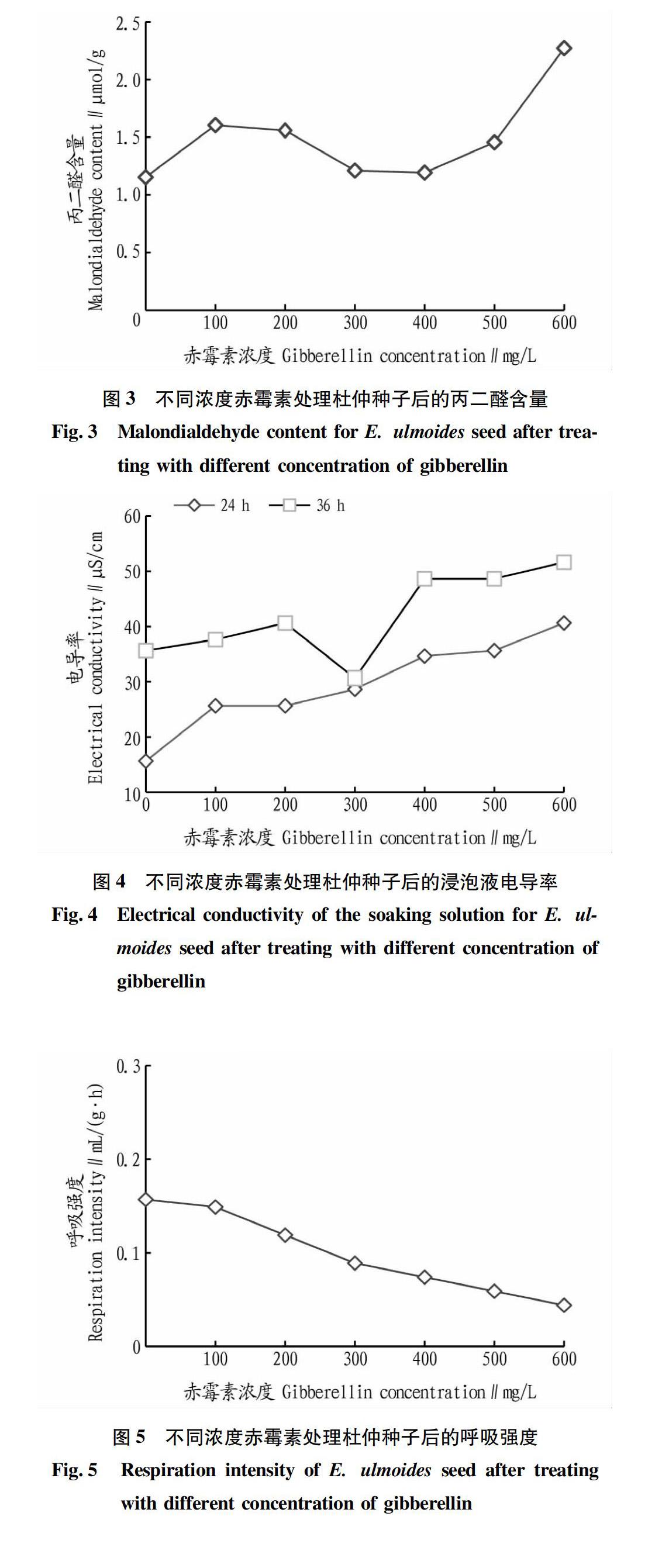
从图3可看出,赤霉素处理在浓度0~400 mg/L時,丙二醛含量总体趋势变化不是很大,只在100和200 mg/L 时稍微有所增加。但当赤霉素浓度为600 mg/L 时,丙二醛含量大幅度提高。在浓度为300、400 mg/L时,与被试浓度范围内其他浓度下丙二醛含量相比较低,但又高于0 mg/L,结合此浓度下杜仲种子发芽率和发芽势又最高,说明此时的赤霉素浓度刚好打破种子休眠,而又不破坏种子内部结构,加快种子新陈代谢,促进种子发芽。当赤霉素浓度高于400 mg/L时,丙二醛含量显著增加,表明高于此浓度会使杜仲种子遭受逆境伤害,抑制种子活力,降低发芽率。因此超过400 mg/L的赤霉素浸种处理不再适宜促进杜仲种子发芽。
2.3赤霉素浸种对杜仲种子浸泡液电导率的影响
不同浓度的赤霉素处理杜仲种子后,浸泡液电导率如图4所示。赤霉素溶液浸种24 h后,随赤霉素浓度上升,电导率逐渐上升,表明赤霉素可以打破杜仲种子休眠,引起种子内部活动,从而促进种子发芽。当赤霉素浓度高于400 mg/L时,电导率大于30 μS/cm,种子发芽率降低。赤霉素溶液浸泡杜仲种子36 h后,种子浸泡液电导率比浸泡24 h明显增大,且电导率均大于30 μS/cm,因此,赤霉素浸种时间不易超过24 h,否则会降低种子活力,导致种子不易发芽。
2.4赤霉素浸种对杜仲种子呼吸强度的影响
呼吸作用是指种子内活的组织在酶的参与下将贮藏的营养物质进行一系列氧化分解,同时释放能量的过程。一般种子在贮藏期间呼吸强度大,容易发生劣变,使得种子活力减少。呼吸强度常被作为研究植物生理器官活性的检测指标。不同浓度赤霉素处理杜仲种子后的呼吸强度如图5所示。随着赤霉素浓度上升,释放二氧化碳的量逐渐降低,杜仲种子的呼吸强度缓慢下降,表明赤霉素浸种对杜仲种子呼吸有抑制作用。
3结论与讨论
种子发芽势、发芽率可以直观地表示种子的发芽能力。该研究显示,当赤霉素浓度为0~400 mg/L时,杜仲种子的发芽势、发芽率随赤霉素浓度上升而增加;赤霉素浓度为400~600 mg/L时,杜仲种子发芽势、发芽率随赤霉素浓度增加而降低。说明赤霉素浓度能在0~400 mg/L打破杜仲种子休眠,对杜仲种子发芽起促进作用;当赤霉素浓度超过400 mg/L,会抑制杜仲种子发芽。此外,该研究发现土壤培养的杜仲种子发芽效果优于培养皿培养,并且土壤培养的杜仲种子株高显著高于培养皿培养的种子,长势也优于培养皿培养的种子,这可能是由于土壤中含有一定的营养物质,并且土壤会起到一定的保温作用。
当植物遭受不利环境胁迫或种子本身衰老时,细胞膜系统会发生变化[12],丙二醛是膜脂过氧化的重要产物,因此可用丙二醛含量来表示植物细胞遭受的逆境程度[13]。丙二醛含量的高低,可反映出植物遭受逆境的程度大小。该研究发现,随赤霉素浓度增加,丙二醛含量呈先升后降再上升的趋势,当赤霉素浓度高于400 mg/L时,杜仲种子遭受逆境程度过大,种子内部结构被严重破坏,不再促进发芽,因此超过400 mg/L 的赤霉素浓度不再适宜促进杜仲种子发芽。
植物细胞膜对维持细胞正常内部结构有保护作用[14]。细胞膜具有选择透性力[15],植物在受到外界环境的影响时,细胞膜会受到损坏,不能再选择性进行膜内外的物质交换,细胞膜透性增大,内外部的电离子会发生变化,而导致浸泡液的电导率发生变化,因此可用浸泡液电导率的大小判断杜仲种子受到的影响。该研究中,当处理时间为36 h时,各浓度赤霉素处理后的种子浸泡液电导率都在30 μS/cm以上,说明种子受伤害程度较大,活力降低,在试验中发芽效果也不明显。处理时间为24 h,浓度高于400 mg/L时,种子的电导率也高于30 μS/cm,且在600 mg/L时,电导率达40 μS/cm,此时种子基本失去活性,不能再发芽。因此,赤霉素溶液处理杜仲种子时间应控制在24 h以内,才能有效促进杜仲种子发芽,达到预期效果,并且赤霉素的浓度应控制在0~400 mg/L。
发芽势、发芽率、种子呼吸强度、丙二醛含量、电导率等都是衡量种子活性的指标[16],该研究通过观察杜仲种子的发芽势、发芽率、呼吸强度、丙二醛含量、电导率值等,得出赤霉素促进杜仲种子发芽的最适浓度为400 mg/L。培养皿培养和土壤培养2种方法比较,土壤培养更适合于促进杜仲种子发芽。
参考文献
[1] 杜竹静,刘鸿岩.杜仲种子繁殖栽培技术[J].现代农业科技,2009(3):47.
[2] CHEN W D,PENG P H,LI X W,et al.The geochemical features of genuine Eucommia ulmoides Oliv.producing area in longmen mountains[J].Medicinal plant,2013,4(5):79-82.
[3] OPENSHAW K.A review of Jatropha curcas:An oil plant of unfulfilled promise[J].Biom Bioener,2000,19:1-15.

