ERO1α慢病毒过表达载体的构建及其在RAW264.7细胞中稳定表达
戴安娜 胡佳慧 屈玉杏 刘婉洋 许显玉

摘要[目的]构建小鼠ERO1α基因慢病毒过表达载体,并筛选其在RAW264.7细胞中稳定表达。[方法]利用PCR方法扩增ERO1α基因的CDS区并测序;将目的片段亚克隆到慢病毒过表达载体pCD513B-1上,构建pCD513B-ERO1α慢病毒过表达载体;通过病毒包装产生慢病毒并转导RAW264.7细胞;转导后的细胞进行嘌呤霉素抗性筛选,获得稳定表达的细胞;利用RT-qPCR和Western blot方法检测ERO1α的表达效果。[结果]ERO1α慢病毒过表达载体构建成功,病毒滴度为5×106~10×106 TU/mL;慢病毒成功转导RAW264.7细胞并且稳定高表达。[结论]成功构建ERO1α慢病毒过表达载体,并在RAW264.7细胞中稳定高表达,为进一步研究ERO1α在免疫系统中的功能提供了技术支持。
关键词慢病毒;ERO1α;过表达;RAW264.7细胞
中图分类号S-852文献标识码A
文章编号0517-6611(2019)02-0089-05
doi:10.3969/j.issn.0517-6611.2019.02.026
内质网氧化还原酶1α(endoplasmic reticulum oxidoreductase 1α,ERO1α)是内质网中的重要氧化还原酶,属于ERO1蛋白家族。在內质网蛋白质折叠过程中,ERO1α通过特异性识别蛋白质二硫键异构酶(protein disulfide isomerase,PDI)对分泌蛋白和膜蛋白二硫键形成起到至关重要的作用[1-3]。近年来,研究发现ERO1α在多种肿瘤细胞和癌症中高表达,且过表达ERO1α有利于肿瘤的生长[4]。研究发现ERO1α通过上调血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,激活肿瘤血管生成信号从而促进肿瘤的生长[5]。除此之外,ERO1α通过促进粒细胞集落刺激因子(granulocyte colonystimulating factor,G-CSF)、趋化因子[chemokine (C-X-C motif) ligand 1/2,CXCL1/2]和主要组织相容性复合体I(major histocompatibility complex,MHC class I)的表达,抑制机体的免疫应答从而使得肿瘤增强免疫耐受和逃逸[6-7]。虽然ERO1α在机体免疫方面的研究越来越多,但是对于相关分子机制的研究报道还是很少。笔者通过构建ERO1α慢病毒过表达载体并稳定转导小鼠巨噬细胞系RAW 264.7细胞,以期为进一步研究ERO1α的免疫调节作用奠定基础。
1材料与方法
1.1材料
1.1.1主要细胞、载体和细菌。RAW264.7细胞、HEK293T细胞、慢病毒过表达载体(穿梭载体)pCD513B-1、慢病毒包装辅助载体pGag/Pol、pRev和pVSV-G,均由西北农林科技大学靳亚平教授馈赠;pMD19-T载体,购自大连TaKaRa生物工程有限公司;大肠杆菌DH5α感受态细胞,购自北京天根生物技术有限公司。
1.1.2主要试剂。Total RNA提取试剂盒、逆转录试剂盒、PrimeSTARTM HS DNA Polymerase、PrimeScriptTM RT Reagent Kit和TB GreenTM Premix Ex TaqTMⅡ等,购自大连TaKaRa生物工程有限公司;DMEM(高糖)培养液、Advanced DMEM培养液、Opti-MEM培养液和胎牛血清(fetal bovine serum,FBS)等,购自美国Invitrogen贸易有限公司;TurboFect转染试剂,购自加拿大Fermentas公司;ERO1α兔多克隆抗体,购自台湾Abnova生技股份有限公司;β-actin鼠单克隆抗体,购自天津三箭生物技术有限公司。
1.1.3主要仪器。Ti-E倒置荧光显微镜(日本Nikon公司);Tanon 5200全自动化学发光/荧光图像分析系统(上海天能科技有限公司);5810R型冷冻高速离心机(Eppendorf公司);Bio-Rad iQ5实时荧光定量PCR仪(美国伯乐公司)。
1.2方法
1.2.1引物设计与合成。根据NCBI中小鼠ERO1α基因序列(Accession No.AF144695.2),应用Primer 5.0软件设计ERO1α基因的特异性引物,用于CDS区的扩增,在引物5′端添加Xba I和BamH I酶切位点,引物由上海生工生物工程有限公司合成,引物序列如下:上游引物5′-ATTCTAGAATGGGCCGCGCCTGGGG-3′(下划线为Xba I酶切位点),下游引物5′-TGGGATCCTCAGTGAACATTCTGTAACAAGTGCCTG-3′(下划线为BamH I酶切位点)。
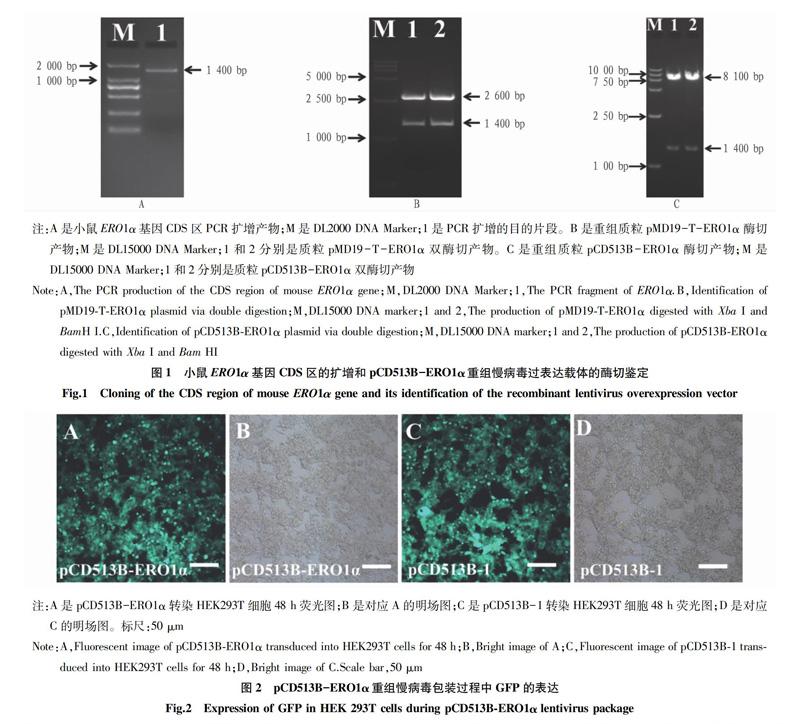
1.2.2ERO1α基因扩增和重组慢病毒过表达载体的构建。利用Total RNA提取试剂盒提取RAW264.7细胞总RNA,分光光度计测定其浓度和纯度。通过逆转录试剂盒合成cDNA,利用PrimeSTAR HS DNA Polymerase 扩增ERO1α基因的CDS区,PCR反应条件为94 ℃预变性5 min;98 ℃变性10 s,57 ℃退火5 s,72 ℃延伸1.5 min,共计30个循环;72 ℃延伸10 min。PCR产物进行核酸凝胶电泳检测,利用胶回收试剂盒进行纯化回收。回收后的片段进行末端加A反应并与pMD19-T载体连接,转化DH5α感受态细胞,37 ℃培养过夜并提取质粒,酶切鉴定并送上海生工生物工程有限公司测序。测序正确的片段与线性化的穿梭载体pCD513B-1连接,转化培养和提取质粒,酶切鉴定,并命名为pCD513B-ERO1α。
2.4pCD513B-ERO1α过表达效果的测定嘌呤霉素筛选后的RAW264.7细胞提取mRNA和蛋白并进行RT-qPCR和Western blot过表达效果检测。由图5A可知,RT-qPCR结果显示,未处理Control组和pCD513B-1组相比无统计学差异,pCD513B-ERO1α组与Control组和pCD513B-1组相比,ERO1α的mRNA表达显著升高(P<0.001)。由图5B可知,Western blot结果显示,pCD513B-ERO1α组的ERO1α蛋白表达量显著高于Control组和pCD513B-1组。
3结论与讨论
ERO1α是内质网中的重要氧化还原酶,在内质网蛋白质折叠过程中,有助于分泌蛋白和膜蛋白二硫键的生成[1-3]。随着对ERO1α研究的不断深入,研究发现ERO1α对于肿瘤对机体免疫抑制和逃避起着非常重要的作用,且过表达ERO1α有助于肿瘤的生长以及肿瘤细胞的增殖[4-7]。为了进一步研究ERO1α对机体免疫调节的分子机制,成功构建了ERO1α重组慢病毒过表达载体pCD513B-ERO1α,且稳定转染RAW264.7细胞。
RAW264.7细胞来源于BALB/c小鼠,是一种永生化的巨噬细胞系,在研究免疫应答反应过程中起到非常重要的作用[11]。慢病毒转导RAW264.7细胞48 h后荧光显微镜下能够观察到较强的GFP表达。该试验采用的是第三代慢病毒载体,即四质粒系统,相比于第一代和二代慢病毒载体其生物安全性更高,病毒包装效率更高。与其他的载体系统相比,慢病毒载体能够携带较长的目的基因片段和稳定高效地转导细胞系或原代细胞,并且不会启动细胞的免疫应答机制[12]。慢病毒转导RAW264.7细胞后能够将携带的ERO1α基因插入到细胞自身基因组内并长期稳定表达,通过嘌呤霉素的筛选作用获得稳定表达ERO1α的细胞克隆。细胞克隆能够继续培养和传代,并保持对ERO1α的过表达效果。通过对转导后的RAW264.7细胞的检测,发现pCD513B-ERO1α重组慢病毒过表达载体能够显著增加ERO1α的过表达效果,证实该载体构建成功。
总之,该研究通过扩增ERO1α的CDS区并亚克隆到慢病毒载体pCD513B-1上,成功构建了pCD513B-ERO1α慢病毒过表达载体。通过转导RAW264.7细胞并进行抗性筛选,成功筛选到稳定表达ERO1α的RAW264.7细胞,为后续研究ERO1α的免疫调节作用提供了技术支持。
参考文献
[1]POLLARD M G,TRAVERS K J,WEISSMAN J S.ERO1p:A novel and ubiquitous protein with an essential role in oxidative protein folding in the endoplasmic reticulum[J].Molecular cell,1998,1(2):171-182.
[2] FRAND A R,KAISER C A.ERO1p oxidizes protein disulfide isomerase in a pathway for disulfide bond formation in the endoplasmic reticulum[J].Molecular cell,1999,4(4):469-477.
[3] ARAKI K,NAGATA K.Functional in vitro analysis of the ERO1 protein and proteindisulfide isomerase pathway[J].The journal of biological chemistry,2011,286(37):32705-32712.
[4] KUTOMI G,TAMURA Y,TANAKA T,et al.Human endoplasmic reticulum oxidoreductin 1α is a novel predictor for poor prognosis of breast cancer[J].Cancer Sci,2013,104(8):1091-1096.
[5] MAY D,ITIN A,GAL O,et al.ERO1L α plays a key role in a HIF1mediated pathway to improve disulfide bond formation and VEGF secretion under hypoxia:Implication for cancer[J].Oncogene,2005,24:1011-1020.
[6] KUKITA K,TAMURA Y,TANAKA T,et al.Cancerassociated oxidase ERO1α regulates the expression of MHC class I molecule via oxidative folding[J].Journal of immunology,2015,194(10):4988-4996.
[7] TANAKA T,KAJIWARA T,TORIGOE T,et al.Cancerassociated oxidoreductase ERO1-α drives the production of tumorpromoting myeloid-derived suppressor cells via oxidative protein folding[J].Journal of immunology,2015,194(4):2004-2010.
[8] 陳风雷.小鼠Zhangfei基因过表达和shRNA干扰慢病毒载体的构建和鉴定[D].杨凌:西北农林科技大学,2013:42-43.
[9] CHEN F L,LIN P F,LI X,et al.Construction and expression of lentiviral vectors encoding recombinant mouse CREBZF in NIH 3T3 cells[J].Plasmid,2014,76:24-31.
[10] CHEN F L,LI Q,ZHANG J Y,et al.Silencing effect of lentiviral vectors encoding shRNA of Herp on endoplasmic reticulum stress and inflammatory responses in RAW 264.7 macrophages[J].Genetics and molecular research,2015,14(4):17587-17598.
[11] RASCHKE W C,BAIRD S,RALPH P,et al.Functional macrophage cell lines transformed by Abelson leukemia virus[J].Cell,1978,5(1):261-267.
[12] BLESCH A.Lentiviral and MLV based retroviral vectors for ex vivo and in vivo gene transfer[J].Methods,2004,33(2):164-172.

