分化型甲状腺癌术前原发肿物超声特征与术后颈部淋巴结转移的关系
高立霓,张敏,杨大雁,胡洁,刘丽莉
(海南省人民医院 1.超声科 2.普通外科,海南 海口570311)
过去几十年以来,甲状腺癌的发病率稳步上升[1-3]。根据美国国家癌症研究所的监测、流行病学和最终结果(SEER)数据库[4-6],2015年甲状腺癌的总发病率为15.04例/10万人。绝大多数(>90%)的甲状腺恶性肿瘤是分化型甲状腺癌,起源于甲状腺滤泡上皮,分化型甲状腺癌中乳头状甲状腺癌占85%~90%,滤泡状甲状腺癌占5%~10%[7]。近年来甲状腺癌总发病率的增加主要是由于乳头状甲状腺癌的发病率明显上升[8]。分化型甲状腺癌的主要治疗方法是手术[9-13],超声检查是术前确定淋巴结转移的主要手段[14-18],基于此,本研究旨在探讨分化型甲状腺癌术前原发肿物超声特征与术后颈部淋巴结转移的关系,以其为临床医生制定合适的手术方式提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2016年5月—2018年5月于我院经手术病理证实为分化型甲状腺癌的217例患者临床资料。纳入标准:⑴患者年龄18~75岁;⑵术前行超声检查并经手术病理证实为分化型甲状腺癌[19]。排除标准:合并其他器官或脏器恶性肿瘤者;有甲状腺手术病史;既往采用碘131治疗。本研究经过本院伦理委员会评审和批准,且所有患者对本研究知情同意。217例患者中男68例,女149例;年龄18~74岁,平均年龄(44.5±9.7)岁;术后病理:乳头状癌212例,滤泡状癌5例。101例发生淋巴结转移(转移组);116例未发生淋巴结转移(对照组)。
1.2 检测仪器
采用Philips EPIQ7,GE Logiq 9彩色多普勒超声诊断仪,探头频率为5~12 MHz。
1.3 观察指标
评估患者甲状腺和双侧颈部淋巴结的具体情况,统计淋巴结收缩期最高流速、搏动指数、阻力指数,分析甲状腺原发肿物的部位、数目、大小、纵横比、边缘、边界、与甲状腺被膜接触面积、内部回声、回声的均匀性、微钙化、内部血流情况与淋巴结转移的关系[20-26]。
1.4 淋巴结转移的诊断标准
⑴微小钙化灶;⑵液化或囊性区;⑶多发团片样高回声区;⑷血供丰富或较丰富;⑸淋巴结长短径比<2;⑹淋巴结结构欠清晰、淋巴门消失。具有⑴或⑵,或⑶~⑹中2个或2个以上即为转移淋巴结。
1.5 统计学处理
采用SPSS 20.0进行统计学分析本研究所得数据,计量资料采用均数±标准差(±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 术前超声对分化型甲状腺癌患者颈部淋巴结转移的诊断性能
术前超声在转移组(n=101)中诊断正确92例,诊断错误9例;在对照组(n=116)中诊断正确110例,诊断错误6例。术前超声对分化型甲状腺癌颈部淋巴结转移的诊断敏感度、特异度、准确性、阳性预测值、阴性预测值、漏诊率、误诊率分别为91.1%(92/101)、94.8%(110/116)、93.1%(202/217)、93.9%(92/98)、92.4%(110/119)、8.9%(9/101)、5.2%(6/116)。
2.2 两组分化型甲状腺癌患者的颈部淋巴结超声特征比较
转移组患者淋巴结收缩期最高流速和搏动指数均高于对照组,差异有统计学意义(P<0.05)。两组阻力指数无统计学差异(P>0.05)(表1)。
表1 两组分化型甲状腺癌患者的颈部淋巴结超声特征比较(±s)
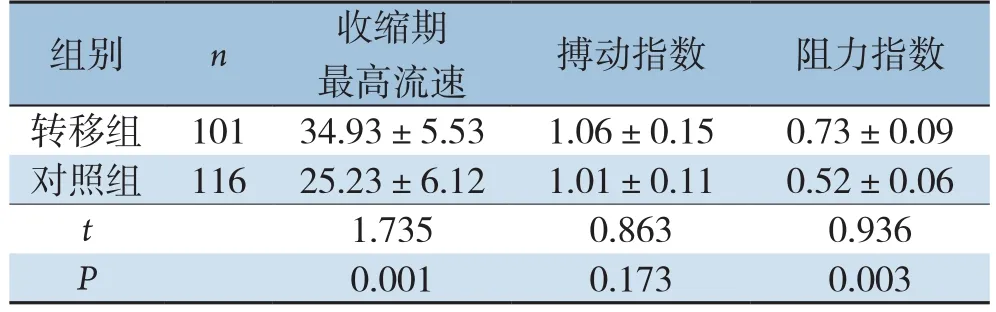
表1 两组分化型甲状腺癌患者的颈部淋巴结超声特征比较(±s)
组别 n 收缩期最高流速 搏动指数 阻力指数转移组 10134.93±5.531.06±0.150.73±0.09对照组 11625.23±6.121.01±0.110.52±0.06 t 1.7350.8630.936 P 0.0010.1730.003
2.3 分化型甲状腺癌患者的临床特征、原发肿物超声特征与颈部淋巴结转移的单因素分析
转移组与对照组患者的性别与年龄的差异均无统计学意义(P>0.05);转移组原发肿物的部位、边缘、边界、内部回声、回声的均匀性与对照组均无统计学差异(P>0.05),但原发肿物的数目、大小、纵横比、与被膜接触面积、微钙化、内部血流与对照组比较有统计学差异(P<0.05)(表2)。
2.4 分化型甲状腺癌患者原发肿物超声特征与颈部淋巴结转移的多因素分析
Logistic回归分析结果显示,原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富为分化型甲状腺癌患者颈部淋巴结转移的独立危险因素(P<0.05),原发肿物数目、大小、纵横比与分化型甲状腺癌患者颈部淋巴结转移关系不明显(P>0.05)(表3)。

表2 分化型甲状腺癌患者的临床特征、原发肿物超声特征与颈部淋巴结转移的单因素分析[n(%)]

表3 分化型甲状腺癌患者原发肿物超声特征与颈部淋巴结转移的多因素分析
3 讨 论
全世界甲状腺癌的发病率一直在上升。在美国,2016年男性和女性甲状腺癌新发病例超过64300例,死亡1980例,患者易发生颈淋巴结转移[27]。通过适当的规范化治疗,如手术和放射性碘消融术,大多数分化型甲状腺癌患者的预后良好,10年生存率为80%~90%。尽管如此,高达20%的患者可能会发生局部复发,甚至少数患者会进展,导致致命性的结果。颈部淋巴结转移不仅影响分化型甲状腺癌的治疗策略,而且是分化型甲状腺癌的重要预后指标[4]。现代影像学的最新进展使人们能够准确地识别颈部淋巴结区内受累或可疑的淋巴结,由经验丰富的超声医生对颈部淋巴结进行仔细的辨识,有助于外科医生在术中进行定向的(或选择性的)淋巴结清扫,而不需要广泛的改良根治性淋巴结清扫[28]。为了给术中淋巴结的精准清扫提供指导依据,本文重点探讨分化型甲状腺癌术前原发肿物超声特征与术后颈部淋巴结转移的关系。
本研究结果显示,术前超声对分化型甲状腺癌颈部淋巴结转移的诊断敏感度、特异度、准确性、阳性预测值、阴性预测值、漏诊率、误诊率分别为91.1%(92/101)、94.8%(110/116)、93.1%(202/217)、93.9%(92/98)、92.4%(110/119)、8.9%(9/101)、5.2%(6/116)。可见术前超声成像诊断分化型甲状腺癌颈部淋巴结转移与病理诊断结果吻合度较高。既往有文献[29]报道术前超声诊断颈部淋巴结的诊断灵敏度为85.4%,略低于本文报道的91.1%,这可能是由于本研究中所有超声诊断均由2名副主任医师共同确认,故诊断性能稍高。还有研究[23]报道超声对颈部中央区淋巴结的诊断灵敏度为35.3%,这可能是由于中央区淋巴结位置较深,而本研究既包含颈侧区淋巴结,也包含中央区淋巴结,因此总体诊断率较高。
本研究中转移组患者淋巴结收缩期最高流速和搏动指数均高于对照组(P<0.05);两组阻力指数无统计学差异(P>0.05)。说明淋巴结收缩期最高流速和搏动指数对分化型甲状腺癌患者颈部淋巴结转移有重要的预测价值,也有研究[30]发现了这一现象,提示临床超声医生在检查时要注意关注收缩期最高流速和搏动指数指标的变化,以便及时筛查出已出现淋巴结转移的患者,为手术方案的准确制定提供科学依据。
进一步分析结果显示,转移组与对照组患者的性别与年龄的差异均无统计学意义(P>0.05)。转移组原发肿物的部位、边缘、边界、内部回声、回声的均匀性与对照组均无统计学差异(P>0.05),但原发肿物的数目、大小、纵横比、与被膜接触面积、微钙化、内部血流与对照组相比差异显著(P<0.05)。Logistic回归分析结果显示,原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富为分化型甲状腺癌患者颈部淋巴结转移的独立危险因素(P<0.05),原发肿物数目、大小、纵横比与颈部淋巴结转移关系不明显(P>0.05)。赵博等[21]研究证实患者年龄(<45岁)、甲状腺原发肿物侵犯或紧邻甲状腺被膜以及肿物的丰富血流为分化型甲状腺癌颈部淋巴结转移的独立危险因素,而在本研究中并未发现年龄因素对淋巴结转移的影响,可能与他们的研究中纳入的年轻患者较多有关,也体现出目前分化型甲状腺癌的发病率呈年轻化态势。王晓庆等[23]研究发现,直径>1 cm、微小钙化、被膜侵及的长度/结节周长≥1/4时,伴颈部淋巴结转移的风险较大。殷德涛等[20]研究结果与本文一致,未发现性别、年龄、病灶大小与淋巴结转移的关系,多项研究[21-23]都证实原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富的患者极易发生淋巴结转移,这可能是因为:⑴甲状腺恶性程度较高时,癌细胞繁殖速度较快,向甲状腺包膜外侵袭的程度会更深[21],更易发生淋巴结转移;⑵砂粒体前体由肿瘤细胞中完整的蛋白质组成,释放到局部组织中继而发生钙化,肿瘤内砂粒体可随着肿瘤细胞通过血运或淋巴转移至结节外的腺体或颈部淋巴结[22];⑶肿物内部血流丰富一般提示结节较大,且恶性程度高[23],因此淋巴结转移的可能性更大。
综上所述,分化型甲状腺癌原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富为分化型甲状腺癌患者颈部淋巴结转移的高危因素,临床针对此类患者,术前超声医生应更仔细地寻找淋巴结转移征象,关注收缩期最高流速和搏动指数指标的变化,对淋巴结进行术前定性、定量、定位,外科医生应据此制定精准化、个性化的手术方案。因此,多学科协作对于优化分化型甲状腺癌患者的管理至关重要。未来我们将从早期诊断、有效治疗及随访和预后评估等多方面入手[31-34],为分化型甲状腺癌的治疗和预后提供更高质量的医疗服务。

