乳腺癌组织中cIAP1、XIAP和caspase-3的表达及其临床意义
汪灵,吴至佛,邓增艳,刘桂,刘君杰,黄俊辉
(中南大学 1.湘雅医院 肿瘤科;2.湘雅口腔医院 病理科,湖南 长沙410008)
乳腺癌是全球女性最常见的恶性肿瘤,而其发生机制尚未完全阐明,有研究[1-2]表明可能与细胞自噬和凋亡有关。细胞凋亡抑制蛋白(inhibitors of apoptosis proteins,IAPs)可通过影响细胞凋亡使肿瘤得以存活和增殖,是潜在的抗肿瘤治疗靶点之一[3-4]。细胞凋亡抑制蛋白1(cellular IAP1,cIAP1)和X染色体连锁凋亡抑制蛋白(X chromosome-linked IAP,XIAP)均属IAPs家族,cIAP1参与了多种外在凋亡信号通路的转导,XIAP蛋白是IAP家族成员中作用最强的半胱天冬酶(cysteinyl aspartate-specific protease,caspase)抑制剂[5],虽然已发现两者在多种肿瘤组织中高表达,但在乳腺癌中关于cIAP1和XIAP的研究相对较少。caspase家族是细胞凋亡级联反应的真正执行者,caspase-3作为下游效应型caspase,是调控细胞凋亡的枢纽。探究caspase-3在乳腺癌中的表达可有效评估组织凋亡特性及其在肿瘤发生发展中的作用,caspase-3的表达水平与乳腺癌患者预后的关系尚存在争议。文献研究表明新辅助化疗可能会改变乳腺癌的组织病理学特性或生物学因子的表达情况,而新辅助化疗是否对蛋白表达与乳腺癌患者的预后关系产生影响仍需进一步研究。
本研究通过检测乳腺癌组织、乳腺纤维腺瘤和正常乳腺组织中cIAP1、XIAP和caspase-3的表达情况,并结合乳腺癌数据库中的患者资料,旨在探讨3个凋亡相关蛋白与乳腺癌的临床病理参数的联系及其作为乳腺癌诊断和评估预后的生物学标志物的可行性。
1 材料与方法
1.1 研究对象
收集2016年9月—2018年9月于中南大学湘雅医院诊治的99例乳腺癌患者作为实验组,采集其乳腺癌根治术术后标本。患者年龄26~76岁,中位年龄48岁。其中50例患者既往接受过新辅助化疗,49例患者术前未接受过任何肿瘤相关治疗。实验组中非浸润性癌1例,特殊类型浸润性癌4例,非特殊类型浸润性癌94例;HER-2过表达型7例,Luminal A型11例,Luminal B型29例,三阴性乳腺癌(TNBC)52例。纳入标准:⑴肿瘤原发于乳腺;⑵经病理学检查确诊为乳腺癌,有完整临床病理资料;⑶KPS评分≥70分。排除标准:⑴合并其他类型恶性肿瘤;⑵远处转移。同时收集同期10例乳腺纤维腺瘤标本,及6例肿瘤边缘5 cm以上的正常乳腺组织为对照。该研究方案经中南大学湘雅医院伦理委员会批准。
1.2 免疫组织化学法检测cIAP1、XIAP和caspase-3蛋白的表达
抗cIAP1抗体及抗XIAP抗体购自美国Abcam公司,caspase-3抗体购自美国Affinity公司。所有标本均采用EliVision免疫组化方法进行检测。组织标本经石蜡包埋,连续切片,厚度约4 μm。60℃烤箱烤片1 h后脱蜡水化,切片在0.01 mol/L柠檬酸钠缓冲液中(pH6.0)高温高压抗原修复,用3%H2O2孵育20 min阻断内源过氧化物酶活性后,5%BSA封闭30 min,分别滴加cIAP1,XIAP和caspase-3一抗(工作液浓度均为1:100)4℃孵育过夜。在室温下滴加HRP标记的抗兔IgG孵育50 min,随后通过DAB显色。苏木精复染,脱水、封片。用PBS分别代替3种蛋白的一抗作阴性对照实验。
1.3 染色结果判定
严格控制显微镜的摄片照明及参数设定条件一致,将组织切片放大200倍,随机选取5个视野摄片,通过Image-Pro Plus 6.0对各蛋白表达情况进行定量分析。测量每个视野中目标组织的积分光密度及区域面积,计算平均光密度,取5个视野的平均值进行分析。
1.4 生物信息学分析
利用Kaplan-Meier Plotter数据库,分别根据cIAP1,XIAP和caspase-3的表达量,选择其最佳截断值将纳入的乳腺癌病例分为两组,比较两组乳腺癌患者的无复发生存期的差异,分析这3种蛋白的表达量和患者预后的关系。
1.5 统计学处理
应用SPSS 24.0对数据进行统计学分析,Kruskal-Wallis检验用于评估组间蛋白含量的差异;χ2检验,Fisher精确检验来分析组间各分类变量间的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 cIAP1、XIAP和caspase-3在乳腺癌组织、乳腺纤维腺瘤和正常乳腺组织中的表达
在实验组、良性对照组和正常对照组样本中均可观察到不同程度的cIAP1,XIAP和caspase-3蛋白的阳性表达,阳性染色为棕黄色或棕褐色颗粒。cIAP1阳性染色主要见于细胞质中;XIAP和caspase-3在细胞质和细胞核均可见表达,三者在乳腺癌中的表达情况见图1。运用Image-Pro Plus对各组蛋白表达情况进行定量评估,分析发现,在乳腺癌组织中cIAP1、XIAP和caspase-3的表达水平均明显高于正常乳腺组织中该蛋白的表达水平(均P<0.05),而以上3种蛋白在乳腺癌组织和乳腺纤维腺瘤组织中的表达间无统计学差异(均P>0.05)。根据患者接受根治性手术前有无行新辅助化疗,将实验组进一步分为化疗组和未化疗组。结果显示,cIAP1、XIAP和caspase-3的表达水平在化疗组和未化疗组间无统计学差异(均P>0.05)(表1)。
2.2 cIAP1、XIAP 及 caspase-3的表达和乳腺癌临床病理参数的关系
为了探讨cIAP1、XIAP及caspase-3的表达与乳腺癌临床病理参数的关系,分别以cIAP1、XIAP和caspase-3平均光密度值的中位数为临界值将99例乳腺癌患者分为高表达组和低表达组。cIAP-1、XIAP和caspase-3的高、低表达在不同肿瘤临床病理参数患者中的分布情况见表2。结果显示,cIAP1高表达的乳腺癌患者更集中于绝经前或年龄<50岁的患者中(P<0.05);XIAP高表达的乳腺癌患者更集中于Ki-67<20%的患者中(P<0.05);cIAP-1、XIAP和caspase-3的表达水平与其他临床病理参数无关,其中包括ER、PR、HER-2状态、分子分型等(均P>0.05)。
2.3 cIAP1、XIAP 和 caspase-3表达与乳腺癌患者生存期的关系
利用Kaplan-Meier Plotter数据库分析乳腺癌患者中cIAP1,XIAP和caspase-3的表达水平和预后的关系。结果显示,cIAP1高表达患者的无复发生存期与cIAP1低表达者无统计学差异(P>0.05),但进一步分组后发现在化疗组中cIAP1高表达患者呈现出生存时间更长的趋势(P=0.058)。总研究人群中,XIAP高表达患者的无复发生存期长于低表达者,进一步分组后发现,在化疗组中XIAP高表达患者的无复发生存期较低表达组更长(均P<0.05)。总研究人群中与未化疗组中,caspase-3高表达患者的无复发生存期较短,预后较差(均P<0.05);而在化疗组中caspase-3高表达组的无复发生存期较低表达组无统计学差异(P>0.05)(图2)。
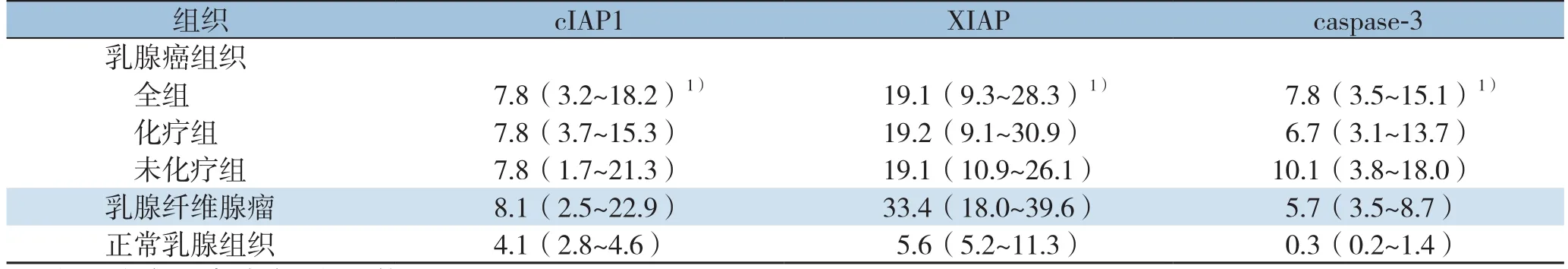
表1 乳腺癌、纤维腺瘤及癌旁正常组织中cIAP-1、XIAP和caspase-3的表达量[×10-3,M(P25~P75)]Table 1 Expression levels of cIAP-1,XIAP and caspase-3 in breast cancer,breast fibroadenoma and normal mammary tissue[×10-3,M(P25-P75)]
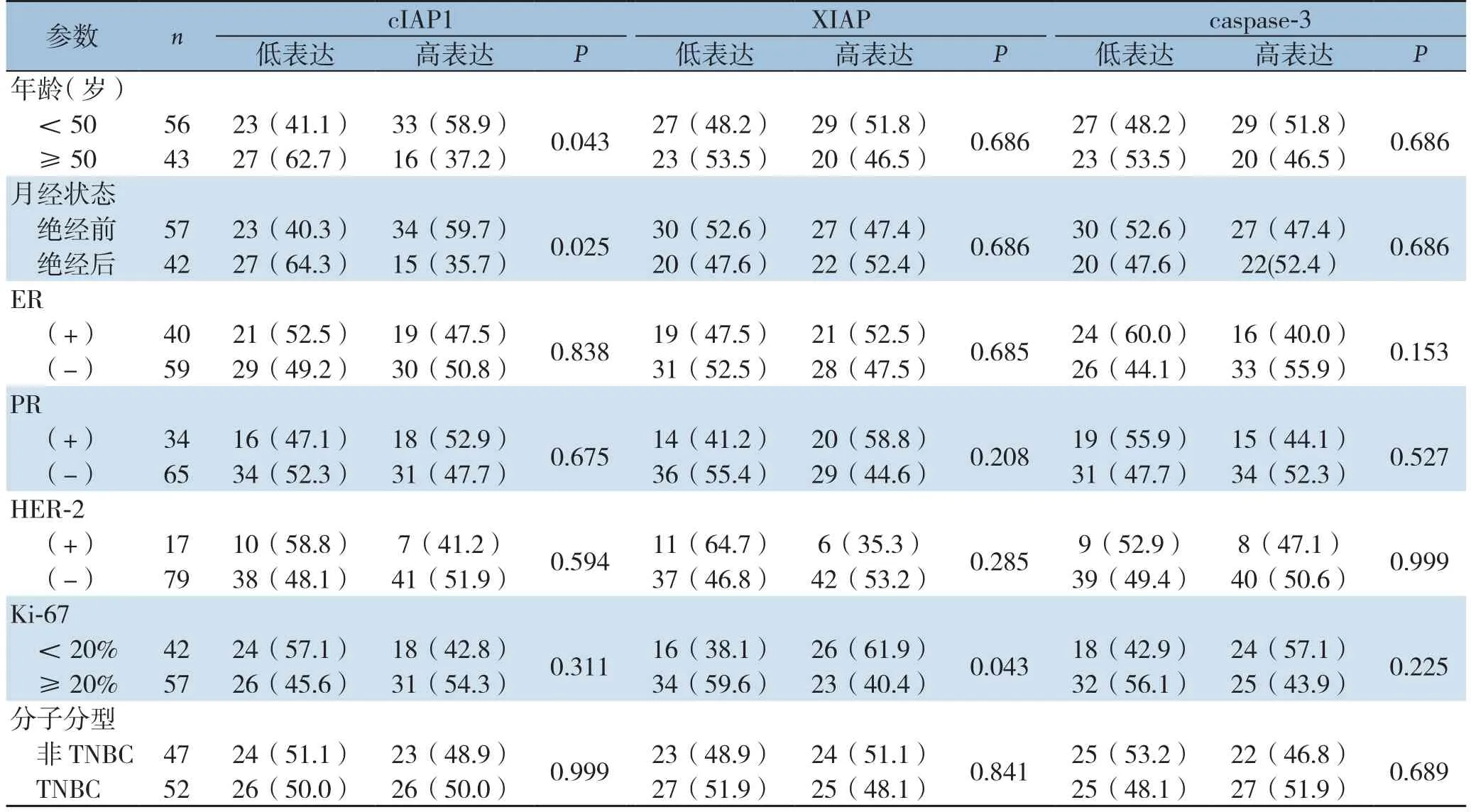
表2 乳腺癌组织中 cIAP-1,XIAP和caspase-3表达情况与临床病理参数的关系[n(%)]Table 2 Relations of expressions of cIAP-1,XIAP and caspase-3 with clinicopathologic parameters in breast cancer[n(%)]
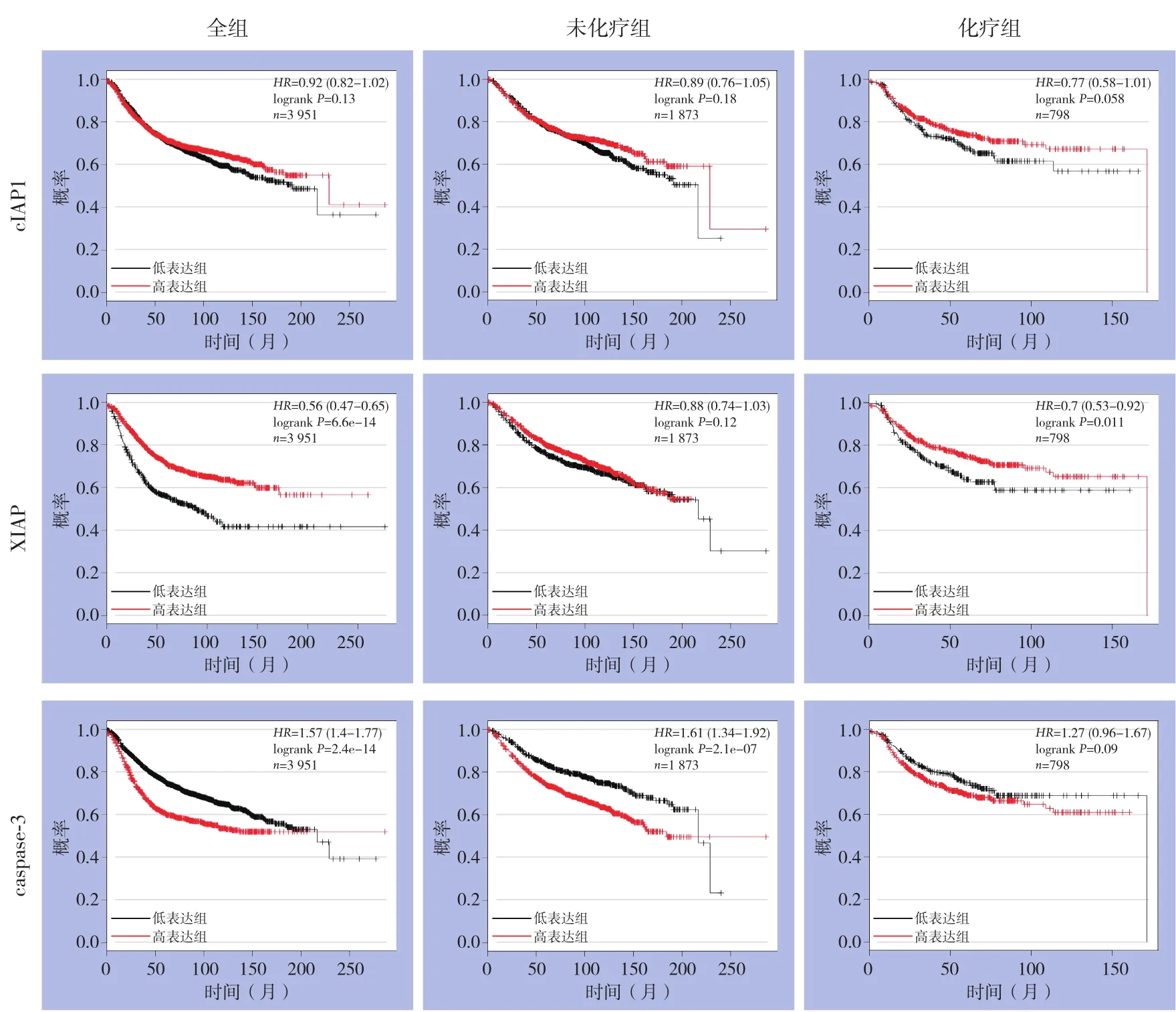
图2 乳腺癌组织中cIAP1、XIAP和caspase-3 蛋白的表达与预后的关系Figure 2 Relations of the expression of cIAP1,XIAP and caspase-3 proteins with prognosis of breast cancer
3 讨 论
国际癌症研究机构制定的GLOBOCAN 2018标准显示,预计2018年全球约有208万新发乳腺癌病例,该病的死亡人数为626679,乳腺癌仍然是威胁全球女性生命健康最高发的恶性疾病[6-7]。随着乳房检查、肿瘤标志物及钼靶X线等检查手段的广泛运用,乳腺癌的检出率得以提高,但仍有约40%的早期患者及大多数青年女性患者无法从中获益,因此临床亟待探寻高灵敏度、高特异性及准确率的乳腺癌诊断方法。
细胞凋亡是一种为维持内环境稳态的细胞自主的程序性死亡过程,凋亡信号的顺利转导有助于保护基因组稳定性,而细胞凋亡缺陷可能促使癌症的发生,规避凋亡是肿瘤的发病机制之一[8]。IAPs家族可参与调节细胞凋亡并促进肿瘤细胞的增殖、侵袭和转移。在哺乳动物细胞中IAPs家族共有8位成员,既往研究显示在肺癌,肝癌和卵巢癌等组织中cIAP1和XIAP均呈高表达,两者亦被发现高表达于乳腺癌组织及其细胞系中。IAPs家族的N端均包含1个或3个杆状病毒IAP重复结构域,该结构域可通过结合凋亡途径中的关键蛋白酶—caspase的活性位点来发挥其生物学作用[9]。其中,cIAP1和XIAP可通过与caspase-3结合抑制凋亡,三者相互作用发挥着调控及效应细胞凋亡的职能。
3.1 cIAP1,XIAP 和 caspase-3在乳腺癌中高表达
本研究发现,相较于正常乳腺组织,cIAP1、XIAP和caspase-3在肿瘤组织中的表达水平更高。Pluta等[10]采用流式细胞术对乳腺癌组织中的cIAP1表达水平进行分析,结果显示,相较于乳腺良性肿瘤,乳腺癌组织中cIAP1显著高表达(P<0.05)。Hussain等[11]通过测定中东地区乳腺癌中XIAP蛋白表达,研究结果示29.5%的乳腺癌组织呈XIAP高表达状态;Xu等[12]运用组织微阵列技术对100例乳腺癌组织及70例配对正常乳腺组织进行胞质中XIAP蛋白表达情况的检测,发现乳腺癌组织中的XIAP表达明显高于正常对照组(P<0.001)。Yang及其团队[13]通过对来自21项研究的3091例患者的数据进行Meta分析,结果指出,既往多项研究发现乳腺癌组织中caspase-3蛋白表达明显高于正常乳腺组织。综合数据表明,以上3种凋亡相关蛋白在乳腺癌中均有上调趋势,提示其异常表达可能破坏了细胞增殖与凋亡的动态平衡,阻滞了肿瘤细胞的凋亡进程,使肿瘤细胞得以存活和增殖,进而促使乳腺癌的发生、发展。
3.2 cIAP1,XIAP 和 caspase-3与临床病理参数的关系
乳腺癌是一种激素反应性肿瘤,其发生、发展和预后与体内性激素的分泌,特别是雌、孕激素和雄激素的水平密切相关。月经是雌、孕激素作用于子宫内膜后引起的周期性出血,是卵巢功能的外在表现,女性月经状态可在一定程度上反映机体内分泌水平。研究显示,雄激素作为合成雌激素的前体,其在绝经前[14]及绝经后[15]妇女体内的激素水平均与乳腺癌发生风险存在正相关,反映月经状态可能与乳腺癌的发生发展有关。本研究发现绝经前乳腺癌患者中高cIAP1表达水平的患者比例较高,推测cIAP1的表达水平可能与患者月经状态有关。
Ki-67被广泛用于评估肿瘤的增殖活性,除G0期外,它存在于细胞周期的各个阶段。参考St.Gallen标准[16],本研究以20%作为Ki-67的临界值,发现在Ki-67<20%的乳腺癌患者中,高XIAP表达水平的患者比例较高;Wang等[17]发现XIAP的高水平表达与增殖指数相关,本研究结果与其结果相符,提示XIAP不仅参与细胞凋亡的调节,还可能与细胞增殖有关。
本研究未发现caspase-3与年龄、月经状态、ER、PR、HER-2及Ki-67等临床病理参数相关,该结果与既往其他研究类似[18];此外,也有文献[19]报道乳腺癌中caspase-3的高表达与肿瘤组织中ER、PR、Her-2的阳性状态相关。结果的差异可能因研究人群、肿瘤异质性、caspase-3阳性临界值等不同而造成,上述结论有待于后续大样本的随机对照试验进行验证。
TNBC作为乳腺癌的一种特殊亚型,具有侵袭性强、易局部复发转移等特性,因其独特的生物学行为成为临床难点之一[20]。TNBC约占乳腺癌总体发病率的15%左右,本研究为探讨cIAP1、XIAP和caspase-3的表达在非TNBC与TNBC中是否存在差异,特增加TNBC病例数。研究结果示,3种凋亡相关蛋白的表达在非TNBC和TNBC间无统计学差异(P>0.05)。
3.3 cIAP1,XIAP和caspase-3的潜在临床价值
cIAP1的C-末端携带具有E3泛素连接酶的功能的RING(really interesting new gene)结构域,它能够通过泛素蛋白酶体途径降解目标蛋白并参与多种凋亡通路的信号转导。本研究发现在接受新辅助化疗的乳腺癌患者中cIAP1高表达患者的无复发生存期可能更长。Kempkensteffen等[21]认为cIAP1的高表达与肾细胞癌的良好预后相关;研究[22]发现下调cIAP1与尿路上皮癌细胞系的凋亡相关;然而也有研究[23]结果显示,cIAP1高表达是膀胱癌患者的不良预后因素。以上结果揭示cIAP1的表达可能与肿瘤预后存在相关性,但在不同肿瘤类型中其表达及意义存在差异,其相关机制有待进一步阐明。
XIAP是IAPs家族中最有潜力的成员,它可以直接结合caspase-3,caspase-7和caspase-9从而抑制caspase的蛋白水解活性来发挥抗凋亡的作用[24-25]。利用其抗细胞凋亡的特性,通过运用XIAP反义寡核苷酸和小分子抑制剂治疗肿瘤的新疗法成为了研究热点,相关试验已进入临床前研究和I、II期临床试验阶段[26-28]。诚然更多的研究致力于探讨XIAP对乳腺癌进展和化疗耐药方面的影响,而XIAP与乳腺癌的预后关系于临床治疗的指导仍有意义。本研究发现,XIAP对评估化疗后患者的预后可能存在参考价值,在化疗组中,XIAP高表达患者的无复发生存期较长,预后较好。Nestal de Moraes等[29]发现XIAP的高表达与乳腺癌患者的不良临床结局相关,本研究与该结论相反。Tamm等[30]在早期的研究中通过对76例原发性急性髓系白血病患者的XIAP表达情况及预后进行分析,发现高XIAP蛋白表达组的中位生存期及中位缓解时间较低表达组更短,即高XIAP蛋白水平可能与急性髓系白血病患者的生存率存在负相关。而其团队在后续的研究中,通过扩大试验样本量(n=172)发现这一相关性并不成立,考虑结果上的差异可能与疾病所处阶段及接受的治疗方案不同有关[31]。Ferreira等[32]通过免疫组化分析144例非小细胞肺癌患者XIAP的表达与预后关系时指出,XIAP高表达的患者其总生存期更长。为进一步探讨出现这一现象的原因,通过检测凋亡指数与增殖指数(如:有丝分裂指数和Ki-67阳性细胞百分率)研究细胞的凋亡及增殖情况,发现XIAP的表达水平与凋亡指数无明显相关性,而XIAP的高表达与低肿瘤增殖指数相关。
由于细胞的凋亡作用主要通过激活caspase-3来实现,因此检测乳腺肿瘤中凋亡效应因子caspase-3的表达能准确地反映其在肿瘤发生、发展中的作用。大量研究表明caspase-3的表达与乳腺癌密切相关,而caspase-3的表达水平与患者的预后关系在仍有争议。既往研究报道caspase-3的高表达与乳腺癌患者的不良预后相关[33-34],而部分研究得到相反的结论,即caspase-3表达的下调与肿瘤发展、侵袭和转移存在相关性[35]。本研究发现,在总研究人群中,caspase-3高表达患者的无复发生存期较短,预后较差。与文献报道的结果一致[36]:高表达水平的caspase-3与进展期乳腺癌患者肿瘤复发及存活率下降相关。caspase-3通常以无活性的酶原前体形式存在于细胞质中,一旦被激活为活化型caspase-3,细胞则进入了不可逆转的凋亡级联反应。研究表明,经放、化疗等抗肿瘤治疗后,细胞凋亡通路被激活引发凋亡,濒死的肿瘤细胞可通过旁分泌途径释放钙非依赖性磷脂酶A2(calcium-independent phospholipase A2,iPLA2)等介质,从而改变肿瘤周围微环境引发“凤凰涅槃”现象,刺激残存肿瘤细胞再增殖。caspase-3作为caspase-3/iPLA2或caspase-3/Pannexin 1“凤凰涅槃”信号通路的枢纽,活化的caspase-3可通过释放大量炎症介质进而促使肿瘤复发和转移。通过进一步的分析发现,在化疗组中caspase-3高、低表达组间的无复发生存期未表现出明显差异,而在未化疗组中caspase-3高表达患者的生存时间较短,反映总人群中两组间的差异主要集中在未化疗的患者,推测caspase-3对既往未接受过任何抗肿瘤治疗的患者的预后判断更有价值。
本研究通过对实验组进行亚组分析,发现cIAP1、XIAP和caspase-3的表达在未化疗组和化疗组间、非TNBC组和TNBC组间均无统计学差异(均P>0.05)。结果提示化疗可能不影响目标蛋白在乳腺癌患者中的表达,化疗前后的稳定表达使得靶蛋白作为乳腺癌潜在生物标志物成为可能。因本研究存在地域局限性,且入组病例数有限,尚需大样本随机试验验证文中观点。
综合本研究的结果表明,cIAP1、XIAP和caspase-3蛋白表达可能与乳腺癌的发生、发展相关,提示XIAP和caspase-3可作为判断乳腺癌预后的潜在指标,其中,XIAP适用于新辅助化疗后患者的预后评估,caspase-3有益于未接受化疗的患者的预后评价,但其实际的临床应用价值仍有待在更大的样本中探明。随着肿瘤分子医学的发展,人们对乳腺癌研究的逐渐深入,疾病诊治转向规范化和精准化。寻找可靠的生物标志物不仅能发掘乳腺癌早期筛查和诊断的新指标,同时还具有指导乳腺癌靶向治疗及评判预后的作用,对IAPs家族的进一步了解有望为乳腺癌的诊治提供新的思路。

