不同抗性短枝木麻黄种源苗木接种青枯病菌后酚类物质含量的变化
魏永成, 张勇, 仲崇禄, 孟景祥, 陈珍
不同抗性短枝木麻黄种源苗木接种青枯病菌后酚类物质含量的变化
魏永成, 张勇, 仲崇禄*, 孟景祥, 陈珍
(中国林业科学研究院热带林业研究所,广州 510520)
为了解短枝木麻黄()抗青枯病的机理,对接种青枯病菌()后短枝木麻黄的单宁和黄酮含量变化进行了分析。结果表明,不同抗性短枝木麻黄种源小枝的总酚和单宁含量呈现不同的变化趋势,高抗、中抗种源均呈现先升高后降低的变化趋势,峰值均约为126 mg g–1,但中抗种源的峰值出现时间较晚,而易感种源则呈逐渐升高趋势。抗、感种源木麻黄接种青枯菌后,小枝中缩合单宁含量均呈现逐渐升高的趋势,但高抗种源的缩合单宁含量均显著高于易感种源,增加70.33%。抗性种源黄酮含量呈S型上升趋势,易感种源则持续缓慢升高。这表明接种青枯病菌后,抗、感短枝木麻黄种源表现出不同的防御特征,次生物质含量增幅越大,抑菌抗氧化能力越强,短枝木麻黄表现出的抗性越强。
短枝木麻黄;青枯病菌;接种;单宁;黄酮
木麻黄抗风、耐瘠薄,是我国华南地区营建沿海防护林的先锋树种,在一些立地条件较差的前缘沙质地带,木麻黄甚至是唯一可造林的树种[1],具有显著的生态、经济价值[2–3]。青枯病()是一种危害严重、传播广泛的毁灭性土传病害, 该病传播速度快、发病死亡率高,可危害54科200余种植物,包括许多具有重要经济和社会价值的植物, 如烟草()、番茄()、马铃薯()、香蕉()和桉树(sp.)等[4],是世界范围内最难防治的细菌性重大病害之一[5]。青枯病是木麻黄的重要病害之一,严重影响我国华南沿海防护林的生态安全。青枯病菌作为一种土传细菌,具有传播速度快、变异大等特点,人们在化学防治和生物防治方面做了大量工作,但依然无法改变青枯病不断蔓延的趋势,如何有效防治青枯病已成为影响木麻黄发展的重要因素。植物在长期进化过程中形成的自身抗性是控制青枯病扩散的重要策略[6]。在影响植物抗病性的因素中,次生代谢物质是植物产生抗病性的重要生理生化基础,能够有效抑制病原菌在寄主体内的扩散与增殖,甚至直接杀灭病原菌[7]。
酚类物质是植物重要的次生代谢物质,参与许多生理生化过程,许多研究表明酚类物质在植物抵御病原物侵袭过程中发挥了重要作用[8]。受病原物侵袭后,可诱导植物产生大量可溶性酚类物质,抑制病原物的迁移和扩增[9]。细胞壁上的大量酚类物质也与植物的抗病性密切相关[10]。黄酮类化合物也可以抑制多酚氧化酶、细胞色素氧化酶等的活性,进而影响植物的抗病性[11–13]。综上,植物酚类物质和黄酮类化合物与植物抗性有密切关系,研究植物受到病原菌侵袭后酚类物质、黄酮类化合物的含量变化规律,可以在一定程度上反映植株的抗病特征。
本研究以选育的抗青枯病短枝木麻黄()高抗(R)、中抗(M)和易感(S)为材料,探讨感染青枯病后小枝中酚类物质和黄酮含量的变化规律,揭示短枝木麻黄对青枯病的抗性生理机理, 明确短枝木麻黄抗病与感病种源间的差异特征,为短枝木麻黄抗青枯病品种选育提供科学依据。
1 材料和方法
1.1 材料
于2017年5月在广东省徐闻县的种源试验林(2014年造林)中收集短枝木麻黄()材料,包括3个抗性种源(R、M和S),每种源选择50株,每株取10支幼嫩小枝,水培生根后移至营养杯培养。供试菌株为中国林科院热带林业研究所前期获得的高致病力青枯病菌() GL-3菌株[14]。
1.2 接种和取样
参考刘勇等[15]的方法,将GL-3菌株在TTC (2,2,3-三苯基四唑氯)培养基上活化48 h,选择单菌落接种到普通营养培养基中扩大培养24 h,然后接种到液体培养基中30℃摇床24 h。培养液静置30 min收集菌体,用蒸馏水将菌液稀释成3×109cfu mL–1用于接种。
2018年3月,大部分幼苗高度在40 cm以上,对幼苗进行接种处理。接种时将所有幼苗从土中取出,小心去掉土壤尽量避免幼苗根部损伤,用水洗净根部。剪掉约1/3根系,一半植株浸入30℃细菌悬浮液中(I, inoculation) 30 min,另外一半植株浸入蒸馏水作为对照(W)。将接种后的植株移栽至装有营养土(黄土∶泥炭土∶沙子=1∶1∶1)的塑料盆(长×宽×高= 40 cm×25 cm×8 cm)中,每盆20株。共6种组合(R-I、R-W、M-I、M-W、S-I、S-W),采用随机完全区组设计,每组合处理苗木4盆80株,重复3次,共12盆240株。接种后每天浇水,相对湿度控制在80%左右。
接种当天取中上部的功能小枝,以后每天固定时间取样1次,直至有植株完全枯萎死亡,共取样8次。每次取样时每组合随机选5株,-20℃冰箱保存备用。
1.3 指标测定
按王翠颖等[16–17]的方法提取和测定单宁和黄酮含量,总酚含量利用Folin-Ciocalteu试剂比色法测定[18],缩合单宁用丁醇/盐酸(95∶5)法测定[19]。3次重复,取平均值。
1.4 数据分析
利用SPSS 19.0和EXCEL 2007对数据进行统计分析,以均值±标准误表示。采用Duncan多重比较法对数据进行方差分析。
2 结果和分析
2.1 总酚含量
接种青枯菌后,不同抗性短枝木麻黄种源苗木小枝中的总酚含量呈现不同的变化趋势(表1)。高抗、中抗种源均呈现先升高后降低的趋势,但中抗种源的峰值出现时间较晚;易感种源则呈逐渐升高趋势,在感病末期虽略有下降,但整体水平较高。高抗短枝木麻黄接种青枯菌后,总酚含量迅速升高,在接种后2 d达最大值126.89 mg g–1,比对照高47.20%。随后迅速降低,接种后7 d与对照的差异不显著。中抗种源接种后,总酚含量也会迅速升高, 但直到接种后4 d才达最大值126.16 mg g–1, 比对照高39.22%,随后迅速降低,接种后5~7 d与对照差异不显著。易感种源受到青枯菌侵袭后,总酚含量持续上升,最大值(109.57 mg g–1)出现在第5天,接种后6 d时略微下降,在接种后7 d比对照高32.53%。
接种青枯菌后1 d,高抗、中抗、易感短枝木麻黄间的总酚含量差异不显著。接种2 d后,总酚含量依次为高抗>中抗>易感,高抗与易感种源间的差异显著。接种3~4 d后,中抗种源的总酚含量高于其余种源。接种后5~7 d,3种源间的差异不显著,且易感种源的总酚含量维持在较高浓度。
2.2 单宁含量
不同抗性种源短枝木麻黄接种青枯菌后,小枝中单宁含量的变化趋势与总酚含量的一致(表2)。高抗、中抗种源单宁含量呈现明显的先升后降的变化趋势,易感种源则持续升高,在接种后6~7 d略微下降。高抗种源接种青枯菌2 d后的单宁含量达最大(125.92 mg g–1),比对照高47.05%。中抗种源在接种后4 d达最大(125.41 mg g–1),比对照高39.58%。易感种源接种青枯菌5 d后达最大值,单宁含量比对照高19.56%。

表1 短枝木麻黄接种青枯菌后总酚含量(mg g–1)
R: 高抗种源; M: 中抗种源; S: 易感种源; I: 接种处理; W: 对照; 数据后不同字母表示差异显著(<0.05)。下同。
R: High resistant provenance; M: Media resistant provenance; S: Susceptible provenance; I: Inoculation; W: Control; Data followed different letters indicate significant difference at 0.05 level. The same is following Tables.
接种青枯菌后1 d,高抗、中抗和易感短枝木麻黄间的单宁含量差异不显著。接种2 d后的单宁含量依次为高抗>中抗>易感,且差异显著。接种4 d后,中抗种源的单宁含量显著高于高抗和易感。接种5~7 d后,3种源间的差异不显著,易感种源的单宁含量维持在较高水平。这表明高抗短枝木麻黄受到青枯菌侵袭后,能迅速大量合成单宁并有效发挥抗菌作用,而易感种源的单宁合成反应缓慢且效用不明显。
2.3 缩合单宁含量
不同抗性种源短枝木麻黄接种青枯菌后,小枝的缩合单宁含量均呈逐渐升高的变化趋势(表3)。接种青枯菌后7 d,高抗种源的缩合单宁含量达最大值13.03 mg g–1,比对照高70.33%,中抗和易感种源分别为10.36和10.2 mg g–1,分别比对照高19.35%和42.06%。高抗种源显著高于易感种源,这表明高抗、易感短枝木麻黄受到青枯菌侵袭后,均会诱导产生缩合单宁,但高抗种源的缩合单宁含量更高, 导致抵御青枯菌侵袭的效果不同。
2.4 黄酮含量的变化
不同抗性种源短枝木麻黄接种青枯菌后,小枝的黄酮含量呈逐渐升高的变化趋势(表4)。其中,高抗、中抗种源的黄酮含量呈S型上升趋势,易感种源则持续缓慢升高。高抗种源接种青枯菌后5 d的黄酮含量达最大值56.66 mg g–1,比对照高35.68%,中抗种源在接种后7 d达最大值54.08 mg g–1,比对照高27.49%,而易感种源接种青枯菌7 d后,黄酮含量比对照高14.54%。
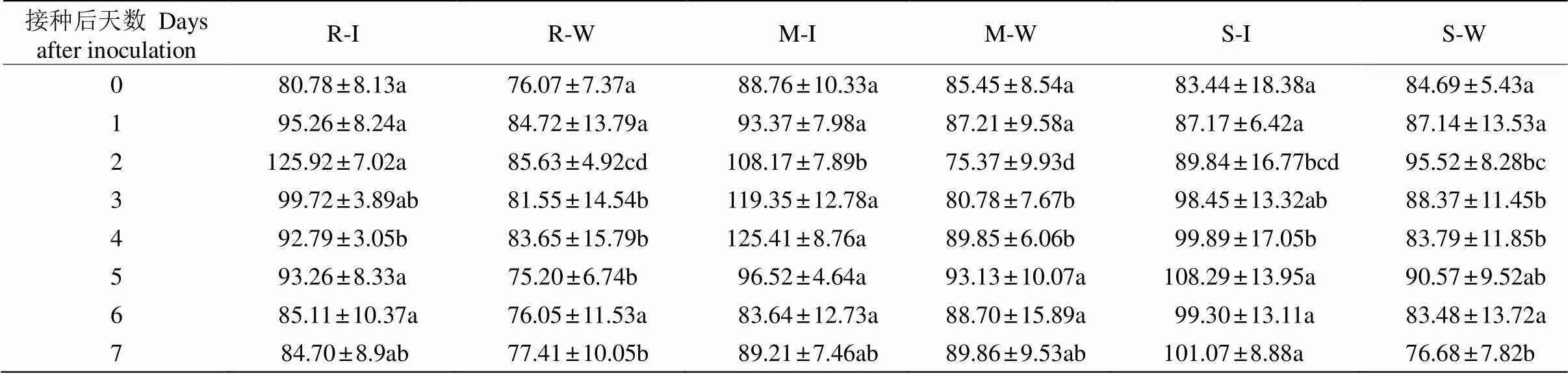
表2 短枝木麻黄接种青枯菌后单宁含量(mg g–1)
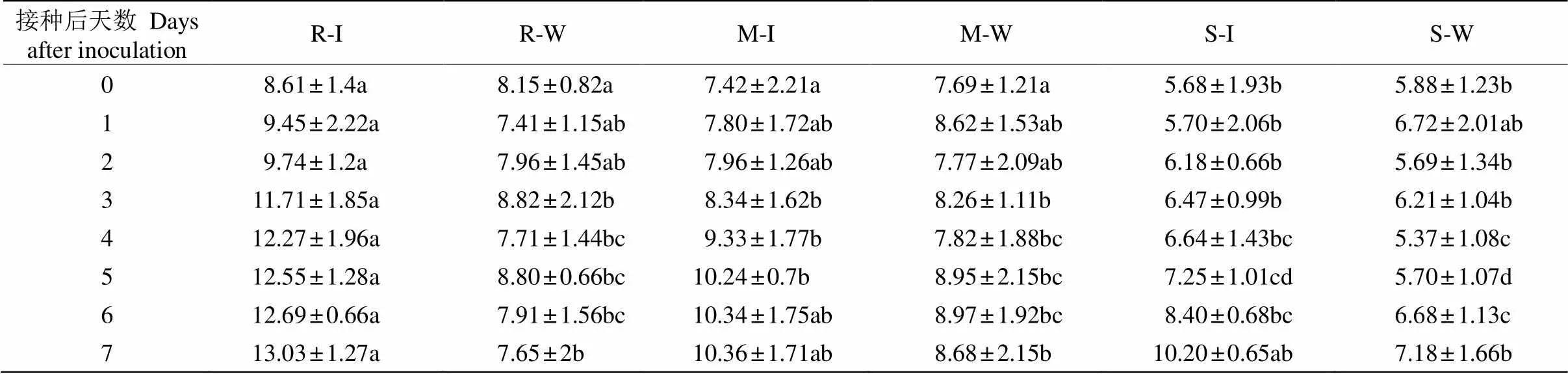
表3 短枝木麻黄接种青枯菌后缩合单宁含量(mg g–1)
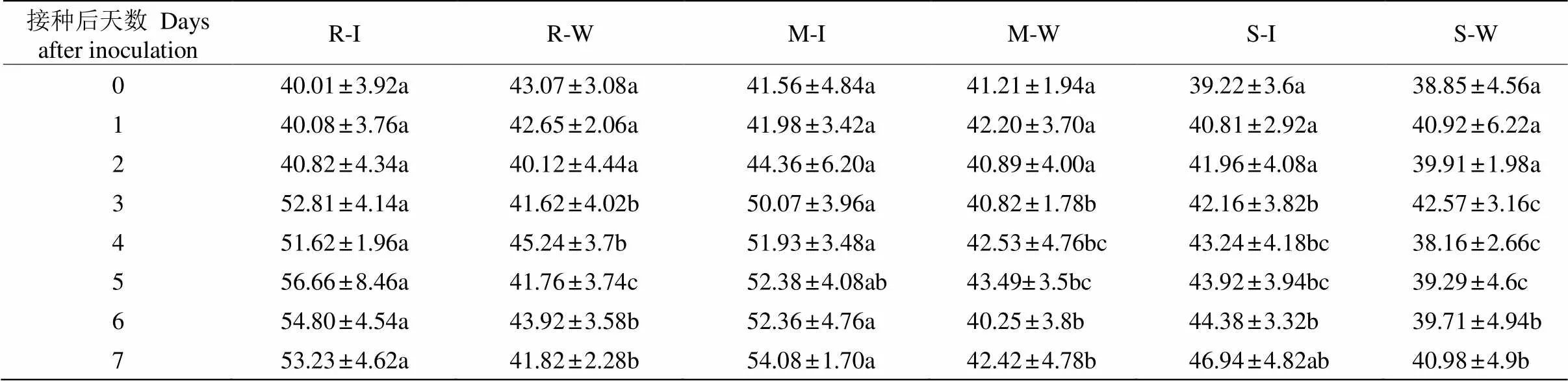
表4 短枝木麻黄接种青枯菌后黄酮含量(mg g–1)
接种青枯菌后1~2 d,高抗、中抗、易感种源间的黄酮含量差异不显著。接种后3~7 d,高抗种源的黄酮含量为51~57 mg g–1,均显著高于易感种源。这表明高抗短枝木麻黄受到青枯菌侵袭后,大量合成黄酮,起到抑制青枯菌的作用。
3 讨论
木麻黄受到青枯病菌侵袭后,体内生理生化物质会发生系统性变化。已有研究主要集中在少数或者单一无性系,极大地限制了木麻黄抗病育种工作的进展。同时由于病原菌不断发生变异,抗病品种选育和应用相对滞后,使得许多木麻黄林大面积染病死亡,急需新的抗病种质材料充实到沿海防护林带。本研究从种源层次解析短枝木麻黄抗性机制, 扩大了遗传资源筛选范围,对短枝木麻黄抗病选育提供了良好的理论基础。
林木抗病性是在长期演化过程中所形成的生物特性,根据抗性产生机制可以分为组成型抗性和诱导型抗性[20]。组成型抗性是植物不论受侵袭与否均产生与抗性有关的物质,诱导型抗性是植物所产生的一种更为主动的抗性反应方式,即在受到如病原菌等物的侵袭后,植物诱导产生一些物质来发挥防御作用[21]。本研究中,受到青枯菌侵袭后,高抗和易感短枝木麻黄的单宁和黄酮含量均会升高,高抗种源的单宁含量呈先升后降的变化趋势,黄酮含量呈S型增长趋势,而易感种源的单宁和黄酮含量均呈逐渐升高的变化趋势,但高抗种源中单宁和黄酮含量增幅高于易感种源,这表明短枝木麻黄受青枯菌侵袭后表现出诱导型抗性。因此,诱导产生的单宁和黄酮含量可以作为评价短枝木麻黄抗青枯病的生理指标。同时,不同种源单宁和黄酮含量峰值出现时间并不一致,为快速有效地鉴定短枝木麻黄抗病与否,需要进一步明确各抗性种质材料合成单宁和黄酮的阈值。
单宁和黄酮类化合物是多酚中的代表性成分,是短枝木麻黄受到病原菌侵袭后产生的两类重要次生代谢物质,来源于莽草酸途径和苯丙氨酸代谢途径,具有抑菌、抗氧化等多种功能,是植物体内主要的防御措施[22]。王翠颖等[16]报道抗病木麻黄无性系在接种青枯病菌前后的单宁含量均高于感病无性系。林秀琴等[23]在筛选木麻黄抗星天牛品系时,认为抗虫等级越高,植物体内的单宁和黄酮等次生代谢物含量越高。这与本研究结果基本一致, 但本研究中不同种源间短枝木麻黄的单宁和黄酮含量在接种当天或未接种时的差异不显著,这可能是由于不同种源短枝木麻黄遗传特性造成的。而受侵袭后抗感种源的单宁含量变化趋势不同则是因为某些基因差异表达的结果。
由于短枝木麻黄受到青枯病菌侵袭后会出现较长时间的潜伏期,因此本研究中采用高剂量菌液接种,以检测短枝木麻黄感病后的生理生化变化。但在野外,由于降雨充沛、人工干扰等因素影响, 短枝木麻黄并不会表现出枯萎死亡的病症,甚至出现部分枯萎植株逐渐恢复的情况。短枝木麻黄中的单宁和黄酮有组成型和诱导型两类,其中诱导型的单宁和黄酮主要是受到病原菌侵袭后产生的,二者的变化规律能够在一定程度上反映植物的抗性机理, 进一步研究其他防御物质的变化规律将有利于全面揭示抗性短枝木麻黄对青枯病的抗性机制。
[1] Zhong C L, Zhang Y, Chen Y, et al. Casuarina research and applications in China [J]. Symbiosis, 2010, 50(1/2): 107–114. doi: 10. 1007/s13199-009-0039-5.
[2] ZHONG C L, MANSOUR S, NAMBIAR-VEETIL M, et al.: A model tree for basic research in actinorhizal symbiosis [J]. J Bioscience, 2013, 38(4): 815–823. doi: 10.1007/s12038-013-9370-3.
[3] ZHANG Y, ZHONG C L, HAN Q, et al. Reproductive biology and breeding system in(Casuarinaceae): Impli- cation for genetic improvement [J]. Aust J Bot, 2016, 64(2): 120–128. doi: 10.1071/BT15184.
[4] QIAO J Q, CHEN Z Y, LIU Y Z, et al. Research progress on bacterial wilt of nightshade family [J]. Acta Phytopathol Sin, 2013, 43(1): 1–10. doi: 10.3969/j.issn.0412-0914.2013.01.001.乔俊卿, 陈志谊, 刘邮洲, 等. 茄科作物青枯病研究进展 [J]. 植物病理学报, 2013, 43(1): 1–10. doi: 10.3969/j.issn.0412-0914.2013.01.001.
[5] SALANOUBAT M, GENIN S, ARTIGUENAVE F, et al. Genome sequence of the plant pathogen[J]. Nature, 2002, 415(6871): 497–502. doi: 10.1038/415497a.
[6] HUANG G H, ZHONG C L, SU X H, et al. Genetic variation and structure of native and introduced(L. Johnson) provenances [J]. Silv Genet, 2009, 58(1/2/3/4/5/6): 79–85. doi: 10. 1515/sg-2009-0010.
[7] SUN T H, LI J, WANG T, et al. Difference in protein expression of apple leaves with different resistance response tof. sp.infection [J]. Acta Hort Sin, 2018, 45(3): 409–420. doi: 10.16420/j.issn.0513-353x.2017-0686.孙天骅, 李佳, 王涛, 等. 抗病与感病苹果叶片应答轮纹病菌侵染的蛋白质表达差异分析 [J]. 园艺学报, 2018, 45(3): 409–420. doi: 10.16420/j.issn.0513-353x.2017-0686.
[8] TENG T, CAO F X, WANG M, et al. Effects of pine wood nematode (PWN) infection on the activity of PAL and the content of phenols in the host pine [J]. J CS Univ For Technol, 2007, 27(3): 124–127. doi: 10. 3969/j.issn.1673-923X.2007.03.013.滕涛, 曹福祥, 王猛, 等. 松材线虫侵染对松树苯丙氨酸解氨酶及酚类物质的影响 [J]. 中南林业科技大学学报, 2007, 27(3): 124–127. doi: 10.3969/j.issn.1673-923X.2007.03.013.
[9] GUO H L, CHENG G W, CHEN J, et al. The function of phenolic metabolism in resistant mechanism of gray leaf spot of corn [J]. Acta Phytopathol Sin, 2003, 33(4): 342–346. doi: 10.3321/j.issn:0412-0914. 2003.04.012.郭红莲, 程根武, 陈捷, 等. 玉米灰斑病抗性反应中酚类物质代谢作用的研究 [J]. 植物病理学报, 2003, 33(4): 342–346. doi: 10.3321/ j.issn:0412-0914.2003.04.012.
[10] CHEN J, GAO H M, ZHU Y G, et al. Effect of phenols and its meta- bolism on activity cell wall degrading enzymes produced by[J]. Acta Phytopathol Sin, 1996, 26(2): 171–176. doi: 10.13926/j.cnki.apps.1996.02.019.陈捷, 高洪敏, 朱有釭, 等. 酚类物质和代谢对瓜果腐霉菌产生的细胞壁降解酶活性的影响 [J]. 植物病理学报, 1996, 26(2): 171–176. doi: 10.13926/j.cnki.apps.1996.02.019.
[11] HU F, KONG C H, XU X H, et al. Inhibitory effect of flavones fromon the major pathogens in citrus orchard [J]. Chin J Appl Ecol, 2002, 13(9): 1166–1168.胡飞, 孔垂华, 徐效华, 等. 胜红蓟黄酮类物质对柑桔园主要病原菌的抑制作用 [J]. 应用生态学报, 2002, 13(9): 1166–1168.
[12] WU Y H, ZHONG L J, ZHAO X X. Relationship among total phenol, flavonoid and PPO activity with the necrosis of tobacco infected by PVYN [J]. Acta Phytopathol Sin, 2007, 37(4): 398–402. doi: 10.3321/ j.issn:0412-0914.2007.04.010.吴元华, 钟丽娟, 赵秀香. 烟草感染PVY~N后叶脉坏死与总酚、类黄酮及PPO关系研究 [J]. 植物病理学报, 2007, 37(4): 398–402. doi: 10.3321/j.issn:0412-0914.2007.04.010.
[13] HUANG Q X, QU Y Y, YAO Z P, et al. Correlation between fusarium wilt resistance and expression levels of genes involved in flavonoid metabolism pathway inL. [J]. Acta Agron Sin, 2017, 43(12): 1791–1801. doi: 10.3724/SP.J.1006.2017.01791.黄启秀, 曲延英, 姚正培, 等. 海岛棉枯萎病抗性与类黄酮代谢途径基因表达量的相关性 [J]. 作物学报, 2017, 43(12): 1791–1801. doi: 10.3724/SP.J.1006.2017.01791.
[14] WANG S K, WANG J, XU D P. Comparison of four different DNA extraction methods ofin eucalyptus and sensi- tivity of PCR detection [J]. For Pest Dis, 2007, 26(5): 4–7. doi: 10. 3969/j.issn.1671-0886.2007.05.002.王胜坤, 王军, 徐大平. 四种桉树青枯菌DNA提取方法及PCR检测灵敏度比较 [J]. 中国森林病虫, 2007, 26(5): 4–7. doi: 10.3969/j. issn.1671-0886.2007.05.002.
[15] LIU Y, QIN X Y, LI W Z, et al. The resistance evaluation to bacterial wilt of tobacco germplasm in Yunnan Province [J]. J Plant Genet Resour, 2010, 11(1): 10–16.刘勇, 秦西云, 李文正, 等. 抗青枯病烟草种质资源在云南省的评价 [J]. 植物遗传资源学报, 2010, 11(1): 10–16.
[16] WANG C Y, SUN S, WANG J. Relationship between tannin content fromand their resistance to[J]. Shandong Chem Ind, 2015, 44(3): 77,82. doi: 10.3969/j. issn.1008-021X.2015.03.024.王翠颖, 孙思, 王军. 木麻黄抗感青枯病品系单宁含量差异 [J]. 山东化工, 2015, 44(3): 77, 82. doi: 10.3969/j.issn.1008-021X.2015. 03.024.
[17] WANG C Y, SUN S, ZHOU E X, et al. Purification of total flavonoids fromby macroporous adsorption resin & inhibition of total flavonoids on[J]. Prot For Sci Technol, 2012(1): 11–14,32. doi: 10.3969/j.issn.1005-5215.2012. 01.005.王翠颖, 孙思, 周而勋, 等. 大孔吸附树脂纯化木麻黄总黄酮及对青枯菌的抑制 [J]. 防护林科技, 2012(1): 11–14,32. doi: 10.3969/j. issn.1005-5215.2012.01.005.
[18] MAKKAR H P S, BLUMMEL M, BOROWY N K, et al. Gravimetric determination of tannins and their correlations with chemical and protein precipitation methods [J]. J Sci Food Agric, 2010, 61(2): 161– 165. doi: 10.1002/jsfa.2740610205.
[19] MAKKAR H P S. Quantification of Tannins in Tree and Shrub Foliage: A Laboratory Manual [M]. Netherlands: Springer, 2003: 53–54.
[20] WANG X S, YANG C L, WANG S S, et al. Changes of phenols and lignin contents in alfalfa leaf damaged by[J]. Chin J Appl Ecol, 2014, 25(6): 1688–1692.王小珊, 杨成霖, 王森山, 等. 牛角花齿蓟马为害后苜蓿叶酚类物质和木质素含量的变化 [J]. 应用生态学报, 2014, 25(6): 1688– 1692.
[21] WU Y Q, GUO Q Y. Potential resistance of tannins: Flavoniods in upland cotton against(Hübner) [J]. Acta Ecol Sin, 2001, 21(2): 286–289. doi: 10.3321/j.issn:1000-0933.2001.02.018.武予清, 郭予元. 棉花单宁: 黄酮类化合物对棉铃虫的抗性潜力 [J]. 生态学报, 2001, 21(2): 286–289. doi: 10.3321/j.issn:1000-0933. 2001.02.018.
[22] XU X Y, ZHANG W Q, HUANG Y H, et al. Comparison of identification methods of bacterial wilt resistance inand screening of resistant germplasm resources [J]. J S China Agric Univ, 2017, 38(4): 87–94. doi: 10.7671/j.issn.1001-411X.2017.04.015.许秀玉, 张卫强, 黄钰辉, 等. 木麻黄青枯病抗性鉴定方法比较及抗病种质筛选 [J]. 华南农业大学学报, 2017, 38(4): 87–94. doi: 10. 7671/j.issn.1001-411X.2017.04.015.
[23] LIN X Q, HUANG J S, CAI S P, et al. Correlation of inclusions contents of differentspp. strains and resistibility to[J]. J CS Univ For Technol, 2014, 34(5): 37–41. doi: 10.3969/j.issn.1673-923X.2014.05.008.林秀琴, 黄金水, 蔡守平, 等. 木麻黄内含物含量与对星天牛抗性关系的研究 [J]. 中南林业科技大学学报, 2014, 34(5): 37–41. doi: 10.3969/j.issn.1673-923X.2014.05.008.
Changes in Phenols Contents inProvenances with Different Resistibility Infected by
WEI Yong-cheng, ZHANG Yong, ZHONG Chong-lu*, MENG Jing-xiang, CHEN Zhen
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, China)
In order to understand the resistance mechanism of casuarinas () against, the changes in contents of tannin and phenols in casuarinas infected bywere analyzed. The results showed that the change trends of tannin and phenols contents in provenances with different resistibility were different. The contents of tannin and phenols in high- and media-resistant provenances increased at first and then decreased with the peak of 126 mg g–1, and the peak of media-resistant provenances came later. The susceptible provenances showed rising trend. After infected with, the condensed tannin content increased gradually in three provenances, and that in the high-resistant provenances were 70.33% higher than that in susceptible provenances. The content of flavone in resistant provenances showed S type rising trend, while that in susceptible provenances increased slowly. Therefore, it was demonstrated that there were different defense mechanisms between resistant and susceptible provenances. The greater the content of secondary compounds increase, the stronger bacteriostasis and antioxidant activities,would show higher resistance to bacterial wilt.
;; Inoculate; Tannin; Flavone
10.11926/jtsb.3983
2018-08-14
2018-09-21
中央级公益性科研院所基本科研业务费专项资金(CAFYBB2017QA007);广东省林业科技创新项目(2014KJCX017)资助
This work was supported by the Special Project for Basic Scientific Research of Central Public Welfare Institution (Grant No. CAFYBB2017QA007), and the Project for Forestry Science and Technology Innovation of Guangdong Province of China (Grant No. 2014KJCX017).
魏永成(1988~ ),男,博士,助理研究员,主要从事林木遗传改良研究。E-mail: yongcheng369@163.com
通信作者 Corresponding author.E-mail: zclritf@126.com

